

通过经典分子动力学和元动力学模拟,从分子间相互作用、二级结构、平均力势和自由能等方面研究了三种药物对肽细胞毒性的影响,以分析最适合治疗神经退行性疾病的药物。
背景介绍
β淀粉样肽(Aβ)是通过淀粉样前体蛋白的非典型膜内裂解形成的。当这些肽聚集形成了错误折叠和可溶的低聚物将会诱导细胞毒性,从而影响人类大脑中的许多重要功能。Aβ的聚集被认为与神经退行性疾病如阿尔茨海默病(AD)、帕金森病(PD)有病理相关性。
目前市面上被批准的药物仅用于改善或治疗由AD或PD引起的症状,治标不治本。随着人口老龄化的加重,相关药物的研发变得十分紧迫。
他汀类药物阿托伐他汀、洛伐他汀以及克罗莫林均被发现具有一定的抗Aβ毒性的效果,但没有研究者对它们进行进一步的分析和比对。在AD和PD患者的大脑中发现的许多肽均属于Aβ(1-43)序列,但毒性并不相同。其中,毒性最大的部分是(25-35),它可以在数小时内聚集,并仍保留Aβ(1-43)全长肽的毒性。此外,Aβ(31-35) 也会引起细胞毒性。有研究发现,这两个肽引起毒性的机制不同,Aβ(31-35)通过凋亡机制起作用,而Aβ(25-35)则通过附着细胞数诱导神经毒性。另外,肽末端的MET35氨基酸也被认为与毒性相关。
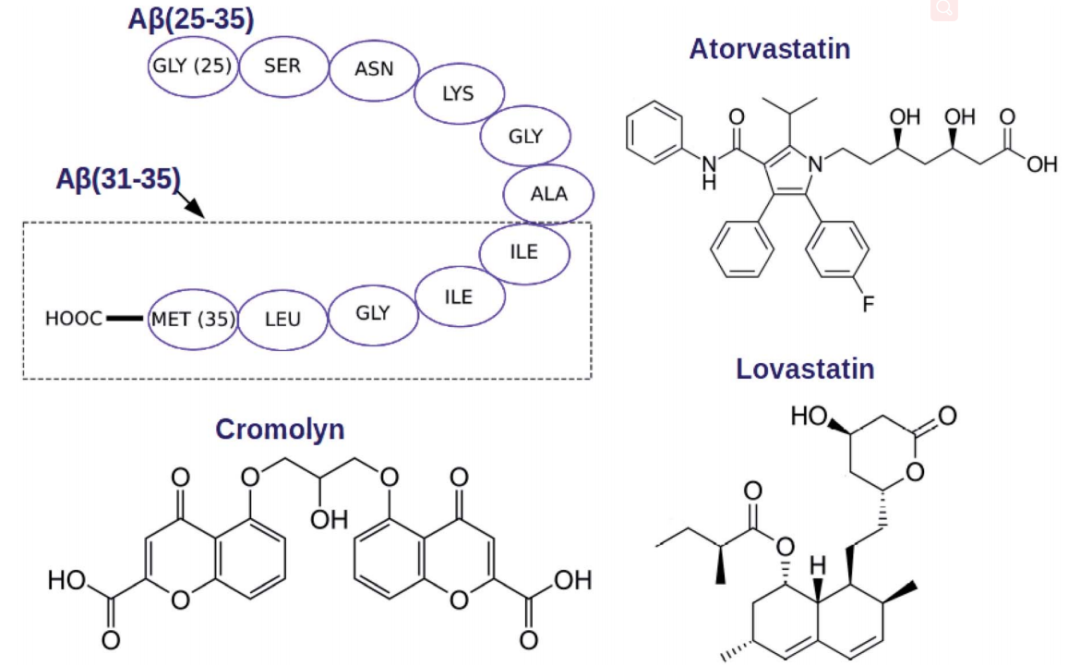
图1. 参与模拟研究的分子。图片来源:RCS Advance
实验结果
分子间相互作用的表征
研究者计算了分子质心之间的径向分布函数(RDFs),以研究肽间是否有聚集的迹象。在短距离(1nm以下)中RDF(g(r))高于1可表示分子之间存在联系。
数据显示,阿托伐他汀可以促进Aβ(31-35)和Aβ(25-35)在六分子的体系中聚集。对于含有8个Aβ(31-35)分子的体系,阿托伐他汀则表现为肽聚集抑制剂。克罗莫林和洛伐他汀则在所有的体系中都减少肽聚集。
在药物分子混合或没混合肽的体系中,克罗莫林均表现出最高聚集倾向。对比含有6个肽的体系,Aβ(31-35)存在的情况下,药物比Aβ(25-35)的模拟中聚集得更多。8个肽分子的体系中,肽的存在减少了所有被研究的药物分子的聚集。因此,根据目前提供的数据,作者得出结论:药物和肽的聚集是相互关联的。然而Aβ(25-35)、Aβ(31-35)和药物都是大分子,它们的质心坐标可以根据分子的构象而变化。因此,RDF计算数据只是初步的证明。
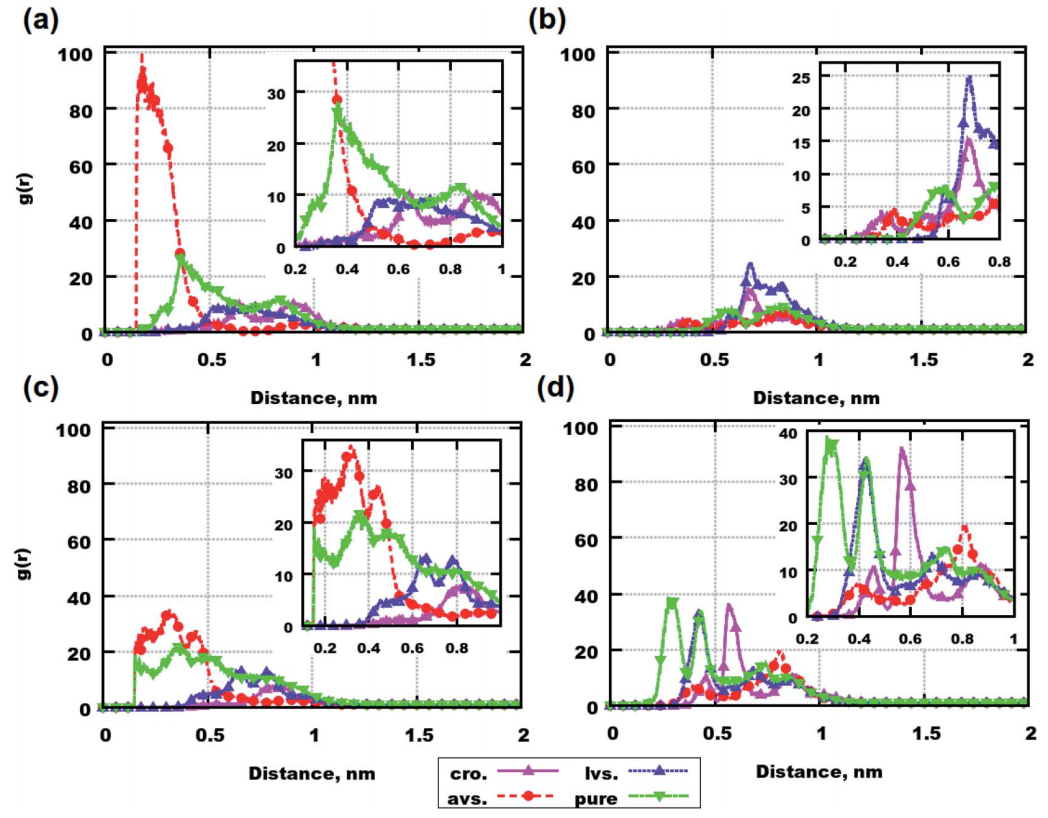
图2. 肽分子质心之间的径向分布函数(RDF)。图片来源:RCS Advance
另一种补充分子间相互作用研究的方法是计算体系中氢键的数量和分子间接触的数量。表1A显示了包含6个肽和药物分子的体系的氢键的平均数。对于Aβ(25-35),氢键的数量并不因药物的存在而有很大的变化。但是氢键并非聚集的唯一指标。药物的存在会影响肽的水合作用。在Aβ与阿托伐他汀或克罗莫林的体系中,水和肽间的氢键少于单纯的Aβ以及肽与洛伐他汀的体系。研究者对疏水部分的相互作用也进行了计算,阿托伐他汀最能减少Aβ的肽间和肽内接触数量。其次为洛伐他汀,最后为克罗莫林。Aβ(31-35)的体系中,药物的存在并未表现出明显的对接触的影响。
表1. 计算体系中分子之间/内的氢键数(A六分子体系.B 八分子体系)表格来源:RCS Advance
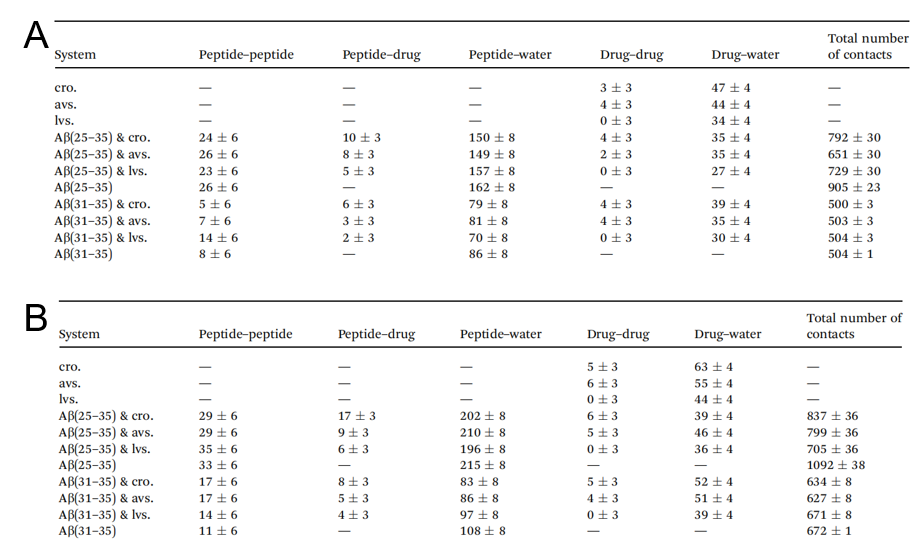
表1B所示, Aβ(25-35)体系中,阿托伐他汀和克罗莫林抑制肽内氢键,洛伐他汀则促进。肽-药间氢键的趋势则与6个分子的体系一致。水分子与肽的结合在与阿托伐他汀的体系中结合最多,与洛伐他汀的模拟体系中结合最少。在与洛伐他汀的体系中,肽间的接触最少。
Aβ(31-35)的体系中,药物存在时的肽间氢键数量要比肽单独存在时多。在克罗莫林存在时,肽-水分子间氢键最少,而克罗莫林自身与Aβ结合最多。阿托伐他汀和克罗莫林减少了整体的肽-肽相互作用数量,而洛伐他汀不影响肽分离。
图3显示了6个肽和/或药物分子的模拟系统。所有的药物分子都有在水中形成聚集的倾向,但只有Aβ(25-35)在没有任何药物的情况下聚集,与实验结果一致。此外,两种肽都有聚集在药物簇周围的趋势。当肽位于同一药物簇表面时,其RDF可显示在此处聚集,因为质心彼此靠近。“收集”细胞毒性Aβ肽的能力可被认为是一种抗神经退行性疾病药物的良好特性,因为这些肽聚集物被周围的药物分子抑制,不能进一步生长。
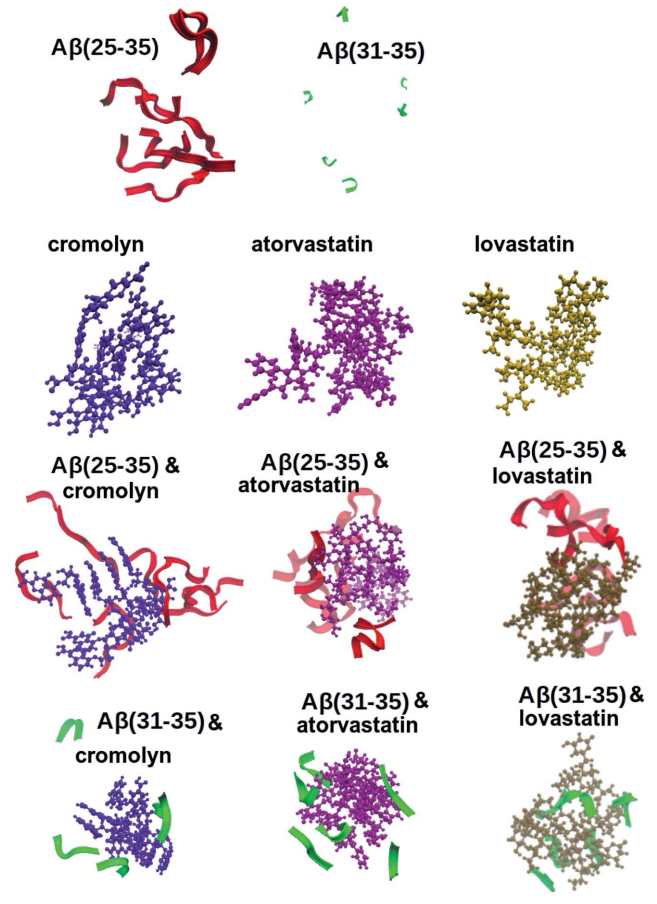
图3.包含6个药物分子和6个分子Aβ(25-35)/Aβ(31-35)的模拟系统。图片来源:RCS Advance
细胞毒性不仅与肽聚集有关。计算和实验研究都证明,Aβ(31-35)是不会形成聚簇的肽。氨基酸残基MET35的存在及其位置被认为是Aβ(25-35)和Aβ(31-35)毒性的原因。
图4演示了氨基酸残基之间的接触总数如何随药物分子的存在而变化。在六分子模拟体系中,阿托伐他汀是模拟浓度下最有潜力分离Aβ(25-35)的药物。此外,在与阿托伐他汀的混合物中,MET35的接触总数明显小于与其他两种药物。
在八分子体系中,洛伐他汀对Aβ(25-35)的分离效果更明显,与表2的数据类似。此外,阿托伐他汀与MET35的接触总数低于其他两种药物。
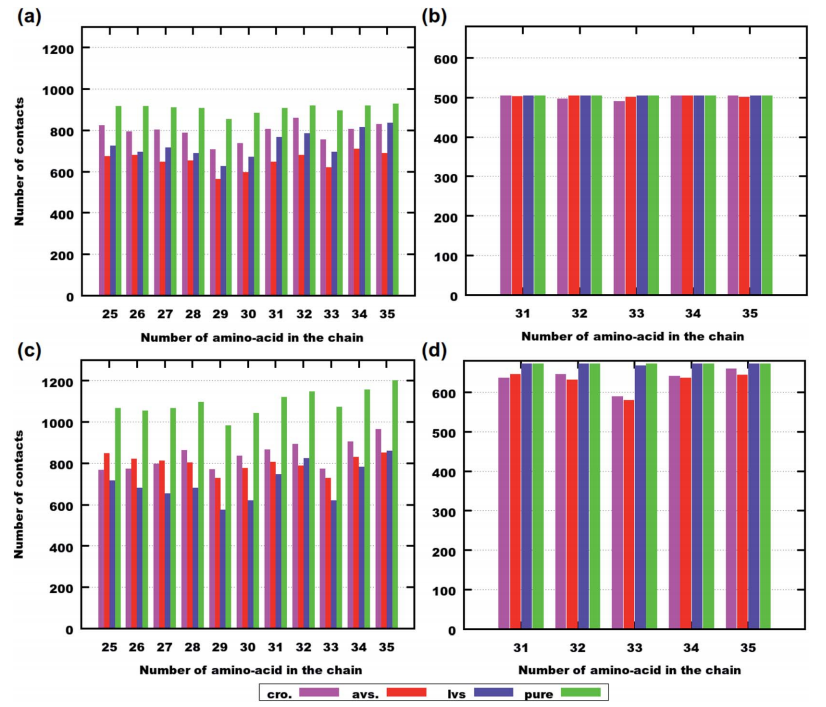
图4. 最后250ns的模拟中氨基酸残基与其他肽的接触次数。图片来源:RCS Advance
图5为MET35与药物分子之间质心的RDF。在Aβ(25-35)的6分子系统中,克罗莫林显示出与MET35的联系最强。在Aβ(31-35)的6分子模拟系统中,阿托伐他汀与MET35的结合略强于克罗莫林。在8分子Aβ(25-35)体系中,阿托伐他汀与MET35的结合明显最强。在8分子Aβ(31-35)体系中,克罗莫林与MET35结合最强,阿托伐他汀和洛伐他汀则更弱。这可能与药物的聚集相关。
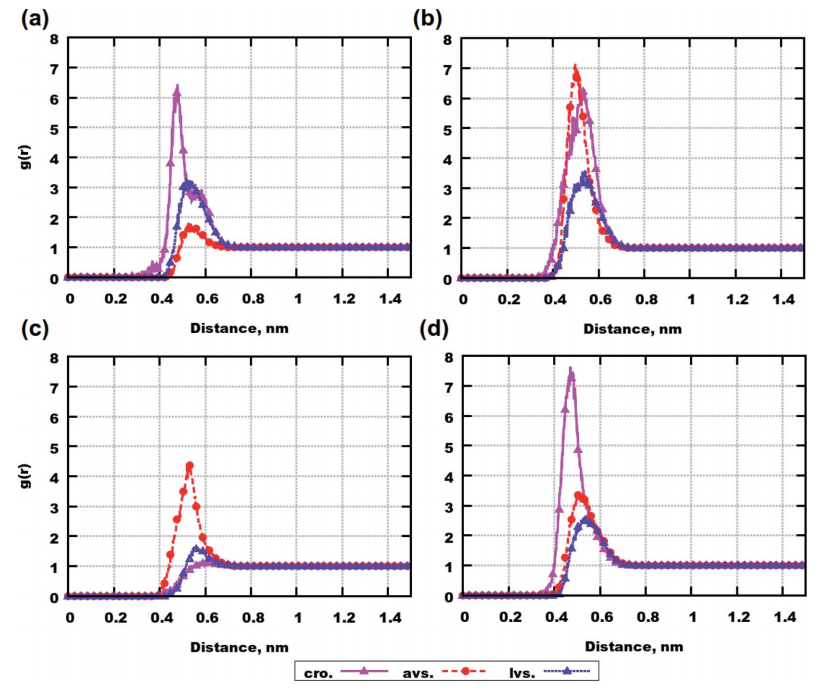
图5. MET35与药物之间分子质心的径向分布函数。图片来源:RCS Advance
多肽的二级结构
蛋白质和肽的二级结构明显影响着它们在生物细胞中的功能。分子构象也在聚集、与某些分子结合等特征中发挥作用。
在Aβ(25-35)的模拟中,有些结构(如β-桥)与聚集相关,且数量很大。对于Aβ(31-35),二级结构的分布有明显的差异,但也能看出二级结构与聚集的关系。尽管二级结构的改变会影响到聚集,但是很难从中获取候选药物最佳选择的信息,只能得出每个药物都会影响肽二级结构的结论。
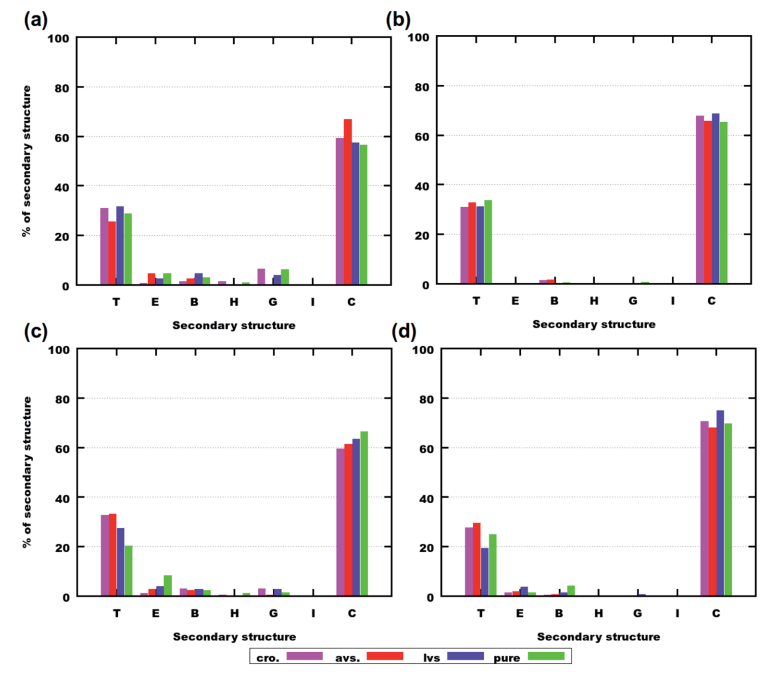
图6. 使用VMD软件计算的最后250ns模拟中二级结构的数量。图片来源:RCS Advance
平均力势和自由能
随后作者进行了自由能的计算,为肽的聚集过程提供了热力学上的见解。自由能越低,分子聚集的可能性越高。这种结合可能性也能从平均力势(PMF)看出:短距离上曲线在零值以下的深度越低,聚集的概率就越高。
结果表明(图7),克罗莫林最能促进Aβ(25-35)肽间的结合,洛伐他汀则表现出抑制效果。对于Aβ(31-35)来说,趋势类似,只是克罗莫林效果稍弱一些。
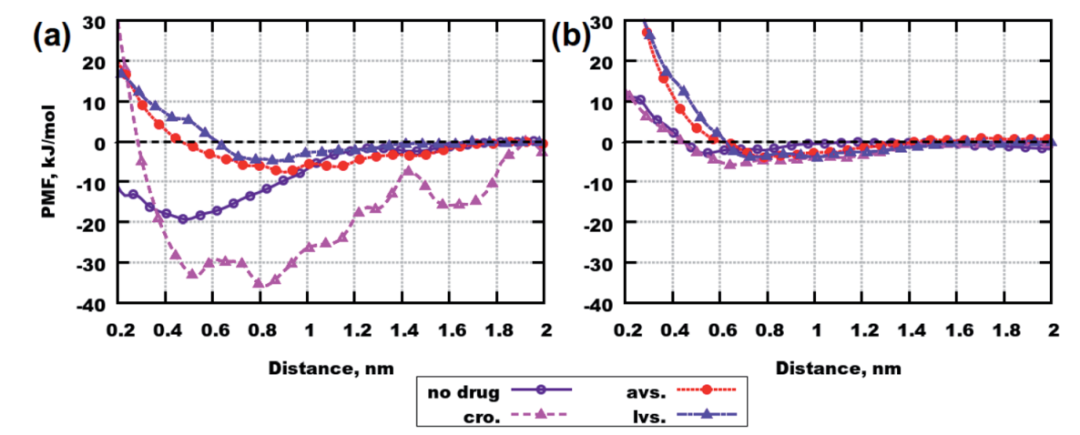
图7. PMF曲线。图片来源:RCS Advance
候选药物评分及选择
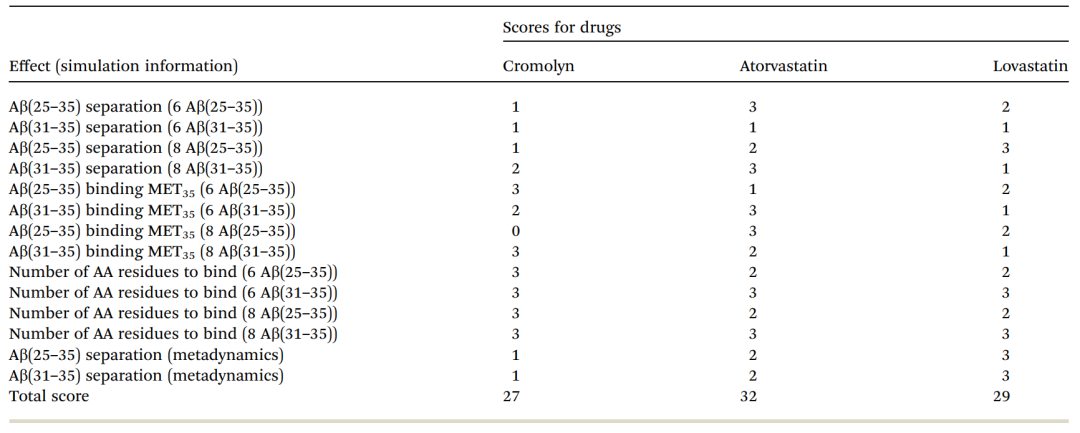
多肽的细胞毒性是一种复杂的现象。确定一种潜在的候选药物并不是一个简单的过程,不能主要基于其抗聚集性。比如Aβ(31-35)有毒性,但不成簇。文章也从各个方面讨论了毒性相关的问题,并将各方面进行评分比较,以选出最优候选药物。候选药物各方面评分如表2。
阿托伐他汀获得了最高的综合得分,但是其难以透过血脑屏障,洛伐他汀则可以。因此,综合来说,洛伐他汀为最佳候选药物。
另外,MD模拟时在不同分子体系中的影响也提醒研究者,浓度的微小变化可能会造成药物对肽行为的不同影响,需要在体外、体内或临床研究中考虑到浓度影响的问题。
表2. 药物对肽的细胞毒性作用比较。表格来源:RCS Advance
结论
本文通过经典分子动力学和元动力学模拟,研究了克罗莫林、阿托伐他汀和洛伐他汀对Aβ肽细胞毒性的可能的有效机制。计算结果表明,最好的候选药物是洛伐他汀。该药物抑制肽聚集,在药物簇表面吸附肽,改变其二级结构并与结合于MET35。此外,洛伐他汀也是一种具有最强穿透血脑屏障能力的药物,使其成为三种研究药物中最有前途的药物。研究为后续的抗神经退行性疾病药物的开发奠定了基础。
参考文献
Blomgren F, Rodin A, Chrobak W, Pacut DW, Swenson J, Ermilova I. Two statins and cromolyn as possible drugs against the cytotoxicity of Aβ(31-35) and Aβ(25-35) peptides: a comparative study by advanced computer simulation methods. RSC Adv. 2022 May 4;12(21):13352-13366. doi: 10.1039/d2ra01963a. PMID: 35520132; PMCID: PMC9066867.