中大唯信提供专业的抗体人源化设计服务,详询客服。
自从首个单克隆抗体muromonab(OKT3)被批用于临床治疗以来,治疗性抗体的开发经历了鼠源抗体、嵌合抗体、人源化抗体、全人源抗体的几个发展阶段。近年来,随着全人源噬菌体展示文库技术以及人源化转基因小鼠技术的发展,全人源抗体在临床上得到越来越多的运用。然而,由于技术可及性及成熟性,成本控制,成药性等方面的原因,目前人源化抗体仍然占据了市场上单克隆抗体的40%以上(图1)。通过免疫小鼠获得高亲和力和生理活性的杂交瘤单抗,再通过抗体可变区基因克隆获得其蛋白序列,进而通过抗体的人源化改造获得人源化抗体,仍然是目前治疗性抗体发现的常规策略。由于抗体人源化的改造涉及抗体氨基酸序列甚至结构的变化,使用计算机辅助药物设计技术进行基于结构的抗体人源化设计,可以在人源化过程中既保持或基本保持其鼠抗或嵌合抗体形式对抗原的亲和力,特异性,生理学活性,又同时不影响其药物可开发性(developability, 通常表现为表达水平,理化性质,稳定性等)。
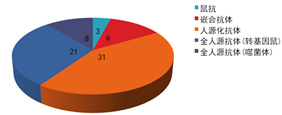
图1. 不同程度人源化抗体在上市药物中的占比(数据截至2018年9月)
抗体可变区的序列编号系统,CDR定义以及基本结构特征
由于抗体人源化的过程伴随着抗体序列和结构特别是重轻链可变区的分析和改造,在介绍人源化改造策略之前,我们有必要来认识一下抗体可变区序列和结构的基本特征,这些特征同时也是抗体文库构建,体外亲和力成熟等其他抗体工程学改造的基础。
抗体可变区基因由免疫球蛋白基因V, D, J片段经过VDJ重排而来(对于轻链是VJ重排),其中V基因编码了抗体可变区N端起始到CDR3前的大部分区域(轻链V基因还编码部分CDR3),CDR3通常由D基因和J基因共同编码(对于轻链CDR3是V基因和J基因共同编码),J基因则编码了CDR3的C端以及FR4的部分。对于人免疫球蛋白VDJ胚系基因的具体编码序列,可进一步查阅Vbase数据库(http://www2.mrc-lmb.cam.ac.uk/vbase/)。
抗体可变区(VH或VL,包括前述VDJ基因组成的部分)通常分为框架区(framework)和互补决定区(complementarity-determining region,CDR),其中CDR区又被称为超可变区(hypervariable region)。目前通常认为CDR区参与了抗原-抗体的结合作用,但在历史上,CDR区的鉴定是通过比对一系列抗体序列,通过比较其可变程度来确定的。同时,由于抗体可变区特别是CDR区不但存在序列的差异,也存在长度的差异,如果按常规方法对抗体按数字顺序编号,会出现保守的同一个位点在不同抗体中编号位数不一致的情况。为了克服这一问题,Kabat等最早通过比较大量的抗体可变区序列,发明了经典的Kabat氨基酸序列编号系统和CDR定义系统,这种系统通过在长度可变区域的氨基酸位数引入a, b, c等字母标识的方法,保证了保守的氨基酸位点在不同的抗体中具有一致性。其他常用的类似的CDR定义和编号系统包括IMGT系统,Chothia系统等。以Pembrolizumab(Keytruda)抗体重链可变区为例,CDR区以及氨基酸编号标识如下(图2):

图2. 抗体CDR区标注以及氨基酸序列编号
从结构上看,抗体可变区由9个β strand组成两个β sheet,同时每个strand之间由loop结构连接,而三个CDR的位置总体上与loop BC,loop C’C”以及loop FG对应 (图3)。值得注意的是,如上所述,由于CDR最早是基于序列可变性的定义,这种结构生物学上的loop结构与CDR区并非完全对应,且不同CDR定义系统中CDR与loop结构的一致性程度不同。
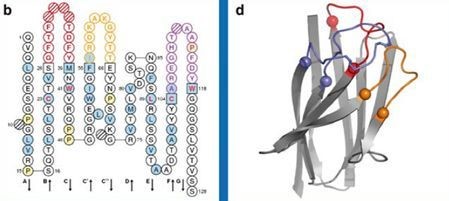
图3. 抗体可变区β strand的结构示意图(AntibodyEngineering, Volume 2, Springer Protocols, 2010)
进一步研究抗原抗体复合物结构发现大概只有三分之一的CDR区域的氨基酸残基直接参与了与抗原的结合,而这部分氨基酸序列的变化程度相较CDR其他部分更高,人们把这部分氨基酸残基叫做特异性决定残基(Specificity-Determine Residue),把包含这些SDR的区域命名为小型CDR(abbreviated-CDRs,aCDRs)。对于Chothia CDR系统,其hypervariable loop(HV),CDR以及aCDR的相对关系如下图所示(图4):
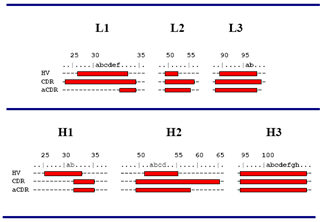
图4 HV loop, CDR以及aCDR相对位置示意图(Chothia编号系统)
Chothia等人进一步的研究发现,除了CDRH3以外的五个CDR其在序列和结构上呈现一些固定的特点,表现为相对于某一特定的CDR长度,其在CDR或Framework区有一些保守的位点,这些位点通常为几种固定类型的氨基酸残基,这些残基对于维持CDR/loop区的构象是比较重要的,这些固定类型的结构被称为抗体的Canonical Structure。另外,Foote 和 Winter等人的研究也发现,在CDR毗邻区域存在一些起到支撑起CDR/loop区域的一些关键氨基酸,其中重链可变区16个,轻链可变区14个,这些区域被命名为Vernier Zone。Vernier Zone与Chothia等人鉴定的Canonical Structure残基在一定程度上有重叠。在重链可变区和轻链可变区,CDR,aCDR,hypervariable loop,Canonical Structure Residues, Vernier Zone等区域的位置如下图(图5,6)所示:
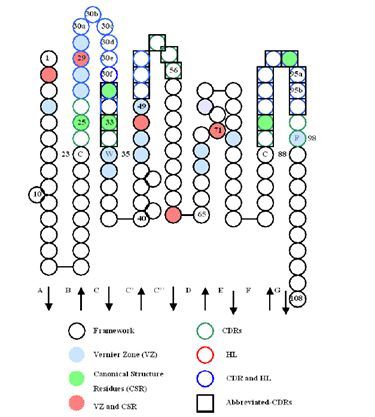
图5 轻链可变区CDR及其他结构相关位点示意图
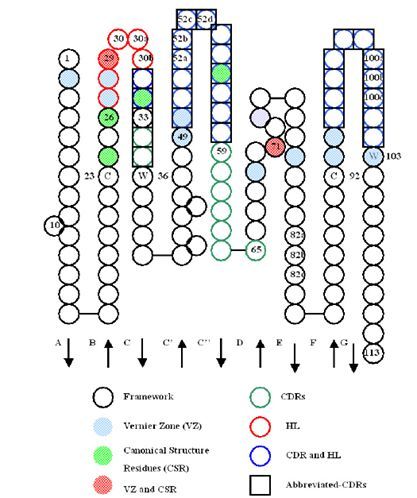
图6 重链可变区CDR及其他结构相关位点示意图
CDR移植:最为常见和成熟的人源化改造策略
如上文所述,既然CDR区域主要参与抗体与抗原的相互作用,那最常规的人源化思路就是把这些决定抗原-抗体相互作用的CDR区域移植人的Framework区域中去,从而降低鼠抗在人体中产生的免疫原性。CDR移植的方法最早由2018年诺贝尔化学奖得主Greg Winter团队在20世纪80年代后期提出,经过几十年的发展,该技术目前已经相对成熟,也是目前业界使用最为广泛,最为认可的人源化策略。
基于CDR移植的人源化策略主要分为以下几个步骤:1) 选定移植区域;2) 选定合适的Framework供体(有时候也叫做Framework受体);3) 对影响抗体结构和功能的关键氨基酸进行回复突变。下文将从这三个方面对该策略进行展开论述。
选定移植区域
抗体人源化项目开展之前最理想的方式是得到抗体-抗原复合物的晶体结构,这有助于理性地分析哪些区域参与了抗原-抗体的相互作用,从而选定这些区域作为CDR移植的供体。但遗憾的是,大绝大多数情况下,这种结构信息通常是不存在的。对于这种情况,通常采用全部六个CDR区作为移植的供体。如前所述,由于CDR是最早是基于序列的定义,其在结构上与参与抗原-抗体相互作用的loop区有重叠但并非完全一致,而不同方法定义的CDR区域也有所不同,此时可以结合结构信息,综合选定所要移植的区域。对于一个已知序列未知结构的抗体,目前有很多商业化软件(如MOE, Schrodinger/Bioluminate等)可以提供抗体结构的同源建模分析。
如上所述,如果项目对人源化程度/免疫原性比较在意,希望尽量少地移植鼠抗序列,那可以考虑只进行SDR而非CDR的移植。或者通过突变体结合实验,证明某些CDR可能并不参与抗原抗体的相互作用,从而只移植部分CDR区域,这些方法都成功的案例报道。
选定Framework供体
在CDR移植技术的发展过程中,人们对于供体Framework的选定有不同的方法。人们最早采用直接把鼠源CDR移植到一些已知结构的人源抗体中,其中并不考虑鼠源抗体与人源抗体在序列上的同源性。但是这种方法得到的移植后抗体往往亲和力较鼠抗或嵌合抗体有明显的下降。这使人们认识到不同人源抗体Framework对被移植的CDR结构的支持作用是不一样的。进而人们考虑选择与鼠抗同源性较高的人抗体Framework序列作为移植供体,这种方法被称为Best Fit策略。如前所述,除了比较序列一级结构的同源性,可以在选定供体Framework的时候就考虑其与被移植抗体在Canonical结构上的一致性,这往往有助于CDR loop结构的维持与抗原-抗体亲和力的保持。也有人在供体Framework序列中不考虑Framework的同源性,而是考虑CDR区域的同源性,这也是基于选定的Framework序列能够较好地支持CDR结构的考虑。
关于Framework序列的来源有两种,一种是发表的人源或人源化抗体序列,这些序列可以通过PDB, IMGT等数据库获得,但是这些人源序列往往已经经历体细胞高频突变过程,其Framework区已经积累一些突变,这些突变对于候选抗体可能是无益且存在免疫原性风险的。第二种来源是未成熟的人胚系基因(germline gene),这些基因未经体细胞高频突变,理论上产生免疫原性的可能性更低。另外,也有研究表明,相对于体细胞成熟的抗体,germline序列作为Framework能够给CDR区域提供更好的柔性,使得被移植的CDR结构能够更好地保持。目前人们更多地使用germline gene framework而非成熟抗体framework作为移植的Framework供体。
确定回复突变位点
CDR移植后的抗体通常其亲和力会发生降低,这可能是由于前述的一些支撑CDR结构的关键位点在人源化的过程中发生了改变。为了恢复抗体的结合和生理活性,往往需要对CDR移植后的抗体进行关键氨基酸的回复突变,保留其鼠源序列。在此过程中,往往需要考虑亲和力/功能/可开发性等与免疫原性/人源化程度的平衡。对于不同的项目,其所需要的回复突变数量不尽相同,而其中的突变位点的选择也十分关键。如前所述,抗体中存在的Canonical Structure与Vernier Zone等区域的氨基酸可能对于维持CDR loop结构非常重要,如果在人源化过程中,这些残基发生了突变,可能对其结构和活性的维持具有重要影响,因此这些关键的氨基酸位点通常是给予首先考虑进行回复突变的。另外,Framework内部与CDR区域在空间上比较近的区域,比如通常认为5A或3A以内的Framework氨基酸,可能对与CDR区域存在分子内相互作用,或者直接参与了与抗原的相互作用,这些氨基酸如果在人源化过程中被突变,也可以纳入回复突变的候选位点。通过抗体已知或建模结构的分析,综合不同级别优先性的重轻链回复突变,再对这些不同回复突变的突变体进行重轻链的棋盘式组合,可以筛选到回复突变较少,而亲和力/生理功能/可开发性符合项目预期的药物候选分子。
利用表面重塑技术(Resurfacing)进行抗体的人源化
表面重塑技术(Resurfacing)是除了CDR移植外一个比较常见的策略,其设计思路与CDR移植类似,但是在选定突变位点的时候只考虑将处于抗体结构表面的氨基酸人源化,而将位于抗体结构内部的氨基酸维持其鼠源抗体序列。这在很大程度上减少了人源化过程中所需要突变的氨基酸数量,从而有助于抗体保持其抗原亲和力及生理功能。这种设计的原理是考虑ADA产生的过程中,需要B细胞通过BCR来识别抗体表面的B cell epitope,而其内部的鼠源序列因为没有暴露而不会被B细胞识别从而产生ADA反应。尽管如此,Resurfacing技术由于案例有限,其临床安全性和免疫原性有待于进一步评估。
利用Framework library进行抗体的人源化候选分子的筛选
这种技术是将CDR移植技术与噬菌体文库技术相结合,在某些与维持CDR结构紧密相关的氨基酸位点,如前述Vernier Zone等区域进行随机化文库构建,利用噬菌体淘选(panning)技术,淘选出了与靶抗原具有高亲和力的人源化突变体作为药物候选分子。
利用Chain Reshuffling技术进行抗体的人源化
这种人源化技术也叫guided selection,其已经成功运用于TNFa抗体Humira的人源化过程中。这个方法也是Greg Winter教授团队最早开发,其思路是先将鼠抗的重链可变区VH固定,构建人轻链shuffling文库,通过噬菌体文库技术筛选出与TNFa能够维持高亲和力的候选分子,进而选定此候选分子的VL序列,构建人重链shuffling文库,筛选得到重轻链全被替换成人源抗体的药物候选分子。
利用HSC(Human String Content)打分系统进行抗体人源化
此方法由Lazar等人最先提出,其核心的观点认为鼠抗内存在的能够与人抗原提呈细胞表面MHC II分子相结合并被T细胞TCR所识别的线性T细胞表位对于ADA的产生起到决定性作用,而常规的CDR移植过程中,尽管Framework区大部分被替换为人germline序列,但是其CDR区域以及CDR-Framework交界区域存在的潜在T细胞表位被忽视从而产生抗体药物的免疫原性。而HSC打分算法就将抗体的这种T细胞表位进行整体评分,评分越高代表其T细胞表位越少,人源性更高,而人源化的设计过程是通过突变来提高其HSC打分从而降低其免疫原性。
总结
抗体的免疫原性一直是业界比较关注的热点问题,尽管免疫原性的产生与抗体人源化程度不一定具有完全相关性,如抗体后续开发工艺和质量标准(如aggregation),不同适应症病人免疫亢奋状态等都会影响临床上ADA的产生,但是在早期开发阶段尽可能地提高抗体的人源化程度是目前业界的共识。而如何进行人源化策略的选择对于保持抗体的功能和成药性都具有十分重要的影响。目前来看,CDR移植仍然是最为通用和被广泛接受的人源化策略。利用基于结构的药物设计技术可以快速精确地进行设计,从而加速抗体药物的研发进程。
参考文献
- Almagro J C, Fransson J. Humanization of antibodies[J]. Front Biosci, 2008, 13(1): 1619-1633.
- Safdari Y, Farajnia S, Asgharzadeh M, et al. Antibody humanization methods–a review and update[J]. Biotechnology and Genetic Engineering Reviews, 2013, 29(2): 175-186.
- Ahmadzadeh V, Farajnia S, Feizi M A H, et al. Antibody humanization methods for development of therapeutic applications[J]. Monoclonal antibodies in immunodiagnosis and immunotherapy, 2014, 33(2): 67-73.
- Lazar G A, Desjarlais J R, Jacinto J, et al. A molecular immunology approach to antibody humanization and functional optimization[J]. Molecular immunology, 2007, 44(8): 1986-1998.
- Antibody Engineering, Volume 1&2 (secondedition), edited by Roland Kontermannand Stefan Dübel, Springer Protocols(2010).