

SARS-CoV-2的突变体是如何影响RBD-ACE2复合物的形成的呢?原子力显微镜和分子动力学模拟揭示了关于SARS-CoV-2突变体结合的原子细节,为了解病毒突变对感染诱导免疫的影响提供了见解。
背景介绍
目前世界上已经开发了几种有效预防COVID-19的疫苗,但是突变的SARS-CoV-2不断出现,迅速传播的突变体表明这种病毒可以轻松适应其刺突蛋白(S蛋白)的抗原变化,而不失去任何适应能力。目前几乎所有与病毒复制的分子和细胞细节、病理和毒性相关的机制认识都是通过早期SARS-Cov原型产生的。
一些SARS-Cov-2的突变负责大型构象变化,可能会加重感染,另一些位于受体结合基序(RBM)的突变增强了对ACE2受体的识别,并影响单克隆抗体(mAb)的中和效率。
RBM是位于SARS-CoV-2三聚体刺突顶部的受体结合域(RBD)的一部分(图1a, b),是目前使用的COVID-19疫苗诱导的中和抗体的主要靶点。RBM作为病毒的主要受体,负责结合血管紧张素转换酶2 (ACE2)。但RBM对突变非常耐受(图1c),许多突变并不影响甚至增强与人ACE2受体的结合,可能对抗体识别有害。例如,N501Y,出现在Alpha、Beta和Gamma变体中,增加了ACE2结合。这种RBM抗原变异造成礼来公司的bamlanivimab单抗从治疗COVID-19患者的单药紧急使用批准中撤出,因为带有E484K/Q突变的VoCs已经耐药。
文中,作者利用原子力显微镜结合分子动力学,在原子水平上更好地了解刺突蛋白突变对刺突-受体相互作用的影响以及它对抗体抑制作用的影响,对后期的研究至关重要。
VoCs RBD与ACE2具有强结合
为了检测受关注的SARS-CoV-2变种(VoCs)是否以更高的亲和力结合ACE2,作者使用基于力曲线(FD-curve)的原子力显微镜(AFM),将纯化的Alpha-、Beta-、Gamma-和Kappa-RBD的结合与WT-RBD的结合进行了比较(图1d)。为了研究结合潜力,RBD修饰的尖端被循环接近并从ACE2表面缩回。对作用于功能化尖端和表面之间的力的变化进行监测,产生的力与时间的曲线如图1e所示。观察到的较高的结合频率表明,与WT相比,VoCs与ACE2的结合更容易,与观察到VoCs的较高的传播率一致。
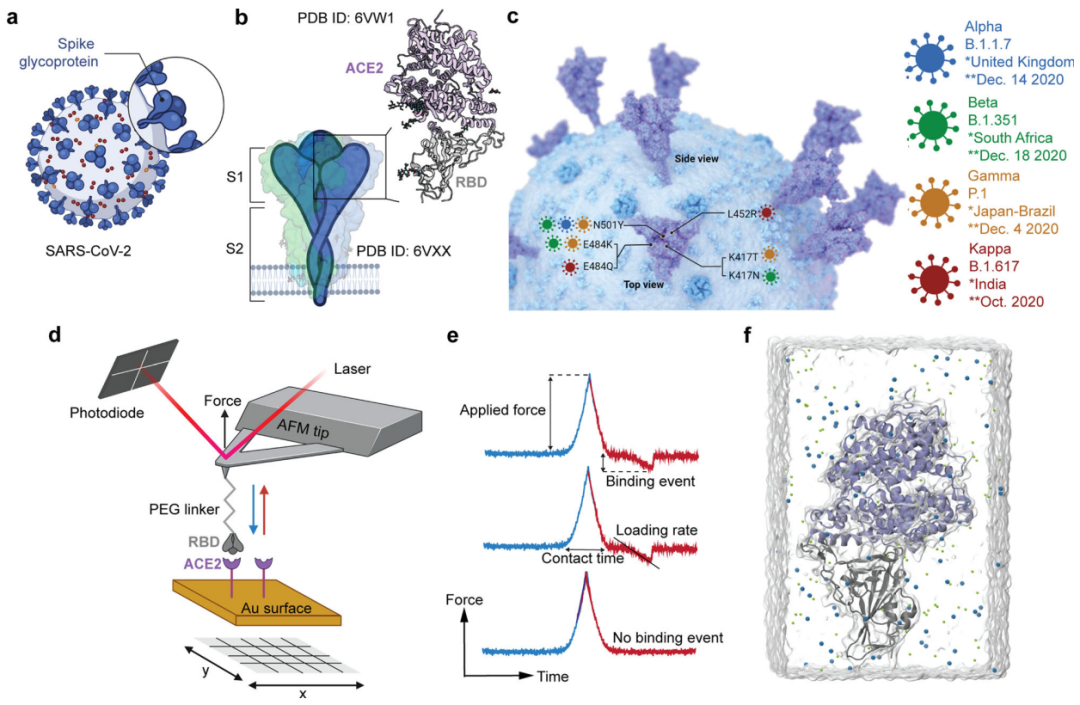
图1. 通过原子力显微镜和分子动力学模拟对SARS-CoV-2突变体与ACE宿主受体的结合进行量化。 图片来源:Nat. Commun.
VoCs-RBD-ACE2的热力学
使用基于FD的 AFM,作者通过对键施加外力(F)来测量RBD-ACE2配合物的结合强度,并使用Bell−Evans模型提取了相互作用的动力学性质,以预测配体-受体键的结合强度与加载速率的对数之间的线性关系(LR为随时间推移,键上的力负荷)。对不同LRs下测量的力进行了分析 (图2b-f)。在WT-RBD或VoCs-RBD与ACE2受体相互作用时,发现都与过渡态的距离相似,表明在这些条件下结合口袋的几何形状/位置相似。
当解离率减小到零时,检测到Gamma-RBD Koff最小,其次为Kappa。接着从 Koff(τ=Koff−1)计算单分子键的寿命τ。作者观察到William-Evans预测的与记录的单分子数据之间有良好的相关性。这一观察结果强调了病毒粒子在附着于细胞表面受体过程中的重要作用。病毒粒子上高密度的RBD有利于形成多个键,从而增强病毒−宿主相互作用的表观寿命。
在单分子水平上,通过复合物的解离常数KD可以得到更准确的整体键寿命图。例如,高亲和相互作用的寿命较长,因为KD被定义为Koff与复合物形成的动力学速率(kon)之比。实验中,假设受体键复合物的形成可以用伪一级动力学近似,kon可以从不同保持时间测量的结合频率(BF)中提取(图2b-f,右图)。计算的平衡解离常数KD(koff/kon):Gamma (KD=21±16nM) < Kappa (KD=71±31nM) ≤ Beta (KD=80±49nM) ≈ Alpha (KD=129±81nM) ≈ WT (KD=134±81nM)。KD对应于高亲和力的相互作用,证实了SARS-CoV-2与其同源ACE2受体建立的复合物的高亲和力和稳定性。
体外实验表明,出现的VoCs,特别是Gamma和Kappa VoC,具有相似或更好的ACE2受体结合能力。VoCs的持续出现似乎是一种向更高稳定性的复合物的进化,同时插入了可以避免恢复期血清或疫苗衍生血清中和的关键点突变。
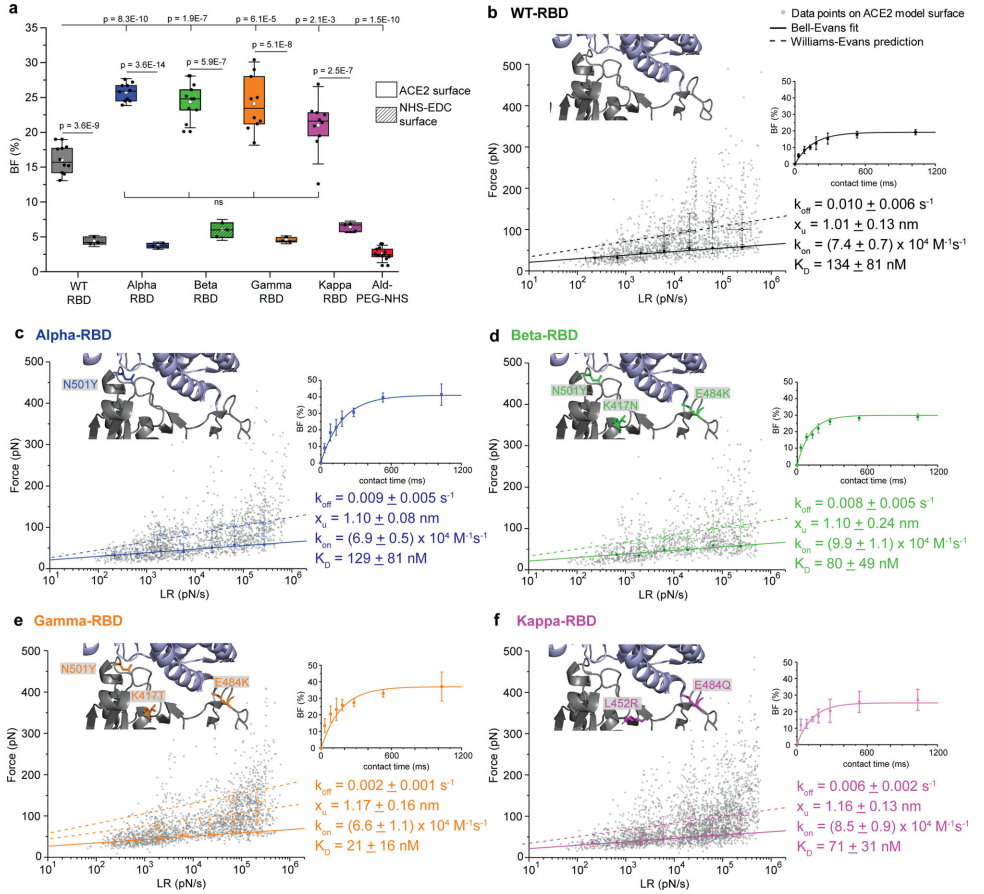
图2 通过AFM测量RBD突变体对其ACE2宿主受体的亲和力。图片来源:Nat. Commun.
RBD-ACE2配合物的能量分析和结构稳定性
为了阐明在VoCs中观察到的RBD-ACE2复合物的更高稳定性的分子机制,作者进行了MD模拟。使用GROMACS软件包对完全溶剂化的RBD-ACE2配合物进行了累积7.5μs的全原子MD模拟(图3a)。在能量最小化步骤和模拟箱的平衡之后,对每个系统进行了5个具有250ns无约束MD模拟的重复和分析。在每个模拟中,各RBD-ACE2复合物是动态的但结合保持稳定,每个RBD测试的初始平衡结构的Cα均方根偏差(RMSD)小于10Å,且VoCs相对于WT的根均方根波动(RMSF)变化较小。
作者首先比较了RBD-ACE2配合物的总能量。对于WT配合物来说,RBD和ACE2之间的势能,即分子间长程库伦和兰纳-琼斯势相互作用的总和,在−590.22kJ/mol左右。在研究的4个VoCs中,只有Kappa变体显示出更稳定的结合复合物,总能量降低了15.2kJ/mol(图3b)。通过观察界面能,其他三个VoCs(Alpha,Beta,Gamma)的兰纳-琼斯势比WT参考能量增加约10 kJ/mol,被更多分子键稳定 (图3c)。在模拟过程中,观察到一些新的分子间接触的形成、断裂和重新生成,主要是在RBD残基484和501附近的区域 (图3d,e,f)。
图3. WT和VoCs的RBD-ACE2的MD模拟。图片来源:Nat. Commun.
对点突变的精细能量分析显示了WT和VoCs之间的重要差异(图4)。每个单独的突变都可以影响与ACE2的结合,但也可能与局部构象和稳定性扰动相关。N501Y突变在三个突变体(Alpha、Beta和Gamma)中很常见,似乎在能量方面具有最大的影响。这一突变通过新的接触强烈增强了RBD和ACE2之间的相互作用。缺乏N501Y突变的Kappa突变体显示出与WT SARS-CoV-2相似的能量。
图4. 通过MD模拟进行RBD点突变能量分析。图片来源:Nat. Commun.
随后,作者分析了由点突变导致的RBD-ACE2复合物保守残基的能量变化(图5),WT和Kappa的Q498残基与ACE2中的K353保持接触,而该接触在其他突变体中丢失。这种效应与具有最低总能量和兰纳-琼斯势的局部环境相关(图5g,h)。Y505-E37接触点的强度在Alpha和Beta中下降,并在Gamma和Kappa中恢复。而Kappa与ACE2 β-发夹(K353-G496和K353-Q498)出现了两个高频率的接触,在ACE2和RBD之间提供了一个更大、更稳定的界面(图5i,j)。
另外,大多数接触点位于RBD-ACE2界面内的ACE2 β-发夹附近,这在Kappa变体中更加稳定(图5a)。这一过程可以被看作是在AFM中自发解除结合或在加载力下的过程中的关键,因为它可能使ACE2在界面的一侧锚定更长的时间。
图5. 由于VoCs点突变而导致的RBD-ACE2复合物保守残基的间接结构和能量变化。图片来源:Nat. Commun.
突变的残基对VoCs中RBD-ACE2的稳定起着动态作用
在WT中,盐桥K417-D30是具有freq~0.7的高频集的一部分。同样的接触在freq~0.9的Alpha变体下更持久,Beta的K417N突变和Gamma的K417T突变接触频率下降到0.4以下,这与界面能中静电贡献的急剧下降有关。对于Kappa变体,盐桥再次建立了更高的freq~0.85。
残基452没有与ACE2受体建立任何高频接触,然而,它与WT中的349、350、351、492和493残基进行了6次高频链内RBD接触。在Kappa突变体中,这些接触的波动减少,使RBD更加稳定。从能量表征(见图4c,d)来看,WT RBD-ACE2界面能和VoCs的总能量和vdW能量的平坦轮廓与452残基中该突变介导的接触缺失相一致。
残基484形成了一组非常动态的盐桥相互作用,这解释了在界面上的总能量没有显著增加的原因。在WT中,E484与K31形成了一个稳定的相互作用,用一个盐桥和少量的强氢键(HBs)表示。这种相互作用在Alpha变异中不会被突变N501Y所破坏;相反,在ACE2中的一个稳定的疏水接触Y501-Y41被重组。对于Beta,Gamma及Kappa突变体,在残基484突变下,盐桥丢失,但在Beta和Gamma变体中形成了一个具有ACE2的新盐桥K484-E75,在RBD-ACE2界面上提供了额外的静电稳定。
对于WT,残基501与ACE2形成高频接触(freq~0.8),用N501-Y41表示。Alpha、Beta和Gamma变体中相同的残基形成了更稳定的疏水接触,因为吸引的π-π相互作用的频率分别为0.94、0.97、0.98,这是由vdW能量证实的界面稳定的标志(图4j)。然而,这种接触成为Kappa变体中的低频率(freq<0.7)集的一部分。N501Y突变更为动态,并建立了不止一个的在VoCs中的相互作用,这并没有体现在WT中。总之,Alpha、Beta和Gamma突变体中的N501Y突变似乎加强了Y501-Y41接触的频率。
针对SARS-CoV-2的RBD的抗体可作为COVID-19的潜在治疗方法
作者使用单分子力谱方法测试了两种IgG1单抗(B-K45和B-R41,Diaclone SAS,法国)针对WT RBD的结合抑制效率(图6)。定量比较RBD抑制水平的结果显示IC50在在µg/mL范围内。这表明B-K45虽然从WT-RBD免疫小鼠中获得,但却更有效地抑制了VoCs-RBD与ACE2的结合。
而对于B-R41,只有RBD WT和Alpha变体与ACE2受体的结合可以被有效地抑制(IC50在1 µgmL−1)。其他的RBD变体(Beta、Gamma和Kappa)在B-R41存在的情况下仍然能够与受体结合,但BF减少了20-30%。结果表明针对WT-RBD的单克隆单抗也可以抑制被测VoCs的结合。然而,根据对B-R41单抗的观察,VoCs可以逃脱这种中和,可能是E484突变的结果,因为显示抑制减少的三种变异(Beta、Gamma和Kappa)共享这种特殊的突变。
图6. 研究抑制不同RBD突变体与ACE2受体结合的抗体效率。图片来源:Nat. Commun.
讨论
本文基于原子力显微镜结合分子动力学对SARS-CoV-2的突变如何定量地影响RBD-ACE2复合物形成的动力学、热力学和结构特性展开了研究。结果观察到RBD-ACE2复合物的稳定性显著增加。虽然N501Y和E484Q突变对更大的稳定性尤为重要,但N501Y突变不太可能显著影响抗体中和。这项工作提供了关于SARS-CoV-2变异结合的前所未有的原子细节,并有助于了解病毒突变对感染诱导免疫的影响,揭示了RBD作为强有力的抗病毒靶点的潜力。
参考文献
Koehler M, Ray A, Moreira RA, Juniku B, Poma AB, Alsteens D. Molecular insights into receptor binding energetics and neutralization of SARS-CoV-2 variants. Nat Commun. 2021 Nov 30;12(1):6977. doi: 10.1038/s41467-021-27325-1. PMID: 34848718; PMCID: PMC8633007.