

Syros制药公司基于晶体结构,结合动力学模拟、ADME等分析发现了一种高选择性的CDK7非共价抑制剂。目前SY-5609正在进行临床一期试验。
背景介绍
细胞周期蛋白依赖性激酶7 (CDK7)是一种丝氨酸-苏氨酸激酶,在细胞周期的转录和调节中发挥关键作用,对肿瘤的扩增转录和异常生长特征至关重要,已成为新颖的抗癌靶点。Syros制药公司致力于癌症和疾病的基因控制疗法的开发,其候选产品包括SY-1425、SY-2101和SY-5609。本文分享了SY-5609的发现过程。从一系列强效氨基嘧啶CDK抑制剂开始,通过关键氨基酸残基的取代、ADME研究、亲和力分析,结合晶体结构以及计算模拟,获得了可口服的CDK7抑制剂SY-5609。SY-5609可诱导G2/M细胞周期阻滞,并诱导癌细胞凋亡,在体内能够抑制CDK7,使小鼠模型中的肿瘤消退。
实验结果
初始SAR探索及ADME和PK SAR的优化
根据已知研究,研究者首先设计了先导化合物1,其对CDK7有很强的抑制作用,但对细胞周期及转录CDKs (CDK2、CDK9和CDK12)的选择性差。使用公开的CDK7晶体结构,研究者首先通过Docking分析小分子的结合模式,再使用表面等离子共振(SPR)分析化合物的结合动力学表征分子的亲和力,优化化合物骨架,获得具有高度选择性的可口服的CDK7抑制剂。通过逐步的官能团替代、结合亲和力及活性检测,进一步获得效能和选择性均增加的化合物4。通过解析化合物4与CDK2的晶体结构(1.7 Å的分辨率),研究者进一步分析化合物结合模式及SAR,以进行基于结构的化合物优化。最后,对该系列的候选化合物进行了ADME特性分析(表1)。
根据ADME分析,结合SAR,研究者设计了一组类似物(表1),试图利用官能团取代,使其既提供所需的药效和选择性,又提供所需的代谢稳定性和口服生物利用度。综合各项性质,研究者选择了SY-5102作为进一步探索潜在选择性口服CDK7抑制剂的化合物。
在HCC70细胞的异种移植小鼠模型中,当SY-5102日给药达到两次(BID)时,在4mg /kg剂量下显示出剂量依赖性的肿瘤生长抑制(图1)。该结果表明,口服非共价的选择性CDK7抑制剂可以明显抑制肿瘤生长。以SY-5102为基础,研究者进行进一步优化,以期改进其PK,达到每日一次的剂量及更高的选择性。
表1 先导化合物的特性。表格来源:JMC
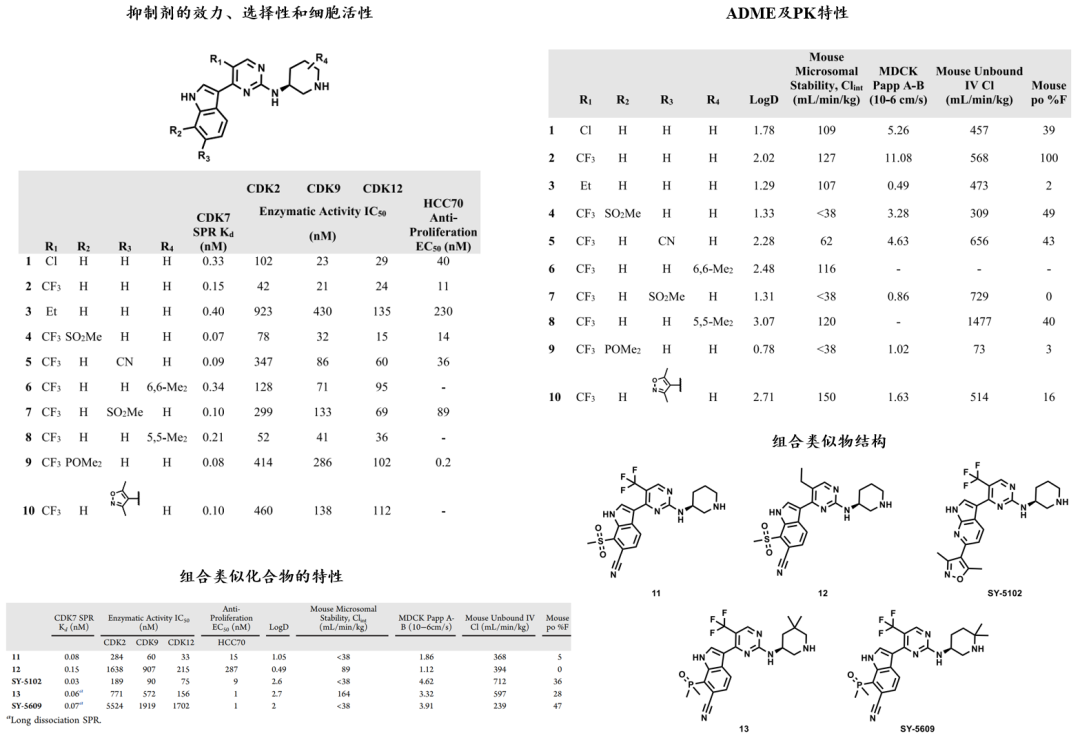
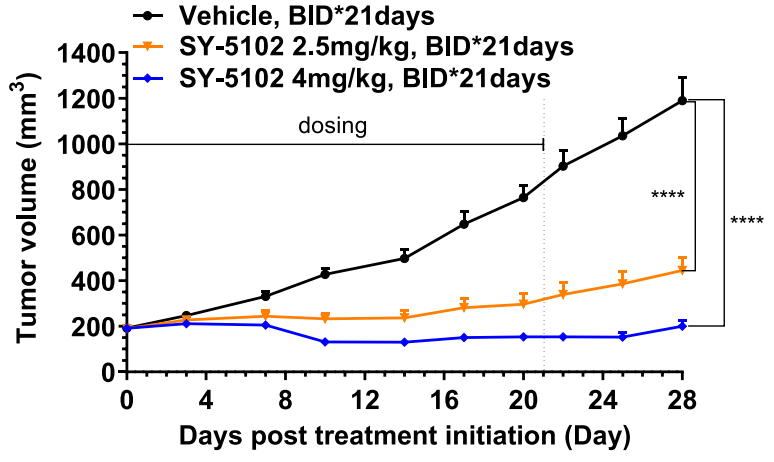
图1. SY-5102在HCC70肿瘤中的作用。 图片来源:JMC
参考 SAR研究以及分子建模结果,研究者将偕二甲基移动到6位,得到SY-5609。经实验验证,SY-5609提高了对CDKs的选择性,并表现出与CDK7/Cyclin H有效的(Kd = 0.07 nM)和缓慢的(koff = 0.0032 s-1)结合。这可能有助于增强HCC70抗增殖活性。SY-5609不仅能有效抑制HCC70细胞增殖(EC50值1 nM),且相对于化合物9和11表现出更高的亲脂性和透膜性(LogD = 2,MDCK Papp 3.91 cm/s)。此外,它在小鼠肝微粒体中有较好的稳定性,表现出显著的口服生物利用度(47%F)。
计算模拟
为进一步分析SY-5609与CDK7可能的结合模式,以解释其高选择性,研究者结合CAK复合物(CDK7/Cyclin H/MAT1)的冷冻电镜结构进行进一步分析。研究过程使用了以ATP-γ-S为配体(PDB: 6XBZ),以共价抑制剂THZ120为配体(PDB: 6XD3),以ICE0942/ CT7001为配体(PDB: 7B5Q)的三种结构。
SY-5609上的二甲基氧化膦部分采用了与氧的刚性构象,从二甲基氧化膦共平面到吲哚NH,它以氢键形成假三环。在SY-5609的小分子X射线晶体结构中也观察到这种低能构象,表明其可能也有助于提高SY-5609的渗透性。这个环状系统靠近柔性的激酶P-loop环,特别是从Gly19到Ala 24的残基。由于相似的铰链结合相互作用,缺乏共价连接,且分辨率高,因此研究者选择PDB结构7B5Q来建模SY-5609与CDK7的相互作用。
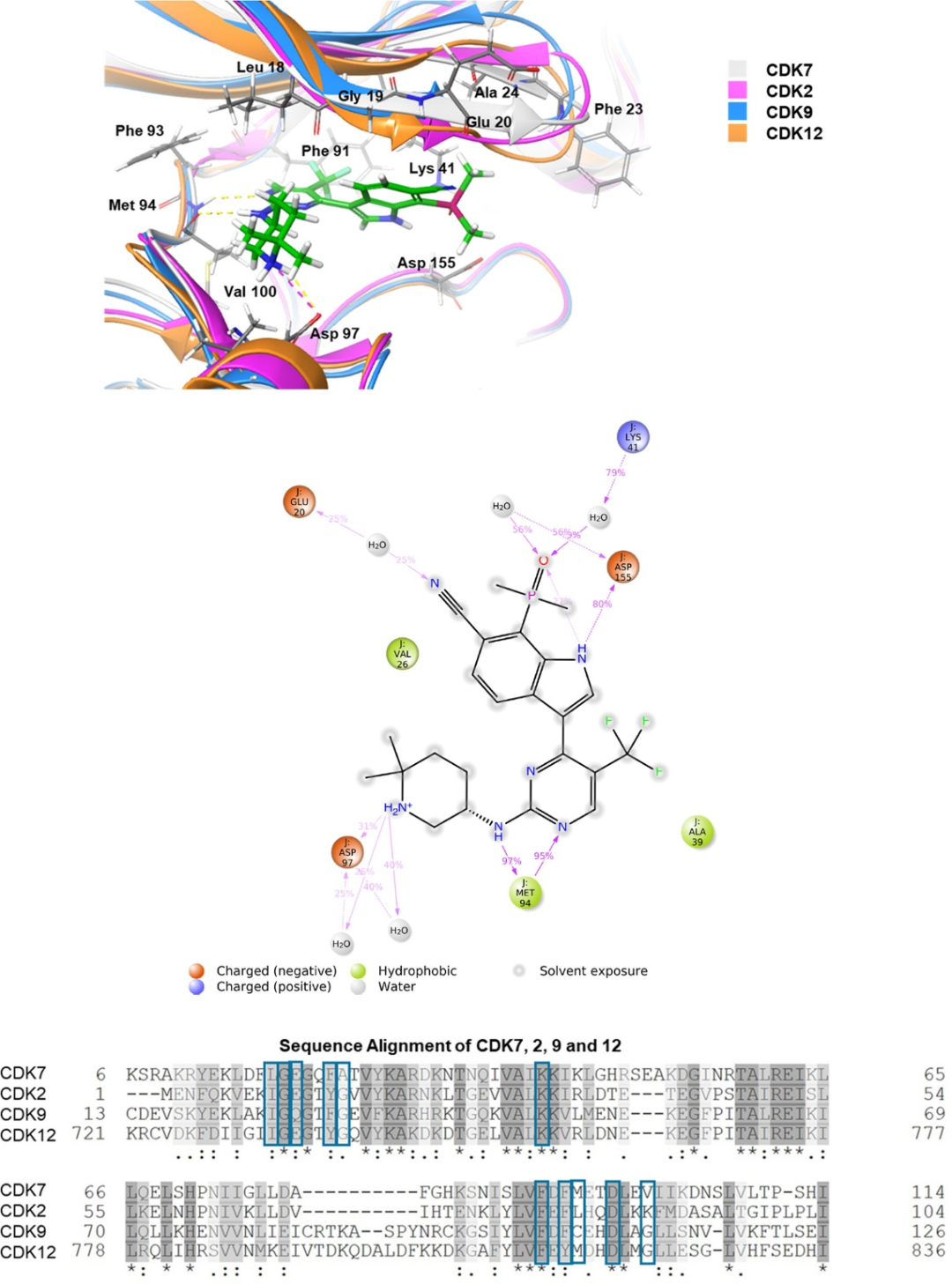
图2. SY-5609与CDK7模拟结合模式的计算分析。 图片来源:JMC
为保留内部氢键,研究者将小分子X射线晶体学观察到的SY-5609构象刚性对接到CDK7激酶结构域中。在对接结构中,Met94和氨基嘧啶之间存在预期的氢键相互作用,6,6-二甲基哌啶氮与Asp97形成盐桥,而嘧啶的5-三氟甲基与Phe91发生相互作用。
以SY-5609、CDK7、Cyclin H和MAT1的刚性对接复合物为起点,研究者进行了50 ns的分子动力学模拟,以研究水分子介导的相互作用的贡献和蛋白柔性。如图2,SY-5609的选择性可能是由哌啶环上的二甲基取代引起的,其指向K -螺旋头部的疏水Val100(这是CDK7特有的残基)。这种取代可能与CDK2的极性Lys89发生冲突。在CDK9和CDK12中,对应的残基是一个体积更小的、疏水性更小的甘氨酸。在CDK7中,偕二甲基可能与Val发生范德华相互作用。这种作用可能被邻近的盐桥锁定,并在CDK9和12中丢失,对这些靶点的选择性也随即增加。然而SY- 5609的选择性远高于化合物6,因此不能完全通过这些相互作用进行解释。刚性对接数据未能阐明任何额外的特异的相互作用。
研究者发现,6位腈基和7位二甲氧基膦可能通过利用P-loop环的构象偏好来驱动选择性。有证据表明,C-6腈基和Glu20的主羰基之间存在瞬时的水分子介导的相互作用。图2中的序列比对突出了残基22和25之间的差异。特别是Ala24作为CDK7所特有的,它可能改变了loop环的灵活性,并在靠近氧化膦甲基的较低侧提供了更疏水的接触表面。SY-5609/CDK7的对接结构和其他CDKs激酶结构域的叠加中,也可明显看到不同的P-loop构象。
CDK7 P-loop从Gly 19周围的结合位点向外发散,Phe23周围的loop环末端相对于其他CDKs向上倾斜,可能使CDK7比其他CDKs更好地适应SY-5609,同时保留了关键的极性相互作用。CDK7 P-loop的柔性曾被认为对配体的选择性很重要。研究者对SY-5609与 CDK2/CyclinA、CDK9/CyclinT1和CDK12/Cyclin K对接的复合物以及所有4种CDKs 无SY-5609的复合物(apo复合物)进行了分子动力学模拟(50 ns)。同时,研究者通过测量Gly19和Ala24对应残基的平均phi和psi二面角来监测loop环的构象。结果只有在CDK7中,apo复合物和SY-5609结合态之间的测量值具有可比性,这表明P-loop环基本不需要重排来适应配体,暗示着其在选择性中的贡献。
CDK家族和基因组的选择性
为进一步分析SY-5609对CDK的选择性,研究者对SY-5102和SY-5609进行了28个CDK家族的分析,并在485种激酶中测量了更广泛的激酶组选择性。结果表明SY-5609的选择性比SY-5102更强,且只有10种激酶在1μM SY-5609时表现出大于70%的抑制作用(图3)。这些数据表明,在治疗相关浓度下,其他激酶不太可能发生显著参与。
图3 SY-5102和SY-5609的基因组选择性。图片来源:JMC
SY-5609的细胞活性
在细胞活性的研究中,SY-5609在TNBC、OVA肿瘤细胞系中表现出较强的抗增殖作用,而在两种正常成纤维细胞系中仅在最高剂量下显示出超过50%的抗增殖作用。HCC70细胞系中,SY-5609对CDK7的细胞周期和转录靶点均存在影响。用SY-5609处理24和48h后,可以通过丢失CAK功能来抑制CDK2在Thr160位点的磷酸化(图4A)。
在TFIIH中抑制CDK7会导致RNA聚合酶IIc端结构域的七肽重复序列中Ser5的磷酸化水平降低,而c-Myc的水平降低(图4A)。在多个癌细胞系中,SY-5609处理48和72h可诱导细胞凋亡,而原代成纤维细胞没有被诱导凋亡(图4B)。此外,SY-5609处理后G2/M细胞周期发生阻滞(图4C),这是CAK功能丧失的结果,与SY-5609处理24和48 h时观察到的Cyclin B1积累一致(图4A)。
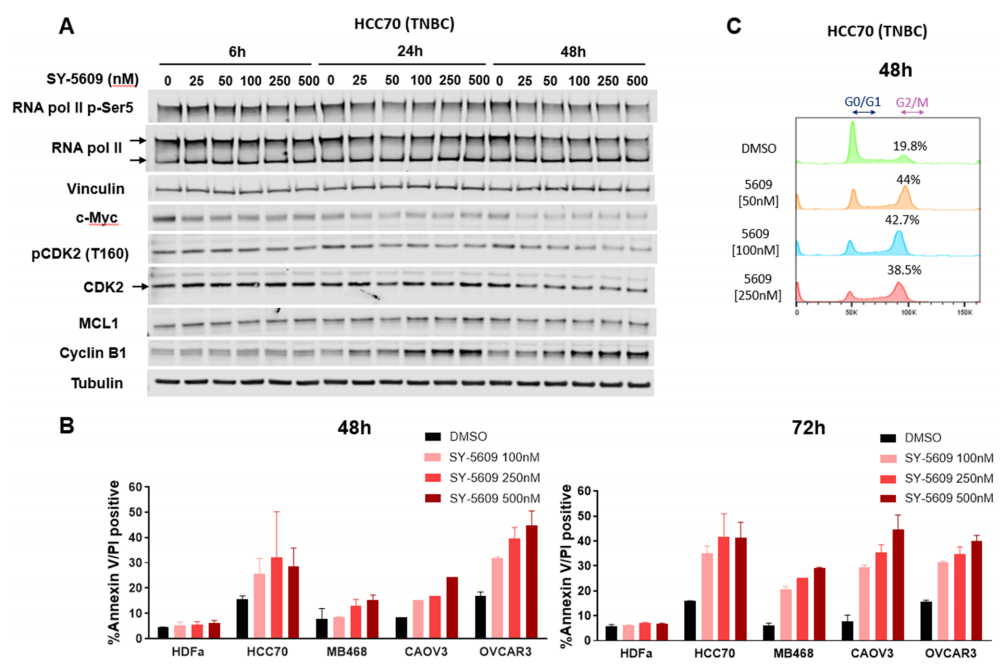
图4. SY-5609的细胞活性。图片来源:JMC
SY-5609的体内药效
研究者在HCC70细胞的异种移植小鼠模型中测试了SY-5069的体内药效。小鼠每日口服2mg/kg SY-5609,血浆暴露量为261.28 ng h/mL,Cmax为50.67 ng/mL(103nM),消除半衰期为3.33h。在给药的21天内诱导了肿瘤消退,耐受性良好。直到第28天,仍未见肿瘤复发(图5)。
此外,研究者监测了涉及细胞周期和对CDK7抑制的转录反应的标记物(图5)。在单次2mg/kg剂量后的4小时内,RNA聚合酶II的Ser5磷酸化和CDK2的Thr160磷酸化均降低,而c-Myc和MCL1蛋白水平基本保持不变。c-Mycm RNA的表达也降低了,这为CDK7转录功能的快速抑制提供了证据。7日给药后,CDK2 p-T160和p-Ser5的减少保持不变,c-Myc和MCL1蛋白水平也降低。这些结果与其细胞活性和体内药效相一致(图4),说明了其对细胞周期(pCDK2)、转录(pSer5和c-Myc)和细胞凋亡(MCL1)的影响。
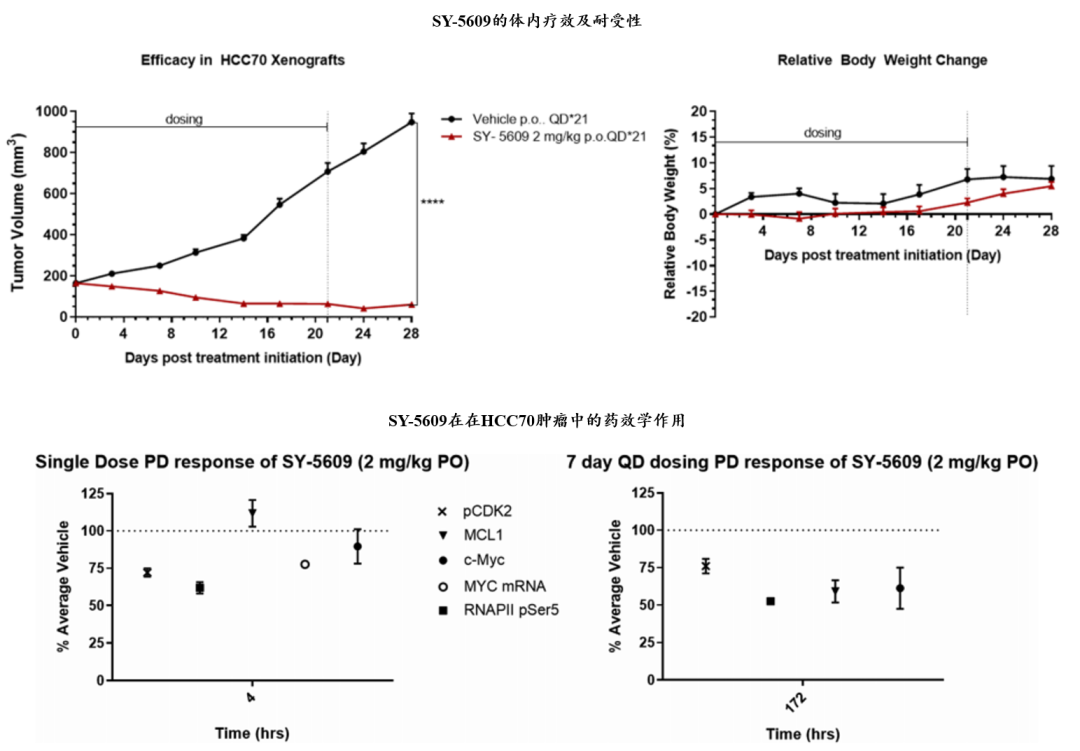
图5. SY-5609的体内药效。图片来源:JMC
结论
研究者通过计算模拟结合实验,筛选到有效且高度选择性的CDK7抑制SY-5609,支持每日口服给药。用SY-5609处理HCC70细胞会导致细胞周期CAK靶点和TFIIH靶点的减少,且呈剂量依赖性;可导致G2/M细胞周期阻滞和c-Myc等重要致癌基因的下调,最终导致癌细胞凋亡。SY-5609在体内外实验中都表现出了显著的药效和选择性。该实验结合计算的研发过程对抗癌小分子的开发具有指导意义。
参考文献
Marineau JJ, Hamman KB, Hu S, Alnemy S, Mihalich J, Kabro A, Whitmore KM, Winter DK, Roy S, Ciblat S, Ke N, Savinainen A, Wilsily A, Malojcic G, Zahler R, Schmidt D, Bradley MJ, Waters NJ, Chuaqui C. Discovery of SY-5609: A Selective, Noncovalent Inhibitor of CDK7. J Med Chem. 2021 Nov 2. doi: 10.1021/acs.jmedchem.1c01171. Epub ahead of print. PMID: 34726887.