

拮抗剂和激动剂结构相似却生物效应相反?基于 RORγ 拮抗剂 VTP-43742 做骨架跃迁设计合成的RORγ 激动剂正是如此!且优化后的化合物17还能在肿瘤组织中诱导产生 IL-17 和 IFNγ 并表现出抗肿瘤活性。
背景介绍
RORγ(视黄酸受体相关孤儿受体)靶点与炎症诱导癌症免疫密切相关。RORγ 激动剂可以通过促进 Th17 细胞分化、激活免疫系统来治疗癌症。Th17 细胞是多种自身免疫性疾病发病机制中关键的炎症效应物,通过产生保护性炎症,促进肿瘤免疫中的细胞毒性 T 细胞活化。保留干细胞样分子特征的 Th17 细胞甚至能有效地根除肿瘤并引起自身免疫。因此,促进 Th17 细胞分化的 RORγ 激动剂有望在多种癌症中发挥治疗作用。近年来,文献报告了合成 RORγ 激动剂在肿瘤免疫治疗中的潜在价值。其中,Lycera研发的 RORγ 激动剂 LYC-55716 是当前最佳的候选药物,已经进入临床1期。
主要内容
Vitae公司报告了一种口服 RORγ 抑制剂 VTP-43742,该抑制剂在银屑病患者的 2a 期临床试验中显示出阳性结果。恒瑞药化部门的Biao Lu及其团队基于 VTP-43742 ,使用骨架跃迁设计了一系列新型 6/5 稠环杂芳烃,其中化合物 1 显示出有效的体外 RORγ 拮抗活性(图 1A)。在时间分辨荧光能量转移 (TR-FRET) 的RORγ 辅助因子测定中,化合物 1 相对于载体,与 RORγ LBD 结合导致 TR-FRET 信号降低,呈现与 VTP-34742 相似的特征(图 1B)。与 VTP-43742 左侧的饱和环己基环相比, 1 的苄基的构效关系值得进一步探索。其邻位 CF3– 苄基取代的2则显示出相反的效应,促进 TR-FRET 信号增加。
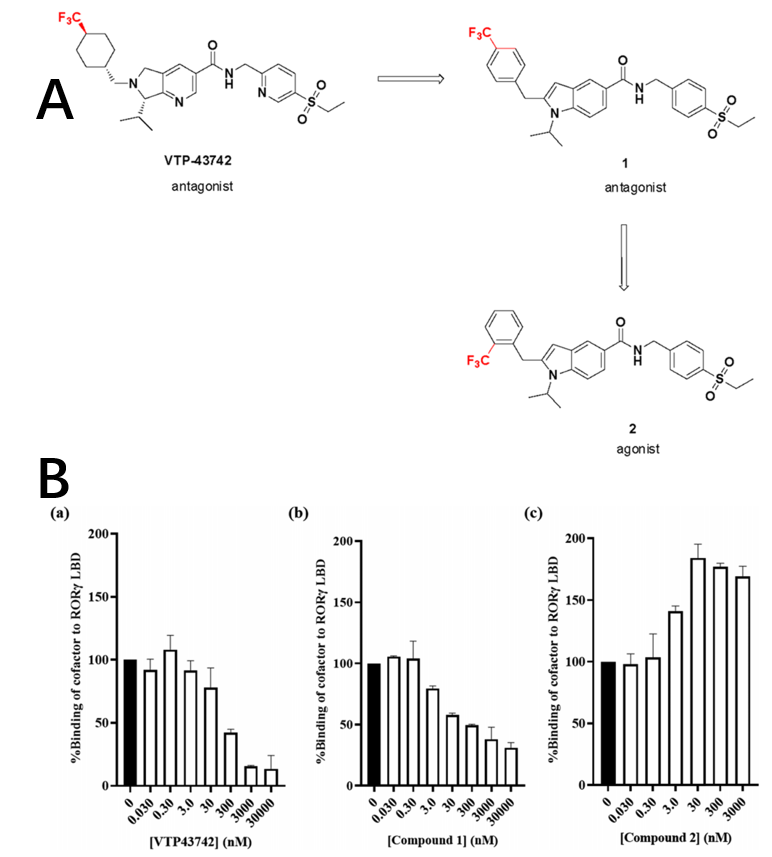
图1. RORγ激动剂的逐步演变及与RORγ LBD的辅酶因子结合方面的相反机制. 图片来源自JMC
文献报告它们的叔磺酰胺和酰胺系列分子的微小结构变化可能在 RORγ 受体结合域呈现不同的机制。于是作者将三氟甲基从苯环上的对位移动到邻位,功能便从拮抗剂转换为激动剂。接着将化合物1,2分别建模出拮抗剂和激动剂的蛋白质结构。核受体一般需要一个关键的氢键来维持激动剂构象。在 RORγ 中,这个关键的氢键位于 LBD11 的 Helix 12 的 Tyr502 和 Helix 11 的 His479 之间,如图 2b所示。化合物1与 Leu287、Arg367 和 Phe377 形成了三个关键的氢键相互作用,如图 2a 所示。它的间位 CF3 苯基很好地指向了由 Helix 3 的 Phe486 和 Helix 11 的 Trp317 形成的口袋。它们将 His 479 锁定在构象中,从而使其不能与 Tyr502 形成氢键。而2 的苯环邻位 CF3 足够大,可以促进 His479 与 Tyr502 形成氢键。其余配体则与 Arg364、Arg367 和 Phe377 保持相同的三个关键氢键相互作用。
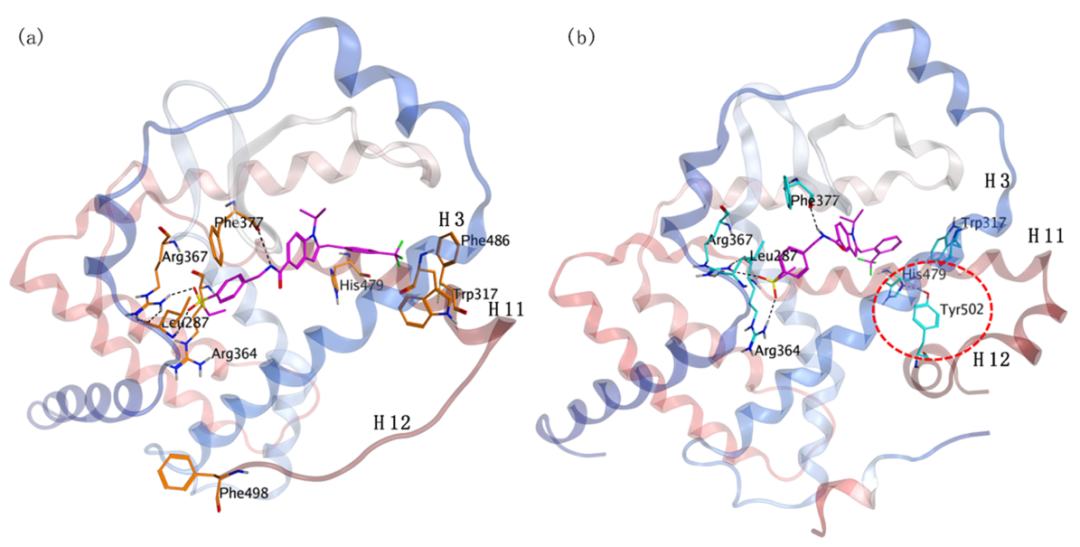
图2. 化合物1和2的结合模式。图片来源自JMC
然后对化合物2进一步优化。5-羧酸甲酯作为原料,在钯催化下通过选择性 CH 活化,与各种苄基溴反应获得关键的 2-(邻位取代苄基)-吲哚中间体 1a-13a,然后经不同的卤代烷烷基化,得到 N-取代的吲哚中间体 1b-15b。在碱性条件下水解后,无需进一步纯化即可获得羧酸 1c-15c。最后经缩合得到最终化合物 1-17。
SAR 结果如表 1 所示,正 Emax 表示激动作用的最大功效,负 Emax 表示拮抗作用的最大功效。化合物4作为拮抗剂,显示出10 nM (Emax= -70%) 的 EC50。苄基环衍生物 5是较弱的拮抗剂,EC50=683 nM (Emax= -67%)。随着受阻取代基的增加,6 和 7 也显示出拮抗效应。溴代物 8 是激动剂,EC50 是 16 nM (Emax= +79%)。此外,化合物 9、10 和 11 显示出与激动剂相似的结合模式。可见吲哚系列的生物效应可能取决于苄基环的受阻基团。
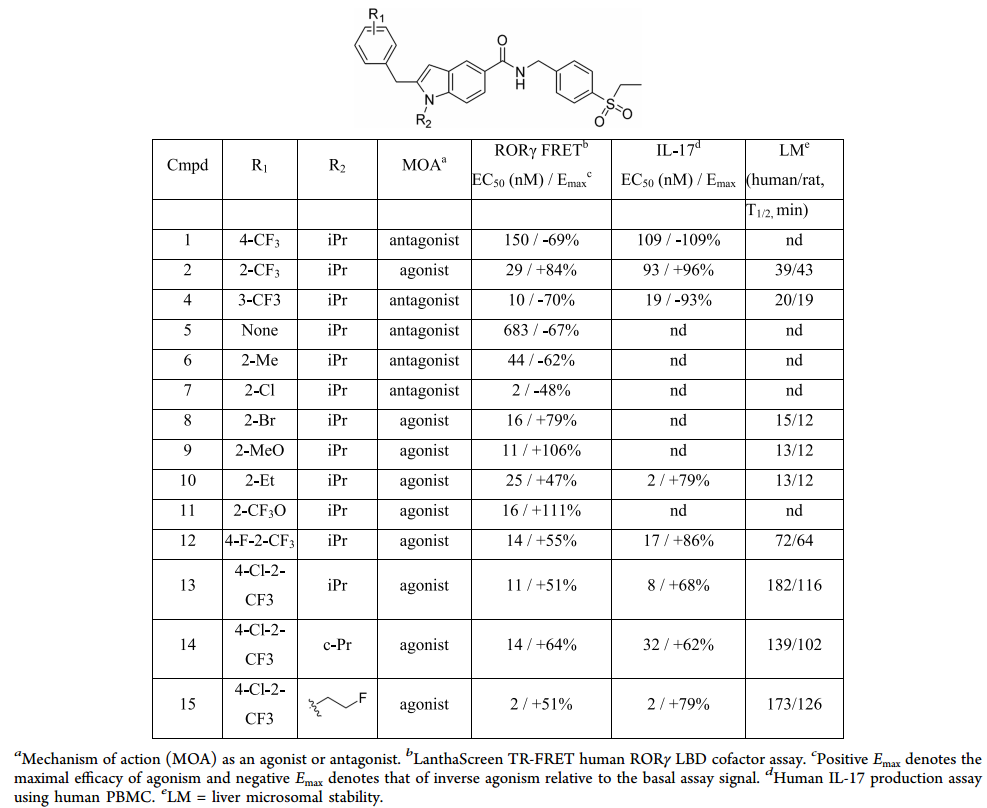
表1. 吲哚系列分子的构效关系。图片来源自JMC
为了确认细胞靶向活性,作者使用 PBMC 细胞研究 RORγ 激动剂对 RORγ 调节的 IL-17 分泌的影响。PBMC 经细胞刺激素刺激 72 小时,细胞培养上清液中 IL-17 的分泌增加 25 倍。这证实了 Th17 细胞分化。我们在相同的测定环境中评估了拮抗剂和激动剂。
表 1 中所有激动剂在相同的分析条件下促进了 PBMC 细胞的 IL-17 分泌,拮抗剂(例如1 和 4)可显著抑制 IL-17 分泌。尽管10 在诱导 IL-17 分泌效果方面比2 强 4 到 5 倍,但实验表明它是一种部分激动剂(EC50= 2 nM,Emax= + 79%)。8、9 和 10 在人类和大鼠微粒体中表现出不稳定性,半衰期不足 15 分钟。邻位 CF3 取代的化合物 2 显示中等微粒体稳定性,半衰期约 40 分钟。
12 和13可阻断潜在苯环代谢点,提高肝微粒体稳定性,显示出良好的激动活性。我们尝试用其他基团取代13 吲哚 N 位的异丙基。14 显示出相似的效果,但是在 IL-17 中活性较弱,15 显示出更好的效力和相似的功效。
作者分别在小鼠、大鼠和狗中测定了15 的药代动力学 (PK) 曲线,结果发现化合物 15 在小鼠中口服生物利用度 (47.3%) 有所提高,作者推测酰胺键的水解是主要的代谢途径。作者合成了一对具有与酰胺键相邻的羟基甲基取代基的化合物 16、17(图 3)。17进一步提高了疗效,几乎是完全激动。16是较弱的激动剂,与 RORγ LBD 的相互作用没有形成更有利的激动构象。17 的效果在 RORγ 调节的 IL-17 上得到了验证。
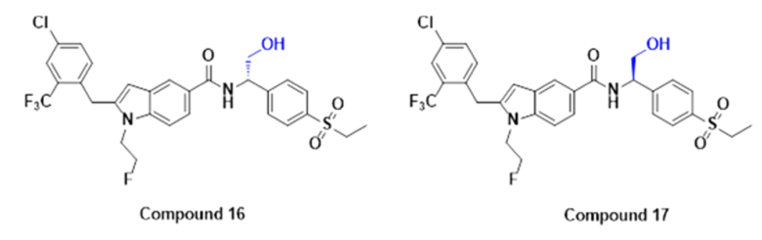
图3. 化合物16和17的结构式。图片来源自JMC
此外,实验发现17 对另一个 ROR 家族成员 RORα 具有高选择性。与15 相比, 17 的 PK 曲线得到了显着改善。PK 结果总结在表2中。17 具有非常低的清除率与良好的跨物种口服生物利用度。17的体内研究的实验方案如图5a所示。在MC38小鼠同源结直肠肿瘤模型的实验中,与对照组相比,所有治疗都具有良好的耐受性,小鼠体重几乎没有变化(图 4b)。所有处理组的生长曲线如图4c所示。
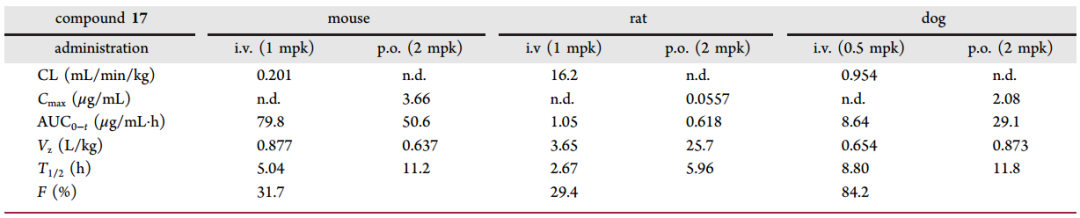
表2. 化合物17的PK效果。图片来源自JMC
一组小鼠 (n = 3) 与其他组,一起每天口服 10 mg/kg 的17治疗肿瘤。在第 5、11、18 和 25 天给药3小时后从这些小鼠中采集血样。如图 4d 所示,化合物 17 的浓度逐渐累积并在第18天后达到平衡。在第25天给药3小时后收集所有组 (n = 8) 的血浆和肿瘤,用于17 的 PK 分析(图 4e)。17 的平均血浆浓度在10 mg/kg,组中值为 9117 ± 1006 ng/mL,在组合组具有相似的浓度 (10 787 ± 1078 ng/mL)。体内药效研究结束时血浆样品的结果与本研究的时间过程一致。由于17 在小鼠中的分布容积较低,因此 17 在肿瘤中的浓度低于血浆中的浓度。17 的血浆和肿瘤的暴露比在4.5和4.6之间。
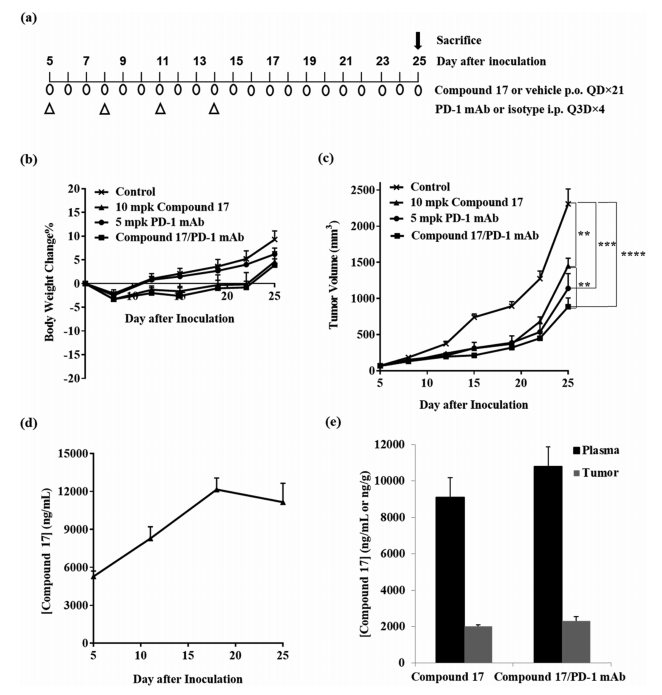
图4. 化合物 17 单独使用,以及与PD-1 mAb 联用在 MC38 小鼠同源结肠肿瘤模型中的药效。图片来源自JMC
为了确认 17 的靶向活性,作者使用从肿瘤组织中分离的细胞(每组四只小鼠),以IL-17 作为 PD 生物标志物,研究了给药方案与IL-17分泌的关系。结果(图 5)表明,化合物 17 给药方案显著增加了 IL-17 的浓度。17与抗 PD-1 mAb 的组合提高了 IL-17 的水平。17 还可以显著增加 IFNγ 浓度,与抗 PD-1 mAb 组合可提高 IFNγ 的水平。化合物 17 治疗激活的 RORγ 受体促进了肿瘤中相关细胞因子的产生和细胞毒性 T 细胞的激活,从而更大程度上抑制了肿瘤生长。
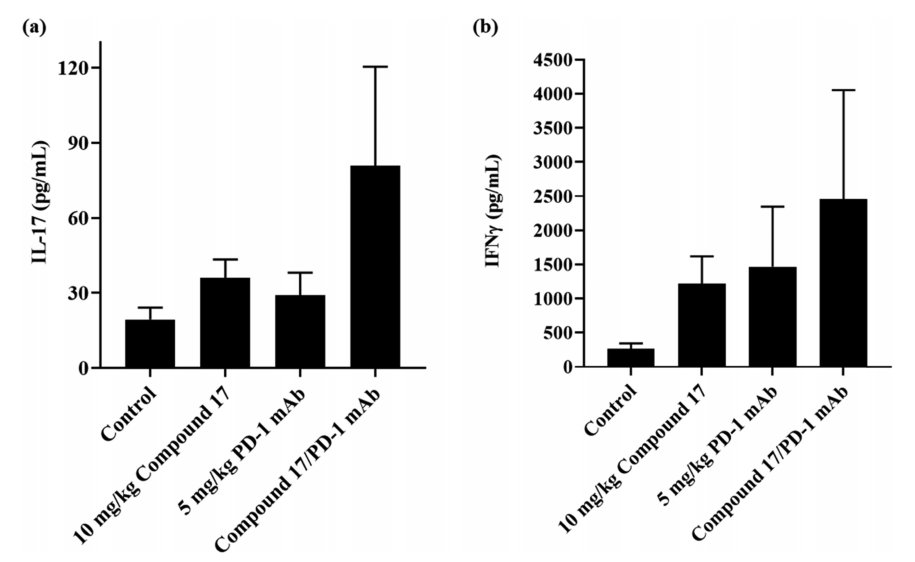
图5. PD生物标志物对化合物 17以及17与抗 PD-1 mAb 联用的反应。图片来源自JMC
结论总结
这是第一份通过详细的 SAR 研究 RORγ 激动剂的工作。在 MC38 小鼠同基因结肠肿瘤模型中,除了 PD-1 免疫检查点外,作者尝试通过阻断 Th17 通路的药物联用的方法来提升抗肿瘤药效。化合物 17 与抗 PD-1 mAb 联合治疗在一定程度上增强了肿瘤生长抑制效果。生物标志物研究的结果和 MC38 同基因小鼠结直肠肿瘤模型的体内药效研究表明,该组合通过抗 PD-1 mAb 阻断免疫检查点和通过 RORγ 阻断 Th17 信号通路激动剂可能有助于改善临床反应。这个方向值得进一步探索。
参考文献
Biao Lu, Dong Liu, Bin Gui, Jun Gou, Huaide Dong, Qiyue Hu, Jun Feng, Yuchang Mao, Xiaodong Shen, Shenglan Wang, Caihua Zhang, Ru Shen, Yinfa Yan, Lei Chen, Huiyun Wang, Di Li, Jiayin Zhang, Minsheng Zhang, Rumin Zhang, Chang Bai, Feng He, Weikang Tao, and Suxing Liu, Discovery of 2‑(Ortho-Substituted Benzyl)-Indole Derivatives as Potent and Orally Bioavailable RORγ Agonists with Antitumor Activity, Journal of Medicinal Chemistry, 2021, 64, 14983-14996.