癌症在个体内表现出高度的遗传和变异性,这种异质性表现为患者对疗法的不同反应。为了定制适合不同患者的独特疗法,个性化医疗旨在确定与个体治疗效果相关的可测量生物标志物,从而使临床医生能够准确预测患者对这些疗法的反应。几十年来,蛋白质生物标志物已被用于靶向癌症治疗,测序方法的发展也促进了靶向药物的识别预测。尽管生物标志物可以提高疗法的整体疗效,但对于特定癌症患者的最佳疗法的确定通常是不精确的。癌症相关研究表明ML可以将基因组特征、基因表达模式等与药物敏感性相关联从而作为预测药物反应的一种手段,但ML方法尚未使用大规模蛋白质组学和磷酸蛋白质组学数据系统地进行测试与应用。为此,该文章开发了一种称为使用机器学习的药物排名方法 (DRUML),使用蛋白质组学和磷酸蛋白质组学特征的组合构建集成机器学习模型,并根据药物在减少癌细胞增殖方面的功效生成药物列表排名。
主要内容
人工智能和机器学习(ML)有望通过准确预测治疗个体患者的最合适疗法来个性化的改变癌症疗法。本文提出了DRUML 方法,该方法使用组学数据根据其在癌细胞中的抗增殖功效生对超过400种药物的疗效进行了排名。DRUML在48个细胞系的内部蛋白质组学和磷酸蛋白质组学数据的基础上进行了训练,并使用来自12个独立实验室的53个细胞模型组成的数据对其准确性进行了验证。结果表明,DRUML可以根据抗癌药物在各种病理中的功效准确地对它们进行排名,因此基于ML模型的DRUML方法对于评估蛋白质组学及推进精准医学领域发展至关重要。此外DRUML预测癌细胞群内药物排名的能力无需与参考样本进行比较,对于ML的临床实施至关重要,并实现了精准医学的核心目标。研究成果以题为“Drug Ranking Using Machine Learning Systematically Predicts the Efficacy of Anti-Cancer Drugs”发布在国际著名期刊Nature Communications上。
图表汇总
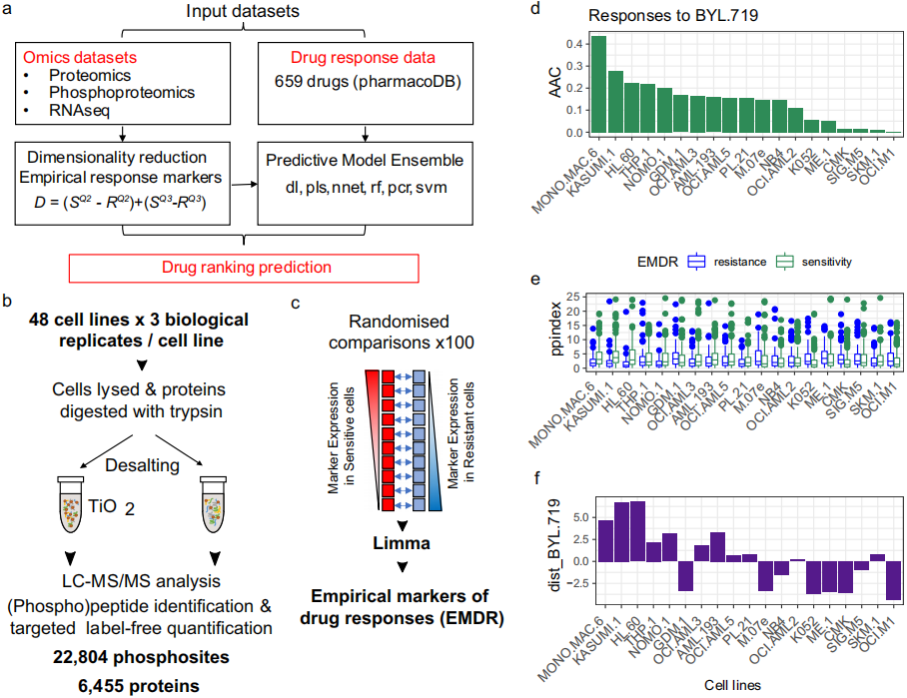
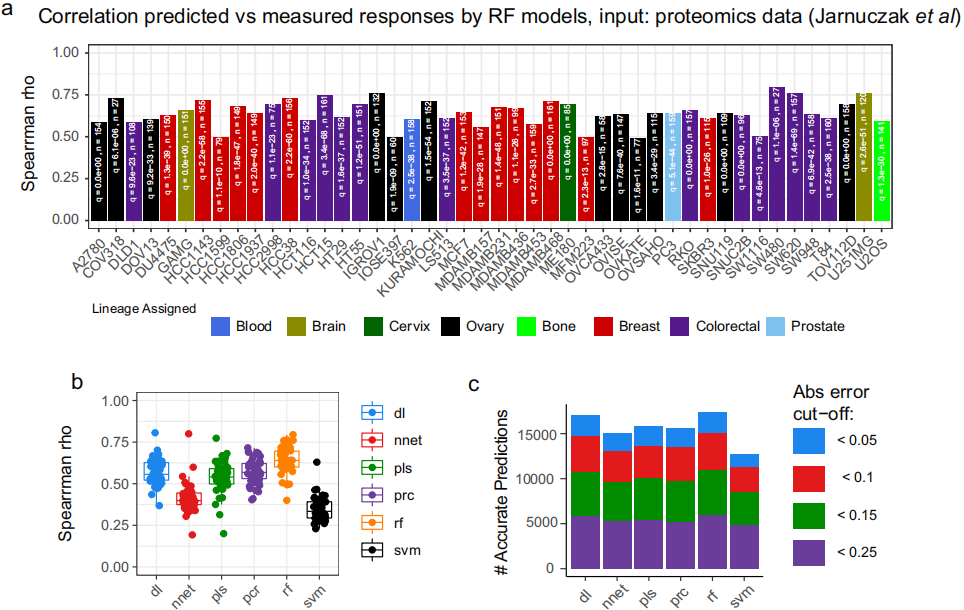
图1. 使用机器学习的药物排名概述(DRUML)
图片来源于Nature Communications
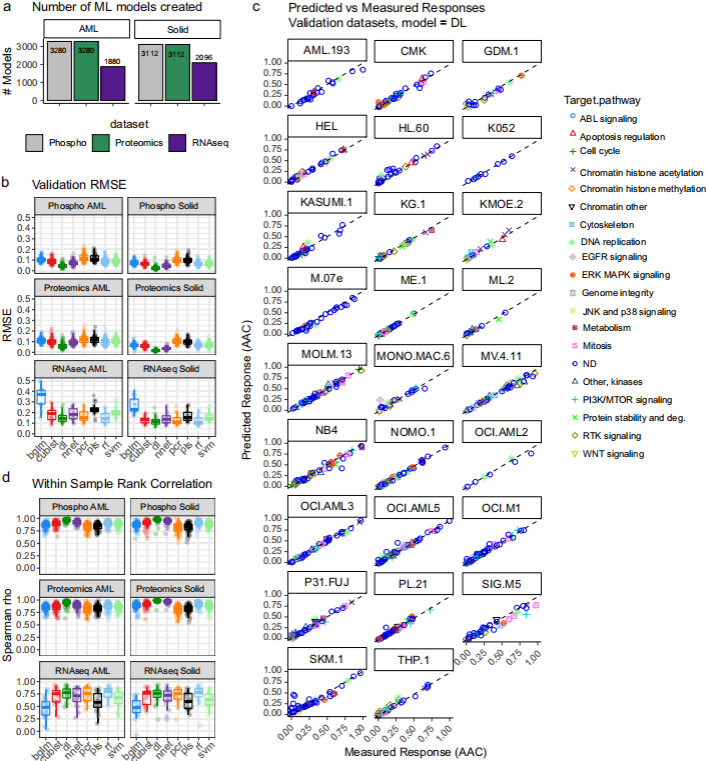
图2. DRUML根据疗效对药物进行排名的性能和准确性
图片来源于Nature Communications
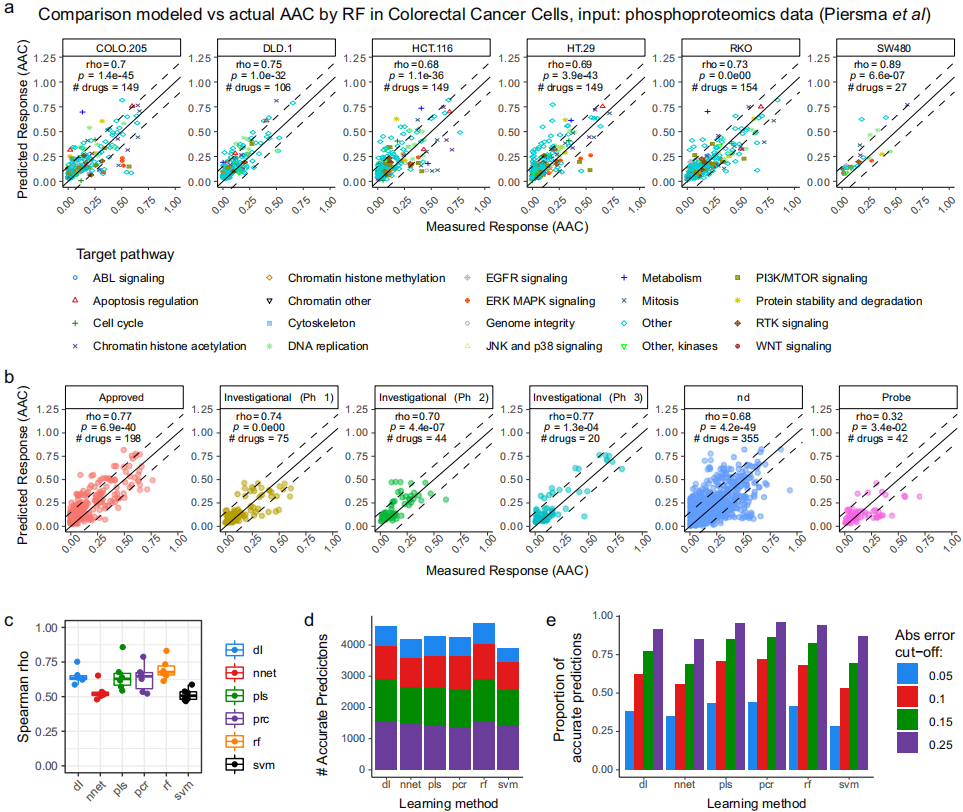
图3. 使用独立的磷酸蛋白组学数据集
对DRUML排名药物的疗效的准确性评估
图片来源于Nature Communications
图4. 基于47个肿瘤模型和8种病理学的
独立蛋白质组学数据集对DRUML准确性的评估
图片来源于Nature Communications
推荐理由
机器学习(ML)在生物医学中的应用有望彻底改变未来癌症的诊断和治疗方式,该文章基于ML建立了DRUML方法,并生成了按其在减少给定癌细胞群增殖方面的预测功效排序的药物列表。此外研究还证明了DRUML可以根据药物在不同癌症类型中的预测功效合理准确的对不同作用模式的药物进行排名,并且误差合理。未来可以应用DRUML从更多的临床病理参数和突变分析中获得的信息来确定药物优先顺序。
参考文献
Henry Gerdes, Pedro Casado, Arran Dokal, Maruan Hijazi, Nosheen Akhtar, Ruth Osuntola, Vinothini Rajeeve, Jude Fitzgibbon, Jon Travers, David Britton, Shirin Khorsandi, and Pedro R. Cutillas, Drug Ranking Using Machine Learning Systematically Predicts the Efficacy of Anti-Cancer Drugs, Nature Communications, 2021, 12, 1850. DOI: 10.1038/s41467-021-22170-8.