

疫情当前,mRNA疫苗成了医药界的“顶流”,而没有纳米脂质颗粒(LNP)这项革命性的递送技术,mRNA及人体基因编辑的技术路线将无法打通。基于合理结合实验和计算方法的重要性,本文着重从计算角度介绍那些用于药物和基因传递的新颖且强大的LNP系统。
背景介绍
脂质体的概念出现在1965年,20世纪90年代LNP在siRNA介导的体内RNAi方面开始崭露头角,被基因治疗先驱确定为一种潜在的药物递送载体,2018年Alnylam公司利用该技术研发的全球首个治疗ATTR的RNAi药物patisiran获批上市,最近更是因为辉瑞和Moderna的COVID-19疫苗的成功研发而获得了极大的关注。如封面图所示,LNP主要由四个成分组成:与核酸静电吸附的离子化脂质、介导LNP内吞的胆固醇、加速药物释放的辅助型脂质以及提高纳米粒整体稳定性的PEG脂质。大小在20nm到1000nm之间。其工作原理是LNP吸附到细胞表面,然后进行内吞作用并将基因药物(mRNA, RNAi, CRISPR)释放到细胞中。一旦核酸药物进入细胞,细胞的阴离子脂质可能通过中和其阳离子脂质载体的电荷,破坏脂质载体与核酸之间的静电相互作用,帮助从 LNPs中释放核酸药物。相对病毒载体而言,LNP具有基本没有预存免疫原性、被天然免疫机制干扰的机制较少、不会被野生或重组的活病毒污染以及随机整合到基因组的风险小等优势。
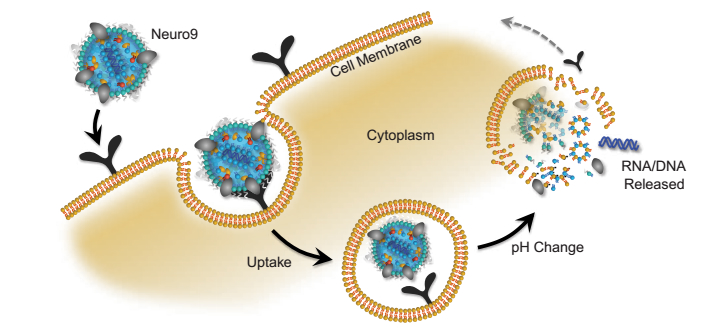
图1. LNP作用机制示意图。图片来源于Precision NanoSystems官网
实验测量所得的基于LNP的药物递送系统(DDS)性质在多重长度和时间尺度上和分子机制所得的存在一定差距,而计算方法尤其是多尺度建模和模拟可以弥补这一落差。本文着重介绍分子动力学在LNP模拟中的应用。
脂质双层的分子模拟
为了合理设计和优化基于LNP的DDS,对小分子如何与脂质相互作用的分子级理解至关重要。这些相互作用会影响小分子在膜中的分配并决定特定LNP的载药能力,其重要表征之一是渗透性,虽然总渗透率可以通过实验测量得到,但渗透过程的动态过程及分子扩散和分配的比例确定却主要来自计算研究。为了降低计算成本,通常采用脂质双层贴片的原子模拟来推断分子在脂质中的扩散和分配结果(图2)。
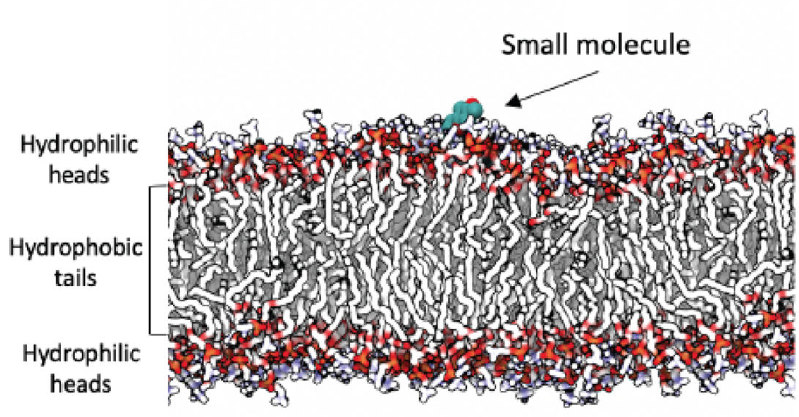
图2. 在模拟中与脂质双层相互作用的小分子。图片来源于Curr Top Med Chem.
早期MD通过在脂质双层内的给定位置约束小分子,通过对位置波动和维持位置约束所需的力的分析来计算扩散系数和分配自由能。模拟结果与实验数据的比较表明,膜渗透率取决于多种因素。通常,亲水分子在进入膜的碳氢化合物核心时会遇到自由能垒,而疏水分子往往位于膜的碳氢化合物区域。后来,Comer 和 Chipot提出了一个亚扩散模型,其中位置相关的分数阶量化了分子的运动如何偏离沿膜法线方向的经典扩散(图3)。通过研究短尾醇的同系物系列,他们首先表明通过双层中心的自由能垒随着脂肪醇链的长度增加而降低,与实验数据在定量上一致。然后他们使用该模型来表明分子的渗透率主要由这种自由能差异决定,而分子之间靠近膜中心的分数扩散率是相似的,尽管它们的分子量和亲脂性差异很大。该策略进一步发展为更经济的膜渗透率计算。可以通过一系列自由能扰动计算来计算自由能分布,并使用贝叶斯干涉通过一系列自适应偏置力计算来计算扩散率曲线。
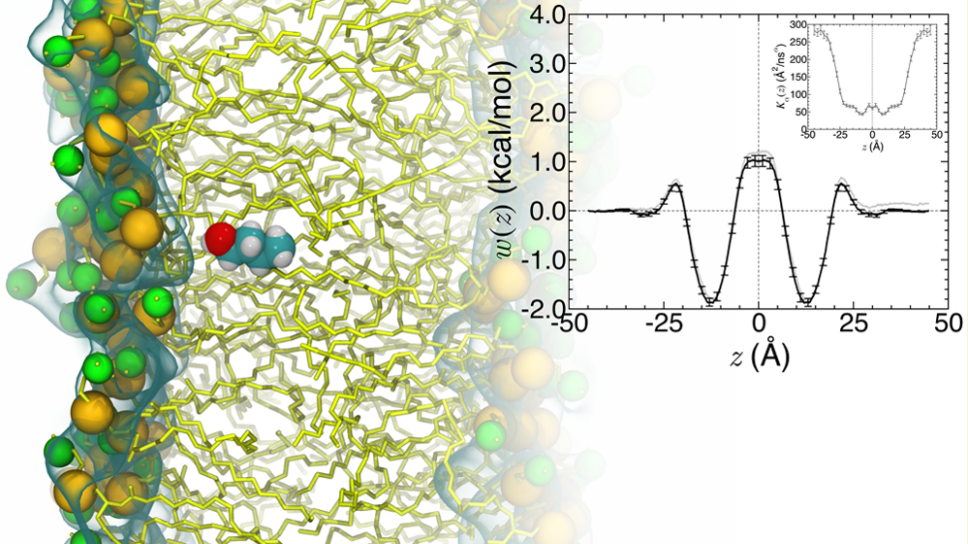
图3. Comer的亚扩散模型。图片来源于:10.1021/acs.jctc.7b00264
PEG化膜的分子模拟
PEG化已成功用于通过在脂质体表面形成保护性PEG层来增加药物递送脂质体的循环时间。PEG化膜减少了免疫细胞对药物的摄取,然而其与周围的各种分子的相互作用及空间效应尚不清楚。
MD在提供对PEG化如何提高膜的载药效率的机制理解方面特别有用。Dzieciuch 等人用MD研究疏水性分子 p-THPP如何与脂质双层相互作用,结果与实验一致,p-THPP 进入两性离子膜和聚乙二醇化膜。因此,与两性离子脂质体相比,p-THPP 在PEG化脂质体中的溶剂暴露程度更高。类似的MD 模拟还表明,在生理条件下,PEG 倾向于缠绕在离子周围,这增加了非极性乙烯基的暴露,从而增加了分子的有效疏水性。这种增加的暴露赋予了 PEG 分子对药物分子(如血卟啉)的保护作用。针对其他LNP 成分也用类似的方法进行了研究。Magarkar 等人通过MD 模拟表明,PEG通过以与胆固醇分子的β片对齐的特定方式进入脂质双层(图4)。此外,PEG 会干扰胆固醇在膜结构中的作用;当膜被聚乙二醇化时,每个脂质的面积会随着胆固醇的增加而增加。另外,增加 PEG 化脂质浓度会导致 PEG 层带正电荷,从而削弱其与阳离子的相互作用,这为PEG化抑制钙诱导的脂质体融合提供了原子级解释。
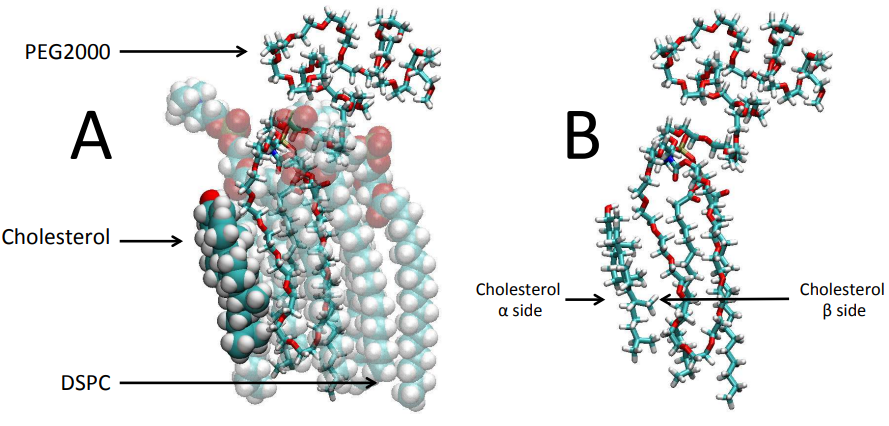
图4. PEG与胆固醇的β片平行进入脂质双层。图片来源于:10.1021/jp504962m
脂质体和胶束的分子模拟
目前全原子MD模拟尚无法探测脂质体的大规模的结构和动力学,例如形态特性、波动动力学和自组装过程。研究人员尝试以较粗的分辨率进行模拟来探索基于脂质的DDS。粗粒化保留了脂质体中单个分子的大部分结构和化学特性,同时提供了探索其生物动力学相关动力学的机会,例如囊泡形成、裂变和融合。
MARTINI CG模型已被广泛用于构建各种大小的脂质体或胶束,这些模型可以评估脂质纳米颗粒的物理稳定性。通过使用CGMD模拟研究高度弯曲的脂质体膜, Risselada等人揭示了一种普遍的堆积效应,在内部单层中发现紧密堆积的脂质头部和无序的脂质尾部。通过混合 PC 和PE脂质,可以明显观察到两种成分的部分横向分层的趋势,尤其是在内单层中富含PE脂质。这说明PE更喜欢内部单层的凹体积,研究人员基于此合理设计了用于siRNA的阳离子脂质。
CG模拟还可以被用于评估脂质体作为药物载体的性能,例如用于光动力疗法的金丝桃素,被发现更靠近外脂质层的极性头部区域,并通过其更疏水的末端达到与脂质体内部的相互作用最大化(图5A)。Menichetti 等人还进行了高通量CGMD模拟以筛选 119 个分子,并确定了与实验确定的分配系数相关的有效分配自由能分布的关键特征。(图5B)他们重新审视了Meyer-Overton 规则,发现化合物的渗透系数由其分配自由能和 pKa 常数决定,常用化学修饰可能无意中限制了渗透率范围。在更大的长度和时间尺度上,可以用DPD和连续模型研究脂质囊泡在流体流动中的行为。
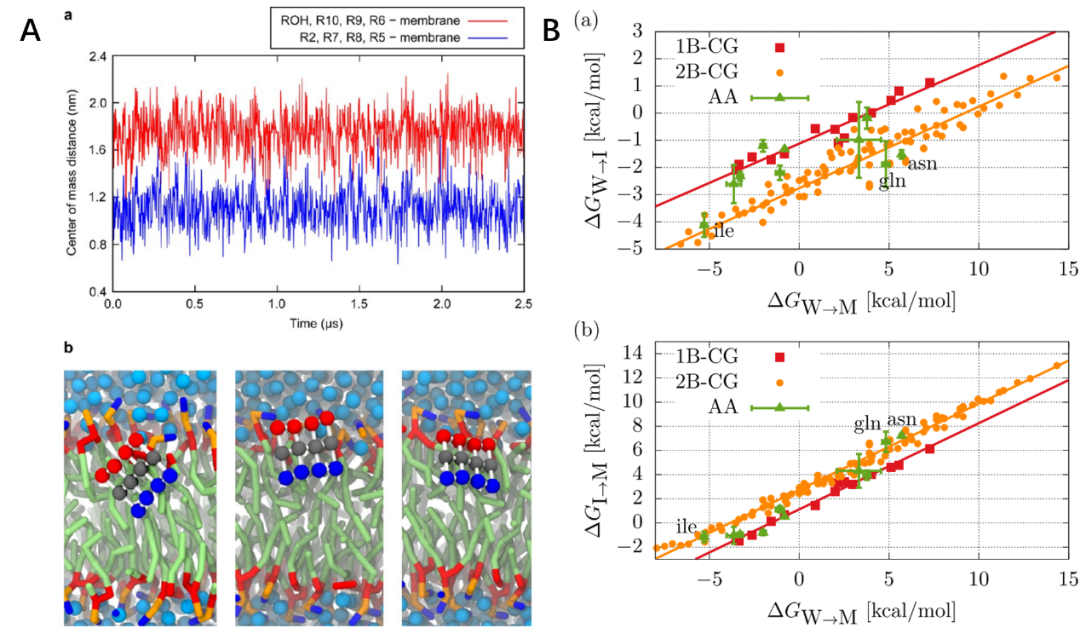
图5. A.金丝桃素的CDMD模拟,图片来源于:10.1021/ct400466m;B. 119种粗粒分子的三种转移自由能之间的关系, 图片来源于:10.1063/1.4987012
小结
分子模拟可以直接和间接地影响新型DDS的开发。虽然能够直接预测LNP的稳定性和形态,但CGMD模拟更常用于提供对感兴趣的膜系统的机理研究,例如结构特性、脂质-小分子相互作用,进而可用于指导LNP 成分优化或化学修饰以提高递送效率。
参考文献
Chan, C.; Du, S.; Dong, Y.; Cheng, X., Computational and Experimental Approaches to Investigate Lipid Nanoparticles as Drug and Gene Delivery Systems. Curr Top Med Chem 2021, 21 (2), 92-114.