

斯坦福大学的Rhiju Das团队提出了估算一个RNA抗水解稳定性的简单计算模型,将mRNA的平均未配对率(AUP)与其总水解率联系起来,有助于提高设计的mRNA的稳定性,以便优化mRNA疫苗。
背景介绍
信使RNA (mRNA)分子已显示出在当前COVID-19大流行中作为候选疫苗的潜力,并已成功研发出mRNA疫苗。然而RNA水解会对mRNA疫苗的制造、储存、运输以及药效的方方面面造成影响。因此,有必要探索如何设计mRNA分子以提高其稳定性。一种减少RNA水解的设计方法是增加RNA分子中二级结构的程度。双链区域的存在可以减缓水解,保护内联切割和酶降解,同时编码相同的蛋白质。
本文作者报道了一个理论框架和计算模型,表明结构感知设计能够快速且显著地稳定COVID-19 mRNA疫苗。作者提出了一个将RNA分子的总体水解率与碱基配对概率联系起来的原理模型,并定义了两个指标:分子未配对概率的总和(SUP),和平均未配对概率(AUP,它是由序列长度标准化的SUP)。该模型中,越小的AUP意味着越高的稳定性。
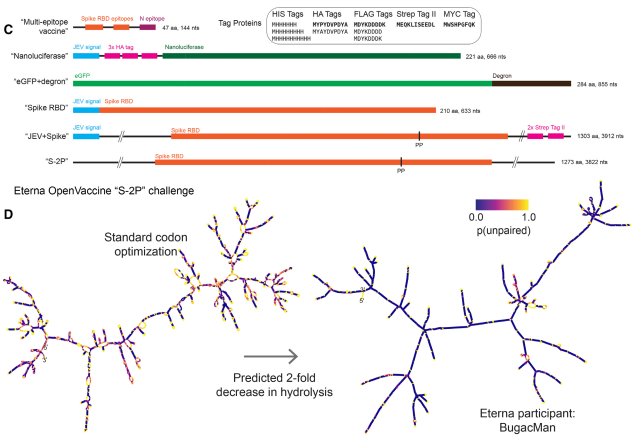
图1. mRNA序列以及优化设计。图片来源:NAR
RNA降解的生物物理模型
以往通过预测mRNA最稳定结构的折叠自由能来评估其稳定性,但尚不清楚这是否是提高RNA抗降解稳定性的正确指标。作者基于RNA降解的原则模型,提出了一种替代的指标。RNA水解的速率是每个核苷酸处于未配对状态的平衡概率的一个特性,这使得其3’磷酸二酯键容易采用内联攻击构象。作者假设配对或未配对核苷酸的降解速率遵循一级动力学(类似于为结合结构探测数据而开发的模型),引入SUP作为一个容易计算的可观察对象,直接与RNA分子的整体分裂率有关。
对于长度为N的RNA分子,SUP定义为
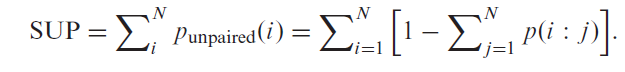
参数Punpaired(i)可以在最广泛使用的RNA二级结构预测包中进行预测,预测包可输出碱基对概率p(i: j),碱基对i与j配对的概率。
解离的总速率可以近似为SUP乘以常数kcleavage unpaired(kcleavage unpaired反映了一个未配对核苷酸的平均解离率):
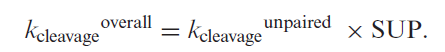
AUP定义为:
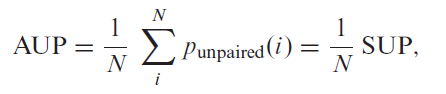
推导出:
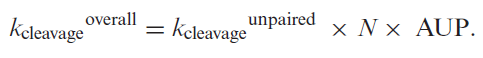
AUP值是一个介于0和1之间的数字,它反映了RNA的整体“非结构化”及任何二级结构基序中的未配对区域占的比例。较低的AUP值对应较低的未配对概率,RNA分子较不容易降解。在这个模型下,可以通过计算来研究一个RNA被重新计算形成稳定的二级结构后能稳定的程度。
SUP优化序列与密码子优化序列或
最小折叠自由能优化序列之间存在差异
为了研究mRNA降解期限可能的动态范围,作者从mRNA设计问题开始,选择了一组短肽标签进行评估(图2)。为了估计通过结构奖励设计可能实现的稳定性改善的范围,作者计算了从商业网站获得的常规设计mRNA序列的平均值与标签蛋白的最小AUP溶液之间的AUP比值,发现AUP变化范围为1.27 ~ 2.23倍。在作者的模型中,这意味着稳定性的显著增加。
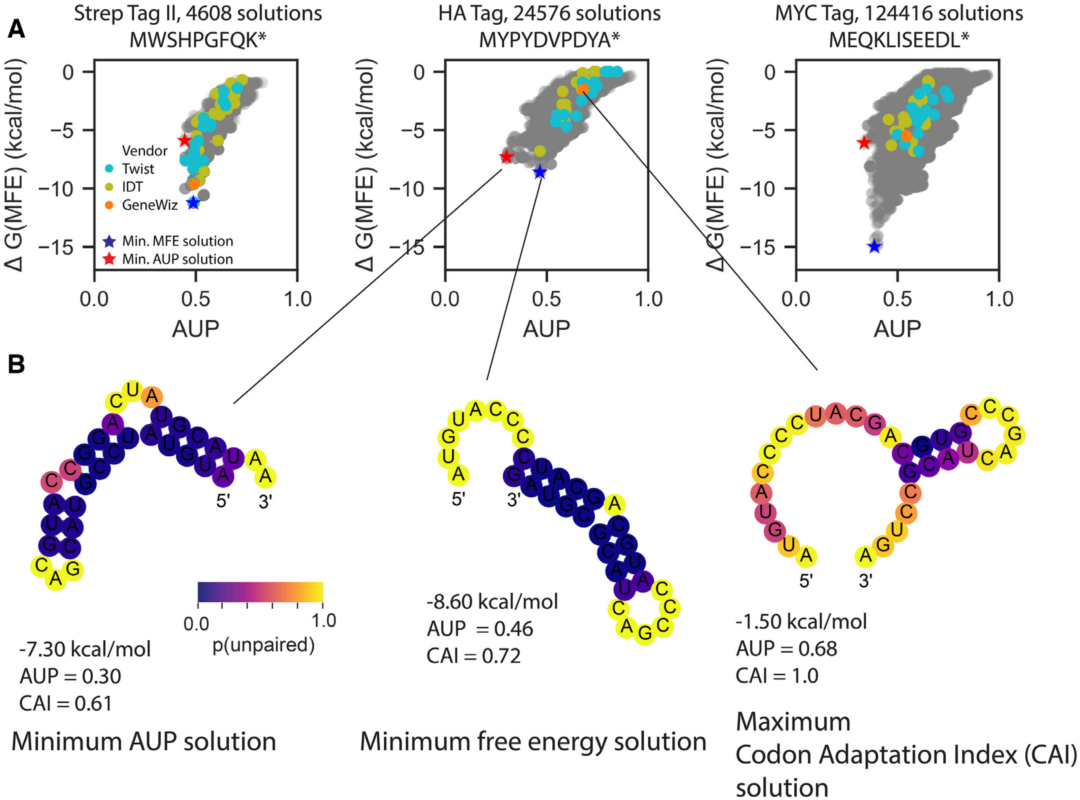
图2. 短肽标签蛋白评估结果。图片来源:NAR
作者探索了这种稳定性改善是否可以通过例如LinearDesign和CDS-fold等算法实现,这些算法优化了一个不同的度量,即最小自由能结构△G(MFE)的预测折叠自由能。对于多个模型系统,能量最低的MFE结构的编码序列与最低AUP的解决方案并不相同(图2A)。而最小AUP解决方案的“热点”少于最小自由能解决方案(图2B),证明了如果希望减少整体水解,较低的AUP会是首选标准。
对于长mRNA结构,AUP可以达到两倍的降低
随后作者测试了长度为数百个核苷酸编码各种目标蛋白的mRNA,以测试更现实的蛋白编码mRNA设计问题的适用性。作者进一步开发了一种随机蒙特卡罗树搜索算法RiboTree,以随机最小化模型mRNA的AUP。
此外,对比在线RNA设计平台Eterna上的Open Vaccine挑战的众包结果,作者在“p(unp)挑战”中请求额外的Eterna序列,即计算AUP指标并在游戏界面中提供给Eterna参与者以指导优化。
图3A中描绘的结构表明了低AUP结构的视觉特征: LinearDesign、CDSFold、RiboTree和Eterna的结果具有更长的螺旋,更少的环和连接,茎中的未配对概率更低(图中暗紫色)。在所有挑战中,AUP最小的解决方案与△G(MFE)最低的解决方案不同(图3B)。表2包含了由标准方法(密码子取样、基因供应商工具)分离的设计方法和旨在稳定二级结构的方法(Eterna AUP理性设计、CDSfold、LinearDesign、RiboTree)的AUP值的汇总统计。
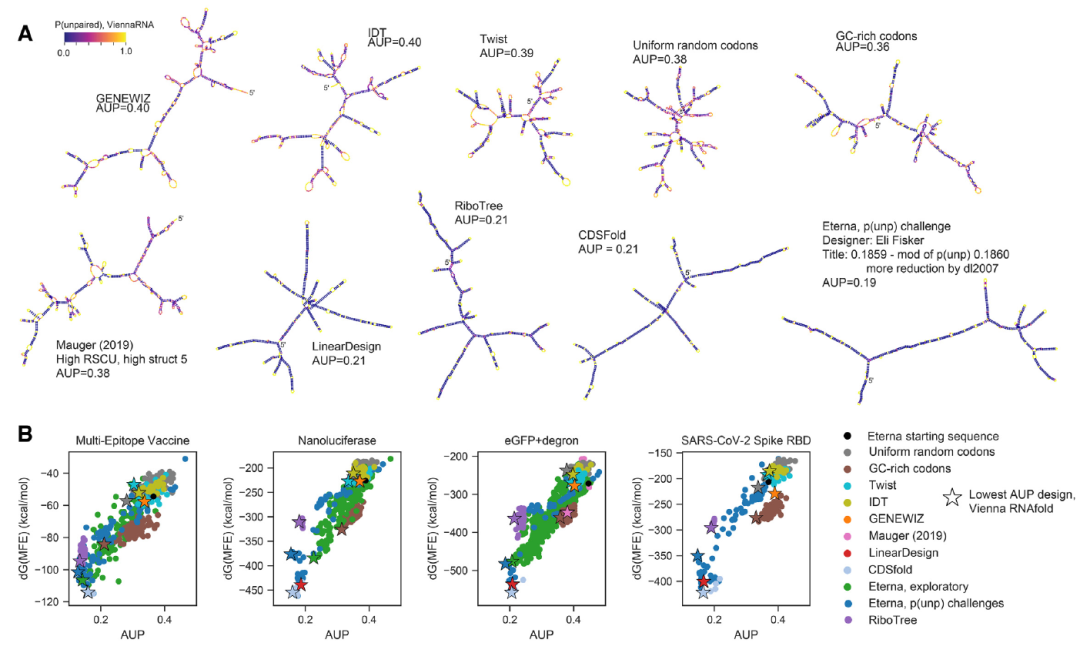
图3. Eterna众包设计。 图片来源:NAR
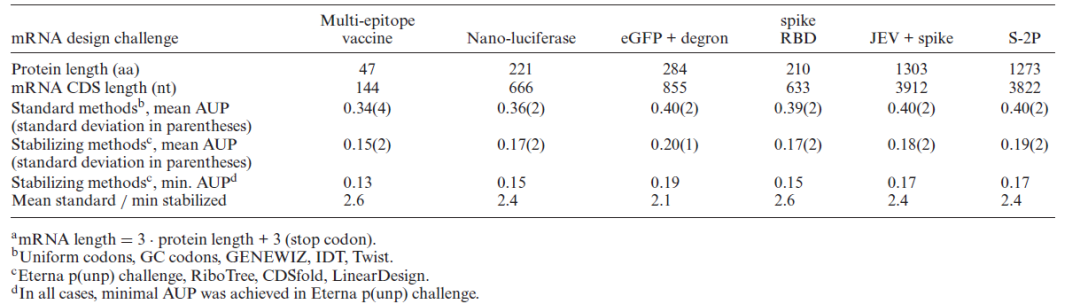
表1. 不同设计方法对mRNA设计挑战的AUP值比较。 表格来源:NAR
在“p(unp)挑战”中,Eterna参与者提交的AUP值显著低于标准方法,且其最低AUP值均低于从LinearDesign、CDSfold,或RiboTree获得的AUP值。RiboTree解决方案表现出较低的AUP,但不一定最小化△G(MFE)。作者指出在不减少△G(MFE)或△G(ensemble)的情况下,最小化AUP可能被证明是一种有价值的设计策略,用于开发储存稳定、但又需要一定的不稳定性以实现其翻译过程中功能的mRNA。
与翻译和免疫原性功能相关的特性的多样性
在确定了用低AUP设计mRNA序列的可行性后,作者希望确定这些序列是否可以翻译,以及预防或引发先天免疫反应。
作者发现,低AUP的mRNA设计(图4A)具有与高翻译效率一致的密码子适应指数值(CAI)。图4B、C分别显示了编码序列的前14个核苷酸未配对的概率范围(AUPinit,14),螺旋长度不超过33 nt,这表明它们不太可能提高先天免疫反应从而关闭细胞mRNA翻译。
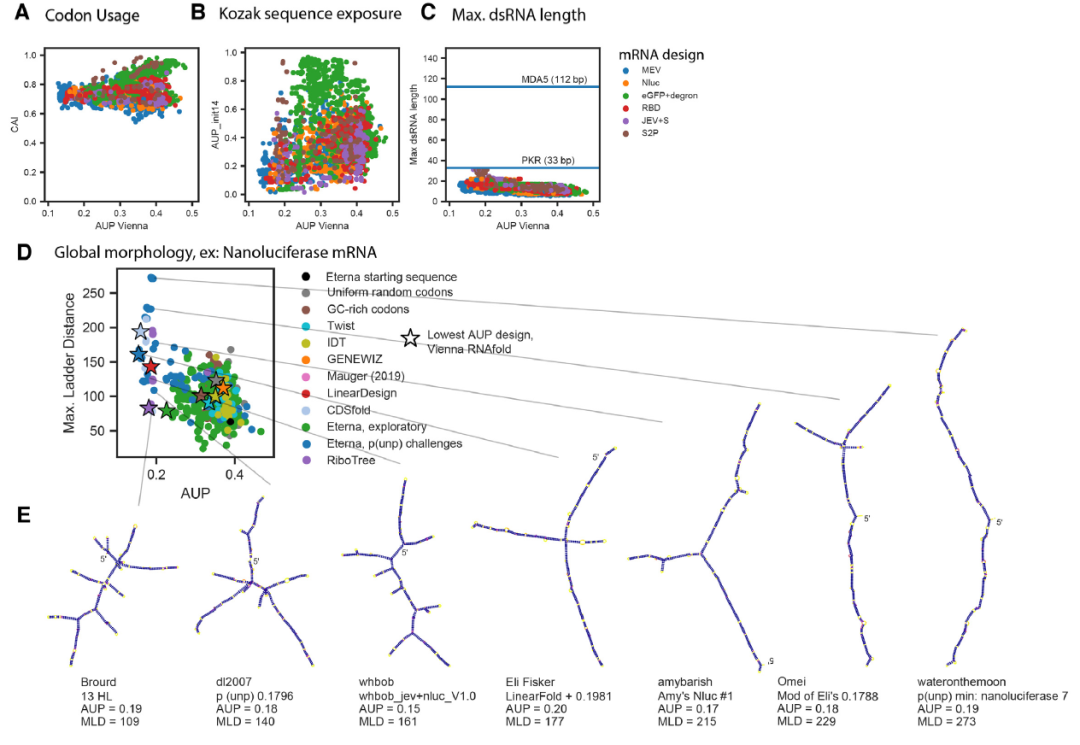
图4. 与翻译和免疫原性功能相关的特性的多样性分析。图片来源:NAR
作者同时对所设计序列的最大阶梯距离(MLD)进行了表征,以定量评价结构多样性。这种测量方法被用来描述病毒的基因组RNA的紧密性,并被猜测与病毒包装、免疫原性和生物持久性有关。作者注意到,对于AUP较低的序列,MLD值仍然在很大范围内(图4)。除了MLD,作者还计算了其他一些表征结构的指标,如不同类型环路和连接的数量。在所有情况下,在低AUP结果的中值范围超过2倍,强调了可获得的结构的多样性。
Eterna的参与者能够设计出
稳定的SARS-CoV-2全长spike蛋白mRNA
对于较长的mRNA设计问题,包括COVID-19疫苗中使用的SARS-CoV-2刺突蛋白mRNA配方(3822 nts),作者注意到与AUP相关的计算热动力学集成相关的计算速度变得缓慢,阻碍了由AUP指导的自动化或交互式设计。因此,为了寻求其他更快速计算的可观察到的结果,作者计算了许多可观测值与AUP之间的相关性,发现单个MFE结构中未配对核苷酸的数量与AUP的相关性最大,并利用这一观察结果在Eterna中推出了另一个设计思路: 将MFE结构中最小化未配对核苷酸的数量作为AUP的替代以设计疫苗。
尽管JEV +spike mRNA的长度是之前挑战的4倍多,但Eterna参与者仍能够找到与之前挑战相同的AUP值,且最佳AUP低于自动化方法实现的最低AUP。
在大多数疫苗配方中使用的SARS-CoV-2刺突蛋白序列是一个双脯氨酸突变体S-2P,它稳定了spike蛋白的预融合构象。作者启动了Enterna的最后一个谜题,要求找到编码S-2P的稳定mRNA的解决方案。Eterna社区投票选出的解决方案在保持低AUP值的同时显示了结构的多样性,AUP最低的解决方案在结构上与LinearDesign的△G(MFE)优化结构相似(图5A)。不同设计方法的AUP值在不同的mRNA长度上是一致的。通过将“标准”设计方法改为增加结构的设计方法,AUP降低了2倍,相当于mRNA半衰期增加2倍(图5B)。
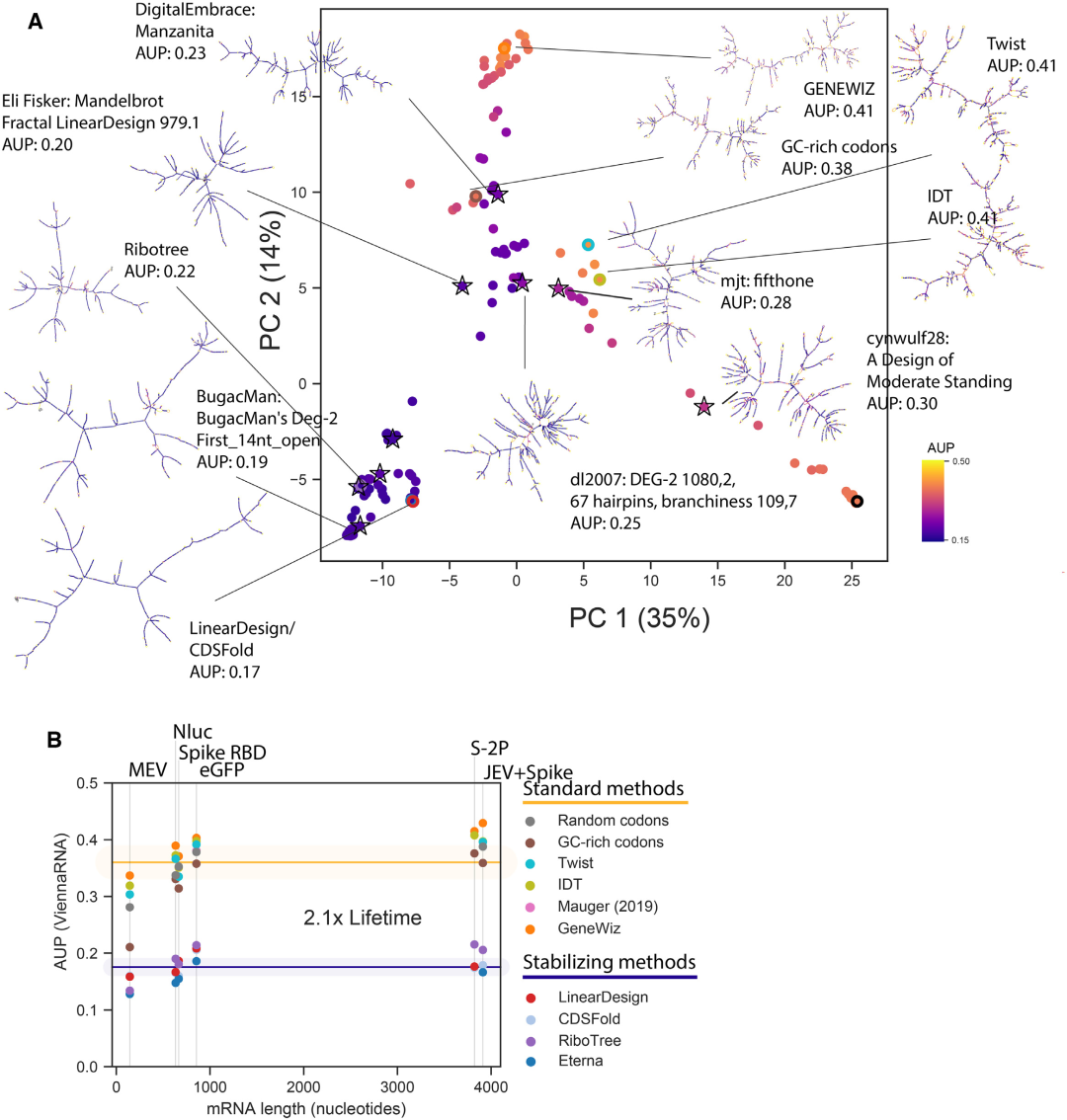
图5. SARS-CoV-2的全长Spike蛋白的稳定mRNA设计。 图片来源:NAR
在一些设计环境中,采用现有的高度稳定的mRNA设计而不是从头设计mRNA是有利的。作者发现,从低AUP解决方案中得到的预测稳定性,不论是当在更高的温度下计算时、在其他折叠算法中计算时,还是存在添加的UTR和蛋白质序列的小变化时,都是稳健的(图6)。
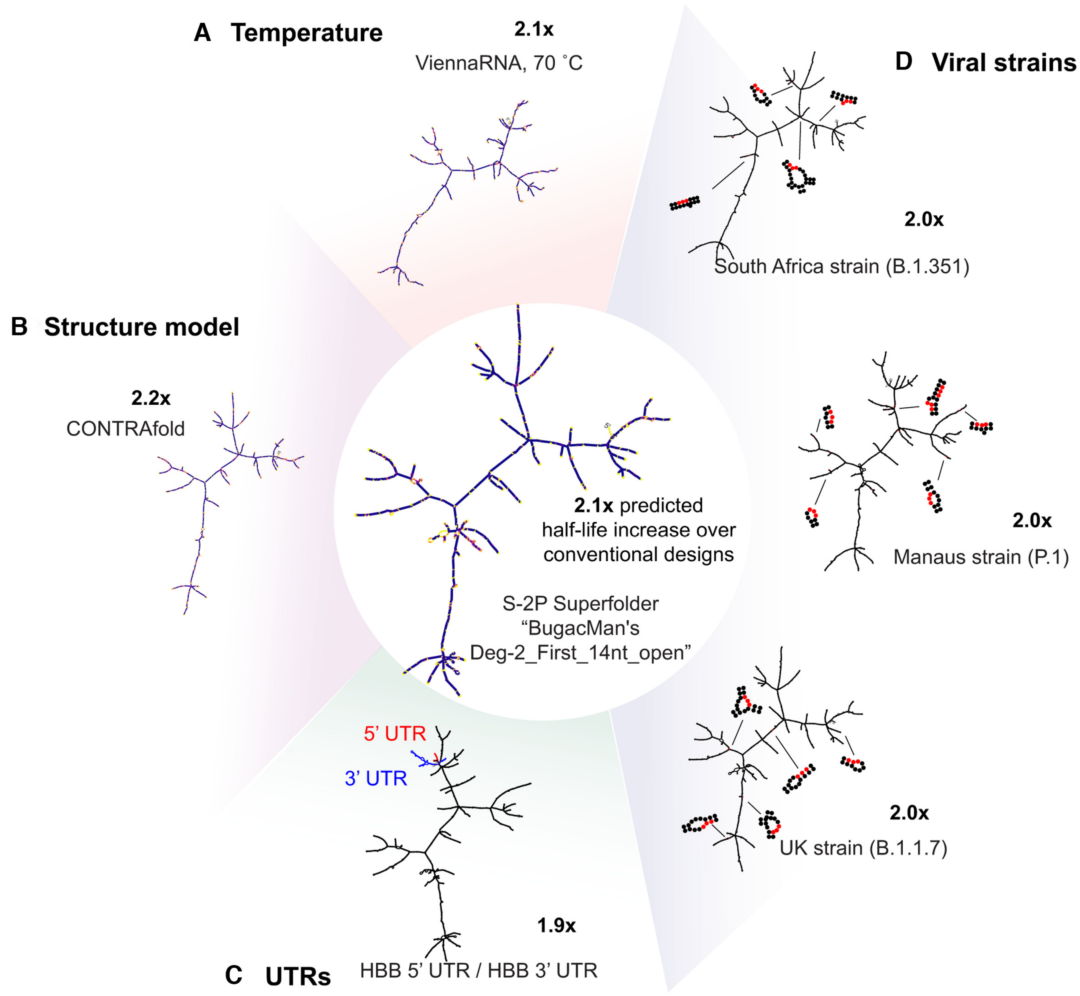
图6. 低AUP结果作为超级折叠mRNA。 图片来源:NAR
小结
本文介绍了通过基于结构的设计开发的一个稳定mRNA抗体外水解的框架。模型将RNA分子的降解速率与mRNA的平均未配对概率(AUP)联系起来。将传统mRNA设计方法的AUP优化和通过Eterna平台上的OpenVaccine挑战的众包结果进行比较发现,对Eterna的理性设计和更复杂的算法会导致低AUP结构,更不易降解,称之为“超级折叠”mRNA。这些设计显示了广泛的序列和结构特征的多样性,可能是翻译和免疫原性所需要的。此外,优化过的结构对温度、计算机建模方法、侧翼非翻译区域的选择和靶蛋白序列的变化具有较强的稳定性。mRNA半衰期增加至少两倍似乎是可以实现的,这可能是mRNA生物技术的重大改善。
参考文献
Wayment-Steele HK, Kim DS, Choe CA, Nicol JJ, Wellington-Oguri R, Watkins AM, Parra Sperberg RA, Huang PS, Participants E, Das R. Theoretical basis for stabilizing messenger RNA through secondary structure design. Nucleic Acids Res. 2021 Sep 14:gkab764. doi: 10.1093/nar/gkab764. Epub ahead of print. PMID: 34520542.