

Hu-mAb工具可以对输入序列进行人源化评分,同时提示可降低免疫原性并保持疗效的人源化突变位点,以此加速人源化过程。
背景介绍
单克隆抗体(mAb)疗法通常来自非人类来源(一般为小鼠),因此会在人体中产生免疫原性。人源化过程是为了降低抗体的免疫原性,保证其对人体的安全性,且不影响疗效。常规的人源化是一个反复实验的过程,周期长、且繁琐。通过实验方法进行的人源化更多的是一个试错的过程,包括将CDR区转移至完全人类序列的框架上,如果疗效消失,则会进行任意的反向突变,试图恢复其效果。
为了更快速的对抗体进行人源化,多种计算方法已被开发用于评估抗体的人源化程度。不过这些算法均存在着一些问题,包括需要手动输入、解析或者模拟抗体结构、缺乏人源化过程以及足够的训练数据集。最近,一种利用双向长短期记忆(LSTM)模型的深度学习方法在区分人类和小鼠序列方面表现很好,但也存在训练数据集大小受限的问题。
观察抗体空间数据库(Observed Antibody Space database ,OAS)是一个来自80项研究的Ig-seq输出数据库,其中包含近20亿个多余的抗体序列,跨越不同的免疫状态和生物(尽管主要是人类和小鼠)。利用机器学习和广泛的OAS序列数据,牛津大学统计系的Claire Marks等人构建了随机森林(RF)分类器,可以准确区分每个人类V基因和非人类可变区序列。RF分类器产生的“人性”评分与观察到的免疫原性水平呈负相关。作者使用这些模型构建了一个计算工具Hu-mAb,可以通过提示增加人性的突变,系统地使感兴趣的VH和VL序列人源化。Hu-mAb以最优的方式使序列人源化,最大限度地减少序列产生的突变数,以限制对疗效的影响。Hu-mAb人源化产生的突变与那些产生低免疫原性序列的实验性治疗人源化研究中产生的突变非常相似。Hu-mAb是试错人源化实验的有效替代品,可以在很短的时间内产生类似的结果。该算法是完全自动化的,无需输入结构,且比任何现有的方法使用更多的序列进行模型训练。
Hu-mAb在线网址
http://opig.stats.ox.ac.uk/webapps/newsabdab/sabpred/humab
网站首页:
模型评价结果
1. RF模型对OAS序列的分类性能
RF模型通过训练OAS IgG数据集生成。每个模型被创建为一个二进制分类器——将特定V基因型的人抗体序列(VH、VL kappa或VL lambda)作为阳性组,将相应链型的所有非人类序列作为阴性组。作者为每个V基因构建了不同的分类器。RF模型的性能是通过确定其正确区分人类特定V基因型序列和其他物种序列的能力来评估的。作者使用验证集来确定分类阈值,即让YJS最大化的值。然后使用为每个模型选择的阈值计算测试集的性能。结果显示,所有模型的性能都非常高,AUCs (ROC曲线下的面积)接近1或等于1。在验证集和测试集中也看到了类似的YJS值,所有模型得分为≥0.999。
2. RF模型与之前的LSTM模型比较
RF模型相比LSTM模型呈现出更好的结果。作者使用自己的序列数据集生成LSTM模型,并将其性能与RF模型进行了比较。在所有22个模型(每条链和每个V基因类型)中,RF模型在AUC和YJS得分上都优于LSTM模型。没有一个LSTM模型能够完全区分人类序列和阴性序列。
3. 治疗方法分类
作者首先从Thera-SAbDab获得了一套481种抗体治疗方法(开发阶段从Phase I至获批均包含)。每个VH和VL序列分别由各自的RF分类器集(VH、VL kappa或VL lambda)进行评分,如果单个模型评分为人类(高于YJS阈值),则将其归类为人类。对于VL序列,作者建立并使用了一个额外的RF模型,首先区分序列类型是kappa还是lambda。图1显示了分类为人类(按来源划分),按链类型(VH或VL)和混合(要求VH和VL都分类为人)分类的治疗比例。在176个人类序列中,除1个的序列轻链人源性得分(0.850)略低于对应的人源性阈值(0.856)外,其余均被准确分为人类,而小鼠序列均被分为非人类。随着抗体序列的人源含量的增加, RF模型将更多的治疗方法归类为人类。LSTM方法虽然也可以观察到这一趋势,但并不那么清楚,且更多的人源性抗体被LSTM方法归类为非人源性抗体。
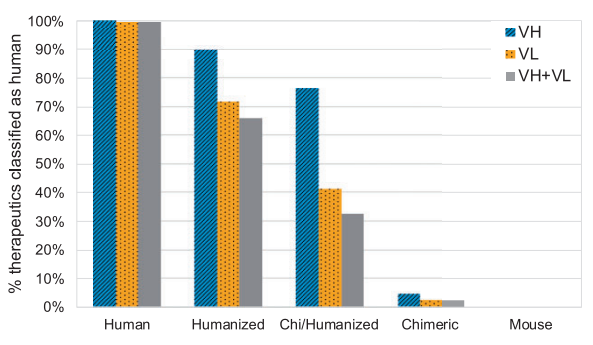
图1 由RF模型分类的人源性抗体比例。图片来源:Bioinformatics
4. RF模型评分与免疫原性的关系
人源化的目的是提供安全且不引起免疫反应的治疗方法。一个强的分类预测评分不足以产生一个人源化结果,因为它没有明确解释免疫原性。因此,作者通过ADA的测量结果,研究了模型评分与观察到的免疫原性反应之间关系。
作者评估了在217种治疗方法中,发生ADA的患者百分比与治疗者的VH和VL链的最低人源化评分之间的相关性,因为最少的人源链有望决定免疫原性水平。研究发现,较高的最小模型评分往往与较低的免疫原性相关,尽管相关性较弱(R2=0.31),但明显高于之前研究中观察到的相关性(R2=0.18)。作者将217种疗法按人性评分进行了分组(图2),并证明了高人源性得分与低免疫原性有关。
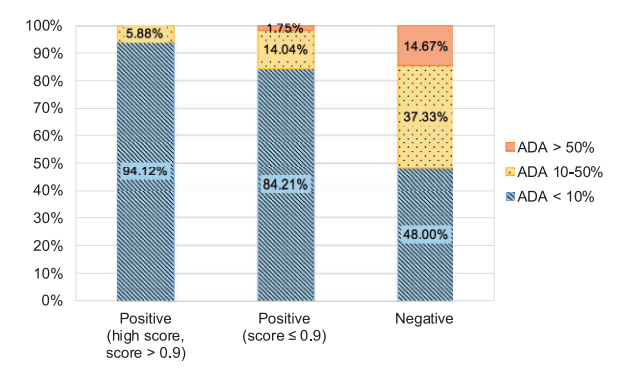
图2 RF模型产生的人性评分与实验确定的免疫原性之间的关系。图片来源:Bioinformatics
5. Hu-mAb:一种计算的人源化工具及其在以前的实验人源化治疗中的应用
由于高模型评分与较低水平的免疫原性相关,这表明最佳突变将增加输入序列的模型评分,从而降低免疫原性,作者使用该评分构建了一个计算人源化工具:Hu-mAb。工具中CDR中的残基不发生突变以维持抗原结合特性。理想情况下,人源化抗体应该产生尽可能少的突变,以减少治疗的疗效损失。为了研究Hu-mAb提示的突变与实验衍生突变之间的相似性,作者收集了具有低免疫原性且前体序列可获得的实验的人源化序列。通过每个RF模型对每个治疗方法的VH和VL序列进行评分,并通过选择得分最高的模型来识别V基因。将前体序列作为人源化器的输入序列,以及其目标人源性评分(通过实验得到的人源化序列获得的评分)和V基因类型。图3显示了Campath重链的一个结果示例。
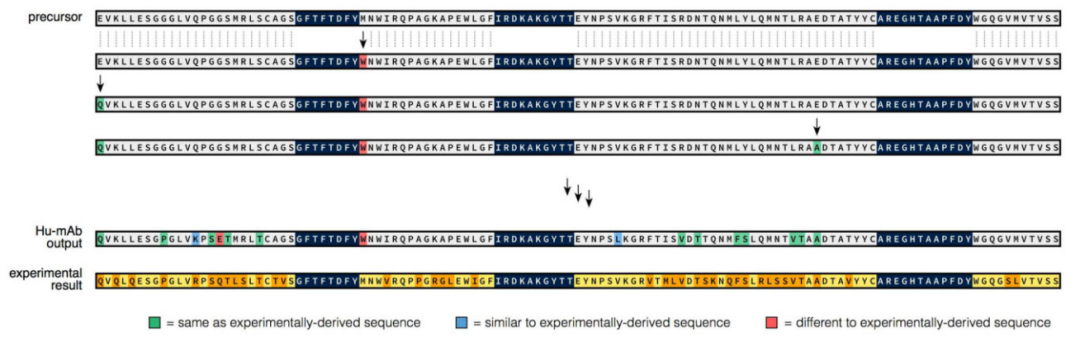
图3 Hu-mAb人源化程序使用Campath的重链序列结果。图片来源:Bioinformatics
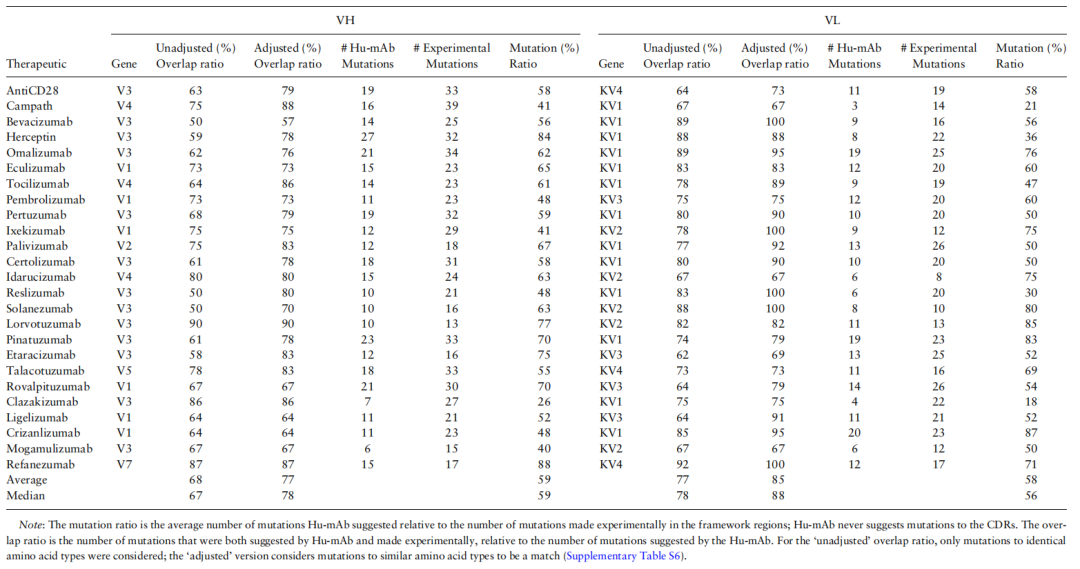
表1比较了25种治疗方法的前体序列(非人源化)的实验突变和Hu-mAb建议突变。这些治疗方法在实验人源化形式中都表现出低免疫原性。所有前体序列均来自小鼠、大鼠或兔,大多数模型评分接近0。
此外,Hu-mAb建议的突变比实验获得的突变更少,VH和VL的突变量分别为实验突变量的59%和58%。Hu-mAb建议的突变中,平均有68%和77%(分别为VH和VL序列)也是实验突变中的(重叠比,OR) 。包括类似残基类型的突变,VH和VL的平均调整OR(AOR)分别为77%和85%。这表明Hu-mAb提出的突变与实验中产生的突变非常相似。Hu-mAb正在利用抗体库中发现的信息,更有效地使抗体序列人源化。
表1实验人源化与计算工具Hu-mAb的比较。表格来源:Bioinformatics
6. Hu-mAb操作流程和RF模型分析
由于实验人源化过程通常涉及将非人类CDR移植到人类框架上,因此预计框架区域比高变CDR区域对人类和非人类序列的分类更重要。对RF模型的特征重要性的分析发现,这是正确的;识别的关键残基主要出现在框架区域(图4)。然而,该模型利用了一些CDR位置来进行识别。
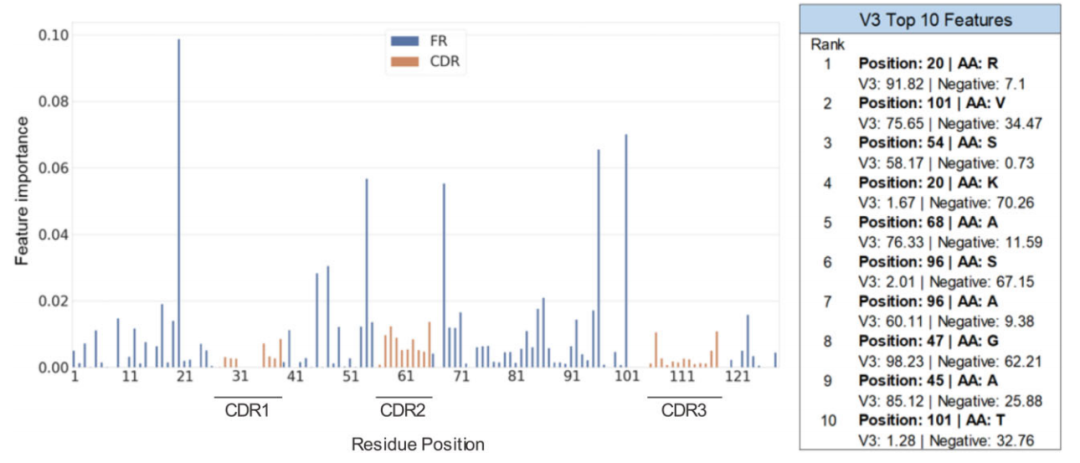
图4. VH V3 RF模型的特征重要性及其十大特性。图片来源:Bioinformatics
对Hu-mAb方案的分析显示,RF模型并没有独立地考虑序列中的位置,而是包含了残基之间的相互作用,以更现实地评估人源。与实验中产生的突变相比,在残基类型方面,Hu-mAb提出的突变也与实验结果非常相似。
抗体结合位点的几何形状取决于VH和VL的方向,而VL反过来又受到两个结构域界面上的残基的影响。Hu-mAb提出的突变对关键VH-VL界面残基的突变比例略低于实验的比例,这些残基的OR也高于平均值(VH/VL为74%/96%,而所有突变的平均比例为68%/77%)。Hu-mAb的平均突变也更少(为实验突变数量的58-59%),每个序列的平均界面突变数大约是实验突变的一半(重链0.8 vs 1.6,轻链0.8 vs 1.8)。在Vernier区也观察到类似的模式——Hu-mAb提出这些被认为会影响到CDR的构象残基的突变较少。这意味着使用Hu-mAb更能保留抗体的结合特性。
结论
本文介绍了一个全新的抗体人源化工具–Hu-Mab,可以同时人源化具有抗体治疗潜力的VH和VL。该模型基于RF分类器,在以抗体来源进行分类的方面显示出非常高的准确性。高效的Hu-mAb只选择提供最高人性评分增加的突变,且只对负责人源的框架区域的关键残基提出突变,尽可能减少突变;如有必要,它会逐步建议增加突变以降低免疫原性。与实验人源化治疗相比,Hu-mAb提示的突变数与实验提示的突变数高度相似(平均AOR为77/85%)。Hu-mAb为实验人源化方法提供了一个有希望的替代方案,允许以更系统和更有效的方式进行突变,并在很短的时间内实现类似的结果。
参考文献
Marks C, Hummer AM, Chin M, Deane CM. Humanization of antibodies using a machine learning approach on large-scale repertoire data. Bioinformatics. 2021 Jun 10:btab434. doi: 10.1093/bioinformatics/btab434. Epub ahead of print. PMID: 34110413.