引言
本文是2016年发表在Nat Rev Drug Discov的综述,详细介绍了两种冠状病毒SARS和MERS的药物发现和治疗策略,希望对当前武汉新型冠状病毒的药物研发有所借鉴与帮助。
背景介绍
冠状病毒(Coronaviruses, CoV)是一组高度多样的、包膜的、阳性的单链RNA基因,序列大小约为26~32 kb, 具化有5’端的甲基化帽子和3’端的聚腺苷酸尾部,结构形态上类似皇冠,膜表面有三种糖蛋白:刺突糖蛋白spike glycoprotein (S)、包膜蛋白envelope protein (E), 膜糖蛋白mem-brane protein (M) 和核衣壳蛋白nucleocapsid protein (N)。之前爆发过两次严害危害人类健康的冠状病毒,分别是2003的严重急性呼吸综合征(SARS)和2012年的中东呼吸综合征(MERS)。可在人类及多种动物中引起不同程度的呼吸、肠道、肝脏和神经系统疾病 。
SARS和MERS的流行病学分析
SARS. 在2002年11月,广东省佛山市发生一起非典型肺炎疫情,医院感染率高2003年3月,一种新型冠状病毒被证实是SARS的病原体,被命名为SARS-CoV。2003年7月疫情结束时,感染SARS-CoV共8098例,死亡774人。通过血清学研究和病毒基因序列分析显示,从蝙蝠中分离出与人类SARS病毒序列高度相似(88-95%)的冠状病毒,表明蝙蝠可能是SARS冠状病毒近缘祖先的天然宿主 。
MERS. 在2012年6月,从一位死于严重肺炎和多器官衰竭的沙特阿拉伯患者中分离出一种新型的β-CoV,被称为中东呼吸综合征(MERS)。截至2015年10月9日,世界卫生组织报告了1593例经实验室确诊的MERS病例,包括568例死亡。MERS-CoV主要是一种人畜共患病病毒,具有非持续性人与人之间传播的能力。血清学和病毒学研究表明,骆驼和蝙蝠是MERS-Co最可能的动物宿主。MERS-CoV的人与人传播发生于防范不到位的医疗场所和家庭聚集。
SARS和MERS的临床特征
这两种疾病都有主要的呼吸系统表现,但严重的病例可能出现肺外症状。值得注意的是,早期治疗对严重MERS患者尤其重要,因为这种疾病发展到呼吸窘迫、肾衰竭和死亡的速度比SARS要快得多。MERS相对SARS的病死率高出3到4倍,可能与MERS患者的年龄较高,合并症患病率较高以及两种疾病的发病机制不同有关。
SARS和MERS的处理策略
器官支持和并发症的预防,特别是急性呼吸窘迫综合征、器官衰竭和继发医院感染,仍然是SARS和MERS最重要的管理策略,因为目前还没有一种特殊的抗病毒治疗方法在随机对照试验中被证明是有效的。虽然,许多化合物在细胞培养或动物模型中被发现能抑制SARS-CoV和MERS-CoV的进入和(或)复制,但体外实验中的活性并不一定能转化为对人类的有效性。由于SARS和MERS的高发病率和高死亡率,其中一些抗病毒药物和免疫调节剂被使用(表1),采用这些研究疗法需要在当地伦理委员会的批准下,对照研究试验中应用标准的研究治疗方案和系统的临床和病毒学数据收集。
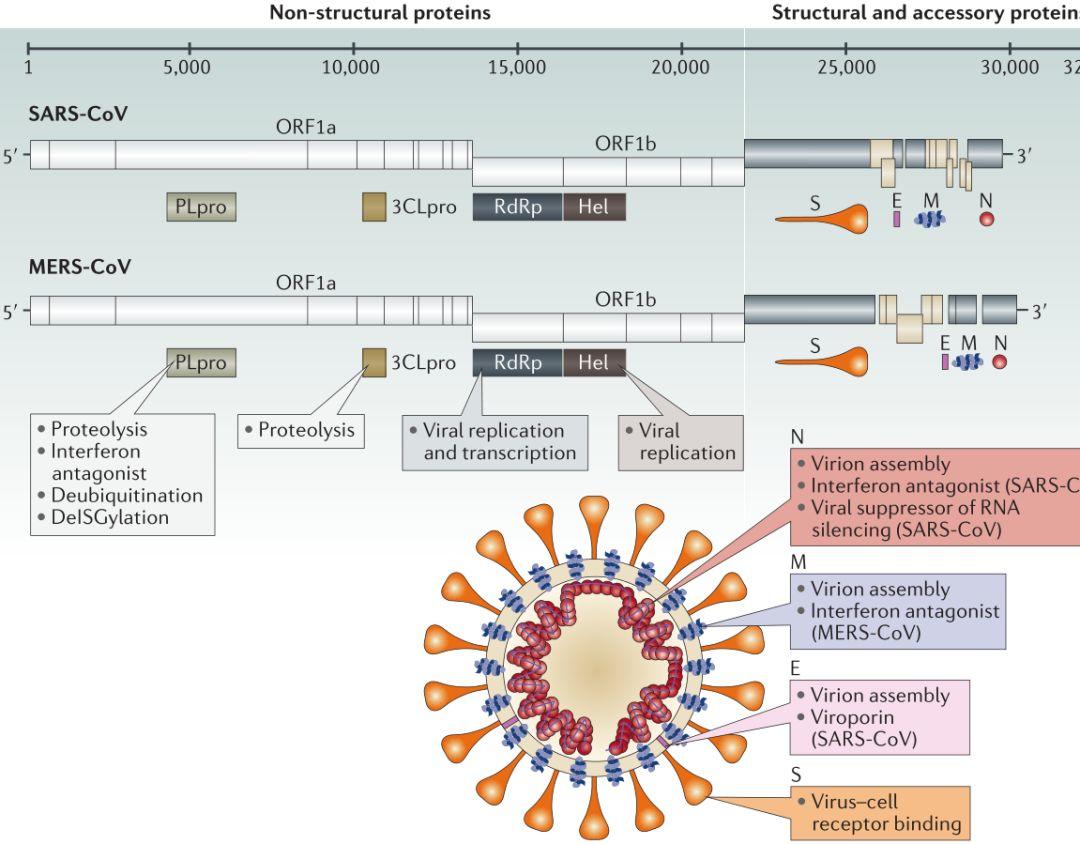
图1 . SARS-CoV和MERS-CoV的基因组和结构
图片来源:Nat Rev Drug DisCov
抗CoV疗法的研究进展
新药开发的关键CoV靶点
尽管CoV具有高度的物种多样性,但它们共享关键的基因组,可成为设计抗CoV抑制剂的关键靶点。5ʹ末端开放阅读框(ORF1a/b)编码的多聚蛋白质(pp1a和pp1ab)可被木瓜蛋白酶样蛋白酶(PLpro)和3C样蛋白酶(3CLpro)切割,产生非结构蛋白(NSPs),如RNA依赖性RNA聚合酶(RdRp)和解螺旋酶,参与病毒的转录和复制过程(图2)。
CoV表面结构的棘突糖蛋白(S)在病毒-细胞受体相互作用中起着关键作用,对抗病毒药物的开发具有特殊的意义。棘突糖蛋白由氨基末端受体结合S1和羧基末端膜融合S2亚基组成。为了激活膜融合、病毒进入和合胞体的形成,需要在S1-S2连接处的蛋白酶位点进行切割。S1亚基受体结合域(RBD)与宿主受体的结合,触发S2亚基(S区)的构象变化,使病毒和细胞膜接近并能融合。针对S1-RBD的单克隆抗体(mAbs)和针对S2亚单位的融合抑制剂在体外和/或体内具有强大的 抗CoV活性。
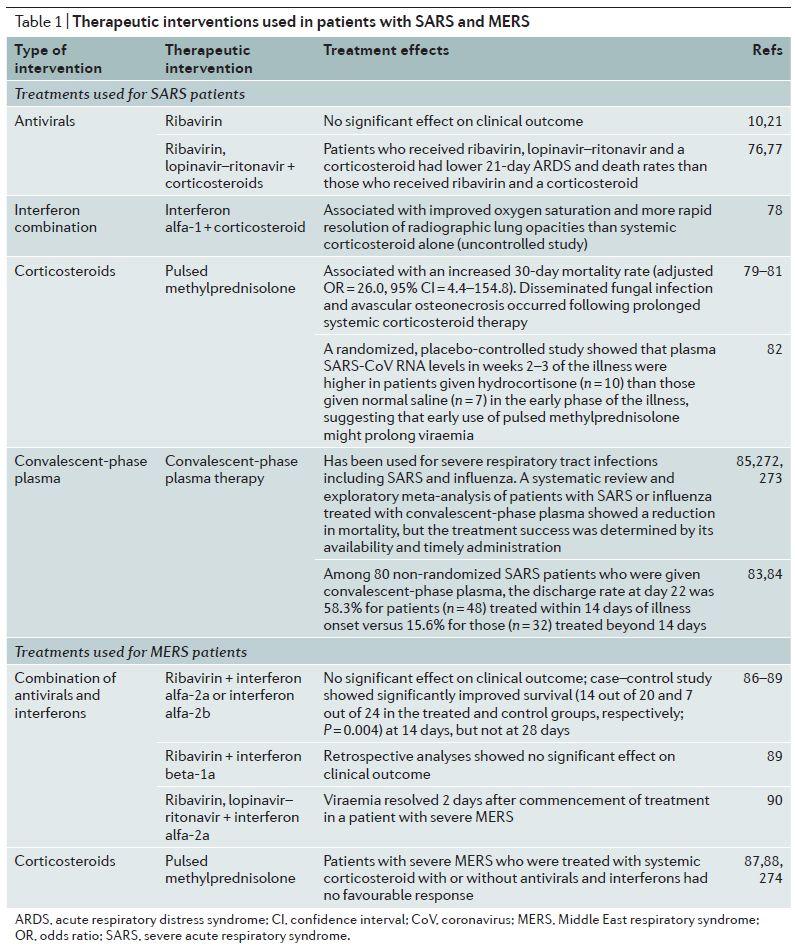
表1.SARS和MER患者的治疗方法及效果
图片来源:Nat Rev Drug DisCov
宿主受体在决定病毒的致病性、组织倾向性和宿主范围方面具有重要作用。靶向宿主受体的单克隆抗体或药物是潜在的抗CoV药物。人类致病性冠状病毒利用的关键功能性宿主受体包括血管紧张素转换酶ACE2(SARS-CoV和HCoV-NL63); 二肽基肽酶DPP4(MERS-CoV), 氨基肽酶N (HCoV-229E), O-乙酰化唾液酸 (HCoV-OC43 和HCoV-HKU1)。
CoV通过内质体途径或细胞表面非内质体途径进入宿主细胞, 低pH值和pH依赖性的内质体半胱氨酸蛋白酶等组织蛋白酶类,有助于克服能量不利的膜融合反应,促进CoVs的细胞进入。其他宿主蛋白酶,如跨膜蛋白酶丝氨酸2(TMPRSS2)和TMPRSS11D(也称为气道胰蛋白酶样蛋白酶),可将S切割成S1和S2亚单位,激活S,使细胞表面的非内质体病毒进入质膜。这些蛋白酶的抑制剂可以部分阻断CoVs细胞进入。MERS-CoV也被弗林蛋白酶(furin)激活,furin是一种丝氨酸内切蛋白酶,参与了融合蛋白的加工和其他RNA病毒的细胞进入(包括HIV、禽流感A/H5N1病毒、埃博拉病毒、马尔堡病毒和黄病毒)。此外,Furin也参与MERS-CoV的 S1/S2从感染细胞中分离的过程。与多种细胞进入途径有关的宿主蛋白酶抑制剂的单一治疗和/或组合治疗在体外具有强大的抗CoV活性,不过仍需在动物研究中进一步评估。
CoVs在宿主细胞内解体,将核衣壳和病毒RNA释放到细胞质中,然后ORF1a/b转化为pp1a和pp1ab,基因组RNA进行复制。pp1a和pp1ab裂解产生的大量非结构蛋白NSPs,形成复制-转录复合物。CoV复制-转录复合物的疏水结构域附着在内质网(ER)的限制膜上,产生典型的CoV复制结构,包括双膜囊泡和卷曲膜。转录全长正链基因组RNA,形成全长负链模板,用于合成新的基因组RNA和重叠的亚基因组负链模板。然后合成并翻译亚基因组mRNAs,产生结构蛋白和辅助蛋白。由核衣壳蛋白(N)和基因组RNA组装而成的螺旋状核衣壳与其他结构蛋白相互作用,形成组装的病毒离子,然后通过胞吐释放到细胞外室。病毒通过胞吐释放到细胞外室,重复病毒复制周期。以这些结构基因为靶点的siRNAs可用于CoV感染的治疗,进一步优化siRNAs的体内传递可能使其临床应用成为可能。
抗CoV药物开发的三种方法
当2003年SARS-CoV突然出现时,研究人员和研究机构采用了三种通用的方法来发现人类致病性冠状病毒的潜在抗冠状病毒治疗方案。
第一种方法是测试现有的广谱抗病毒药物。包括α干扰素、β干扰素、γ干扰素、利巴韦林和环亲素抑制剂。这些药物具有明显的优势,即具有已知的药代动力学和药效学特性、副作用和给药方案。然而,它们没有特定的抗CoV作用,可能与严重的不良反应有关。
第二种方法是筛选已有的化学库或数据库。这种方法提供了快速,高通量筛选许多现成的化合物,然后可以进一步评估抗病毒试验。在非人灵长类动物模型和非随机临床试验中发现抗HIV蛋白酶抑制剂洛匹那韦-利托那韦对抑制CoV有效。这种方法的主要缺点是,尽管许多已鉴定的药物在体外具有抗CoV活性,大多数不是临床上有用的,因为它们与免疫抑制作用相关,或者它们具有抗CoV半数有效浓度(EC50),其显著超过治疗剂量可达到的峰值血清浓度(CMAX)水平。
第三种方法是针对CoV的基因组信息和病理学特征,开发特异性的药物。包括靶向参与病毒复制周期的关键酶的siRNA分子或抑制剂、靶向宿主受体的单克隆抗体、宿主细胞蛋白酶抑制剂、宿主细胞的病毒内吞抑制剂、人类或人源化单克隆抗体。靶向S1亚单位RBD和靶向S2亚单位的抗病毒肽(图2)。尽管这些药物在体外和/或体内都有很强的抗CoV活性,但它们的药代动力学和药效学特性以及副作用尚待在动物和人体试验中评估。此外,将这些候选药物开发成临床有用的治疗方案,通常需要数年时间。
总的来说,这三种药物发现方法通常在CoV暴发期间一起使用,以确定候选药物化合物,这些化合物可大致分为基于病毒和基于宿主的治疗方案。接下来将详细讲述基于病毒和基于宿主的治疗方案。
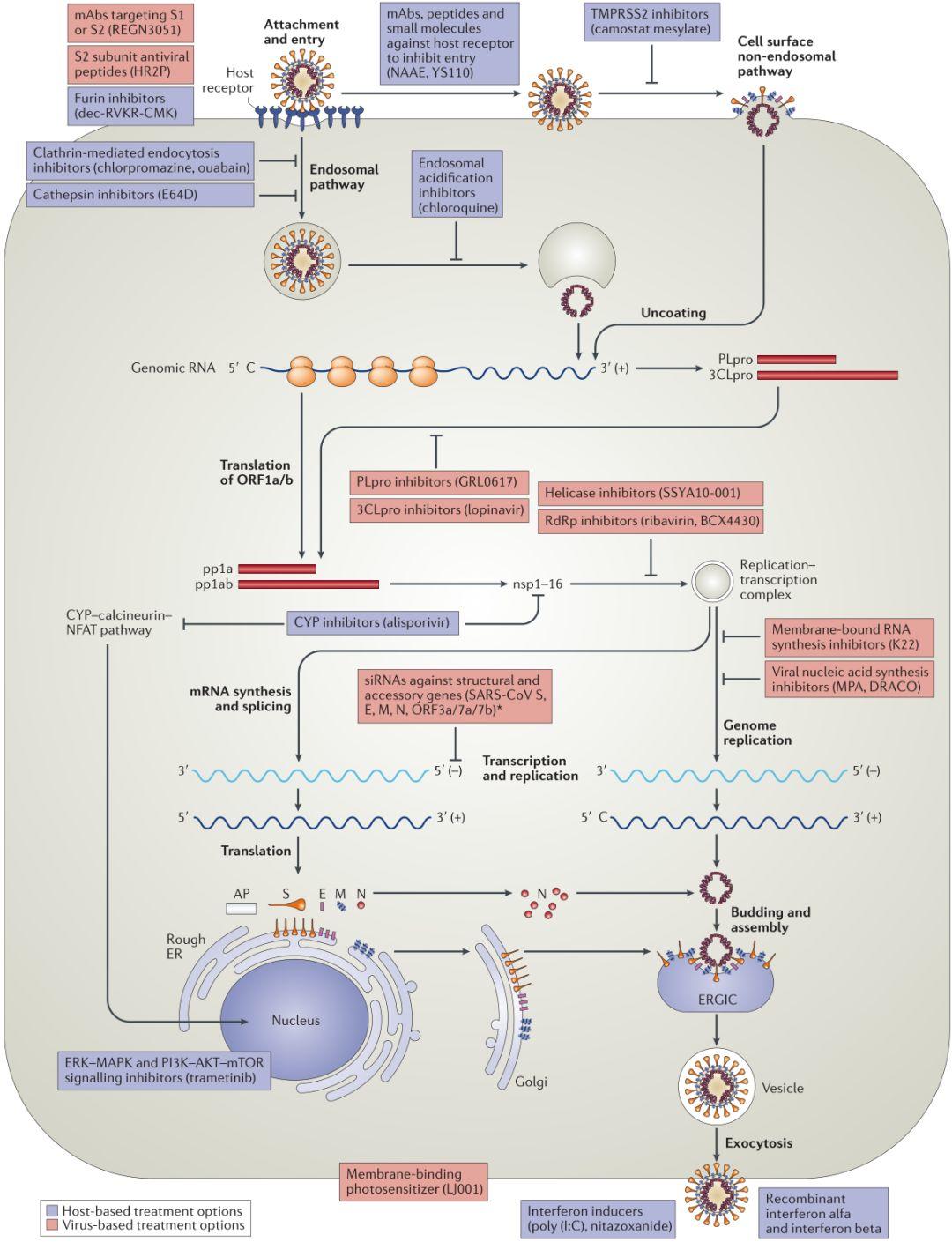
图2 .冠状病毒复制周期的基于病毒和宿主的治疗选项
图片来源:Nat Rev Drug DisCov
基于病毒的抗CoV治疗策略
针对病毒核苷、核苷酸和核酸
核苷和核苷酸是病毒核酸的组成部分。以核苷或核苷酸和/或病毒核酸为靶点的药物通常具有广谱抗多种冠状病毒和其他病毒的活性(表2)。霉酚酸酯(Mycophenolate mofetil)是一种抑制肌苷单磷酸脱氢酶和鸟嘌呤单磷酸酯合成的抗排斥药物。活性化合物麦考酚酸(mycophenolic acid)在体外对各种病毒具有抗病毒活性。高通量筛选发现麦考酚酸在体外具有较强的抗MERS-CoV活性。然而,随后在非人类灵长类动物模型中的研究表明,与未经治疗的动物相比,用霉酚酸酯治疗的MERS共染的普通绒猴的病情更严重,坏死的肺和肺外组织中的病毒载量更高。接受霉酚酸酯维持治疗的肾移植受者也出现严重或致命的MERS。因此,霉酚酸酯单药治疗的常规剂量不太可能用于预防或治疗冠状病毒感染。
核酶(RNA酶)是催化特定生化反应的RNA分子。一种存在于SARS-CoV mRNA的loop区的嵌合DNA-RNA锤头状核酶,特异识别碱基序列GUC,在体外显著降低了重组SARS-CoV RNA的表达。然而,核酶在体内迅速降解,因此必须优化人体内的传递方法。此外,还研究了针对特定宿主细胞膜结合CoV复制复合物的药物。其中一种化合物K22,抑制膜结合CoV-RNA的合成,在体外,有的广泛CoV具有活性。在细胞培养中,K22在病毒复制周期的早期阶段发挥作用,损害DMVs的形成。抗K22的HCoV-229E逃逸突变体在NAP6的潜在跨膜结构域中有替换,NSP6是参与DMV形成的CoV复制复合物的跨膜组成部分,包括NSP 6H121L和NSP 6M159V。在随后的体内研究中,应监测K22耐药性的出现。
近年来,一类以长病毒双链RNA(dsRNA)为靶点的广谱抗病毒药物被报道。例如,dsRNA激活的caspase寡聚物(DRACO)是一种具有病毒dsRNA结合域和促凋亡域的嵌合蛋白,其选择性地诱导含有病毒dsRNA的宿主细胞凋亡,但保留未受感染的宿主细胞。DRACO在体外、体内,对许多RNA病毒都有活性。如果能够实现有效的DRACO给药方式,一种针对高度保守的CoV-RNA序列的广谱抗CoV药物可能成为现实。
针对病毒内的关键酶
所有参与CoVs复制的主要酶和蛋白质都是潜在的药物靶点(表2)。SARS-CoV和MERS-CoV的PLpro酶具有蛋白水解、二氢喹啉化和去糖基化的作用。结晶学促进了这些PLpro酶的表征和抑制剂的鉴定。目前,鉴定出了不同种类的SARS-CoV-PLpro抑制剂,包括小分子抑制剂、硫嘌呤化合物、天然产物、锌离子和锌共价抑制剂以及萘抑制剂。然而,其中一些药物只抑制PLpro的酶活性而不抑制病毒复制,反之亦然。在动物或人类研究中均未验证。此外,由于不同CoVs的PLpro酶的结构差异,大多数PLpro抑制剂具有窄谱活性。由于SARS-CoV和MELS-CoV的PLpro酶的结构不同,阻断loop2(BL2)结构域,大多数SARS-CoV-PLPro抑制剂对MELS-CoV不起作用。
3CLpro是另一种主要的CoV蛋白酶,在病毒复制过程中切割pp1a和pp1ab蛋白。SARS-CoV 3CLpro可被多种蛋白酶抑制剂靶向,包括锌或汞结合物、C2对称二醇、拟肽-α、β-不饱和酯、苯胺、苯并三唑、N-苯基-2-乙酰胺、联苯砜、谷氨酸和带有三氟甲基酮基的谷氨酰胺肽,嘧啶酮和吡唑类似物。其中一些3CLpro抑制剂,在体外,对具有高度相似的底物识别关键残基的CoVs具有广谱活性。在这些3CLpro抑制剂中,洛匹那韦lopinavir,一种用于治疗艾滋病毒感染的蛋白酶抑制剂,通常以利托那韦增强型(洛匹那韦-利托那韦)的形式销售。洛匹那韦、洛匹那韦-利托那韦在体外、感染MERS-CoV的非人灵长类动物和SARS患者的非随机试验中均具有抗CoV活性。不过耐药性,还有待观察。
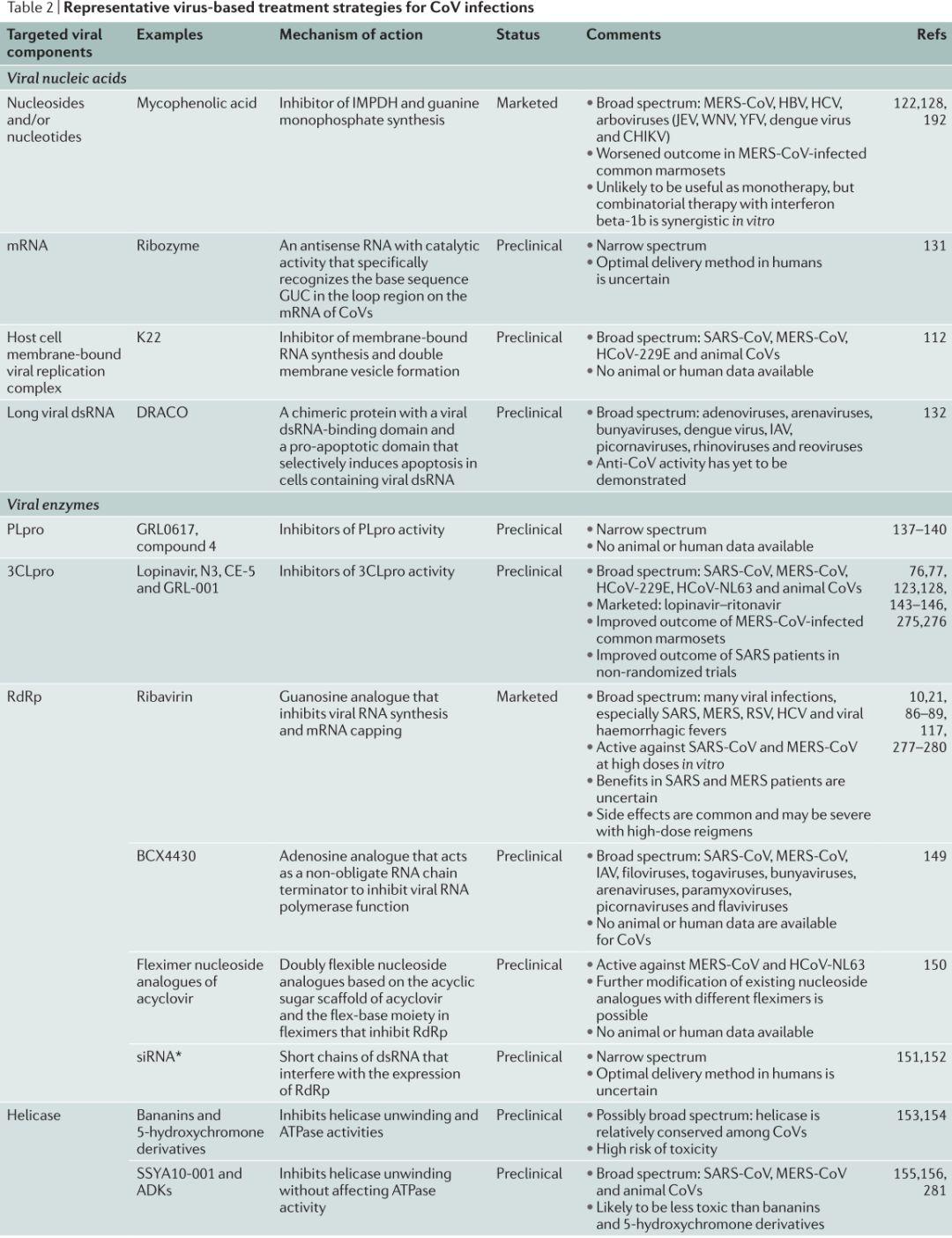
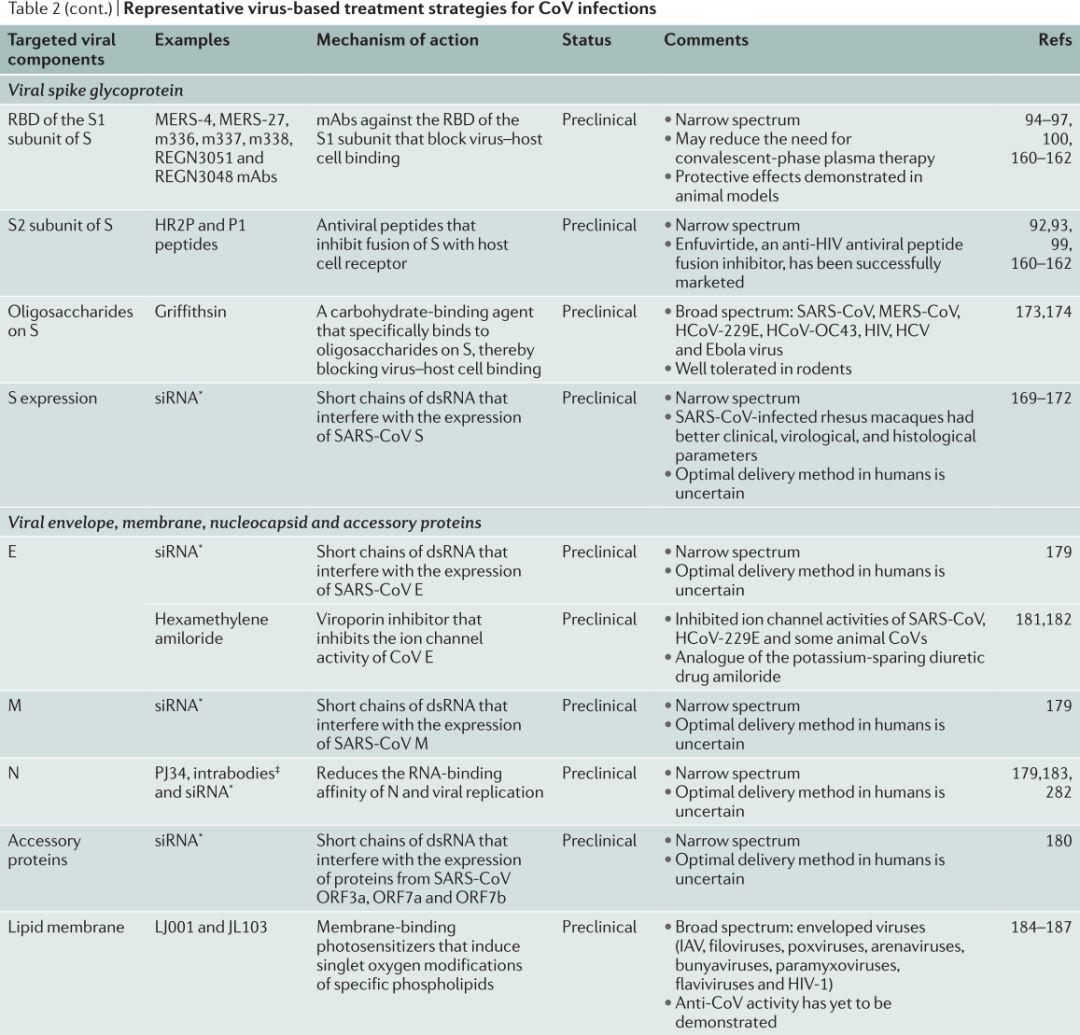
表2.基于病毒的抗CoV感染治疗策略
图片来源:Nat Rev Drug DisCov
RdRp是CoV复制-转录复合物的重要组成部分,参与基因组和亚基因组RNA的产生。利巴韦林是一种具有广谱抗病毒活性的鸟苷类似物,已用于治疗严重呼吸道合胞病毒感染、丙型肝炎病毒感染和病毒性出血热。其确切的作用机制尚不清楚,但抑制mRNA封顶和诱导RNA依赖性病毒复制突变。大剂量利巴韦林已被用于治疗SARS患者,但其疗效尚不明确。在体外和感染MERS-CoV的恒河猴中,高剂量的MERS-CoV具有中等的抗MERS-CoV活性,但在小群体的MERS患者中没有明显的生存优势。而且,大剂量利巴韦林会造成严重副作用,限制了其在严重CoV感染患者中的临床应用。
最近,一种新的腺苷类似物BCX4430(免疫球蛋白-A)被开发出来。它是一种非专一的RNA链终止剂,可抑制多种RNA病毒的RNA聚合酶,包括SARS-CoV和MERS-CoV等冠状病毒以及埃博拉和马尔堡病毒等丝状病毒。它在人类用途的发展已经被快速跟踪,以增加最近在西非流行的埃博拉病毒的治疗选择的数量。现有的核苷类似物,如阿昔洛韦,可以通过加入柔性体来修饰,增加结合的亲和力,并且可以克服结合位点的突变引起的抗性。这些非环柔性核苷类似物,在体外微摩尔浓度下,抑制MERS-CoV和HCOV-NL63。值得注意的是,由于RdRp突变,引起核苷类似物的耐药性已被报道用于其他RNA病毒,当这些药物用于治疗CoV感染时,应予以监测。除了核苷类似物外,靶向SARS-CoV-RdRp的siRNA分子也被用于体外抑制SARS-CoV。
在CoV复制周期中,在ATP依赖性反应中,解旋酶催化双链寡核苷酸解聚成单链。由于不同CoV的解旋酶具有高度同源性,因此解旋酶抑制剂是抗CoV治疗的重要选择。根据其作用机制,CoV螺旋酶抑制剂可大致分为两类。第一组包括巴拿宁和5-羟基色酮衍生物,它们抑制SARS-CoV螺旋酶的解旋和ATP酶活性,从而抑制病毒的体外复制。然而,由这些化合物抑制细胞ATP酶或激酶所产生的毒性限制了它们的开发。第二类CoV螺旋酶抑制剂包括选择性抑制CoV螺旋酶解旋活性而非ATP酶活性的化合物。SSY A10-001就是一个例子,它是一种三唑类化合物,能抑制多种CoV,包括SARS-CoV、MERS-CoV和小鼠肝炎病毒。SSY A10-1001的毒性还需在动物模型中验证。
针对病毒的刺突糖蛋白
包膜上的刺突糖蛋白S是一种主要的免疫原性抗原,对病毒和宿主细胞受体之间的相互作用至关重要(图2)。含有抗MERS-CoV-S抗体的血清,阻断了病毒附着,加速了MERS-CoV感染的BALB/c小鼠的肺内病毒清除,这些小鼠最近被导入腺病毒载体表达人类DPP4(表2)。在症状发作后3周,小群体SARS患者接受含有中和抗体(可能是针对CoVs)的康复期血浆,出院率显著升高,死亡率也较低。然而,CoV暴发时使用恢复期血浆治疗会因康复患者的良好意愿受到限制。有报道称,在细胞和动物研究中,使用低抗体滴度的产品治疗,导致与免疫增强相关的疾病恶化。
为了克服这些问题,研究者通过免疫人免疫球蛋白转基因小鼠,克隆未成年和恢复期患者的小链可变区,以及恢复期S特异性B细胞的永生化,制备了针对SARS-CoV S不同区域的单克隆抗体。这些单抗大多以S1亚单位RBD上的特异表位为靶点,抑制病毒-细胞受体结合,而其他单抗则与S2亚单位结合,阻断病毒-细胞融合。无论其结合位点和机制如何,这些单克隆抗体在体外和小动物模型中都表现出中和活性和降低病毒滴度。类似地,针对MERS-CoV S的S1亚基RBD上不同表位的单克隆抗体也被开发出来。这些单克隆抗体与RBD结合的亲和力比人DPP4高10倍至450倍以上,因而在体外具有更广泛和更高的中和活性。重要的是,两种或两种以上协同作用的人源化或人源性单克隆抗体靶向非交叉耐药表位或S的不同区域的联合治疗可能有助于减少病毒突变以逃避抗体介导的中和作用的频率。用这些单克隆抗体治疗MERS感染的人DPP4转基因小鼠和表达人DPP4的腺病毒载体转染的小鼠具有保护作用。应进一步评估其安全性和对患者的治疗效果。
靶向S不同区域的抗病毒肽是另一种有前途的治疗策略。SARS-CoV和MERS-CoV的S2亚基或茎区均为Ⅰ类病毒融合蛋白,均含有N端融合肽、七肽重复序列1(HR1)和HR2结构域、跨膜结构域和细胞质结构域。抗病毒肽类似于SARS-CoV的N末端、跨膜前区或区分HR1和HR2结构域的柔性loop区,在微摩尔浓度下,可抑制40-80%的病毒斑块形成。同样,横跨MERS-CoV的HR2结构域的抗病毒肽,在体外抑制S介导的细胞-细胞融合和病毒进入细胞。从HR2结构域衍生的一种肽,称为HP2P-M2,如果在病毒攻击之前或之后经鼻给药,则保护C57BL/6小鼠和缺乏V(D)J重组激活蛋白1(RAG1)的小鼠,其10倍至1000倍以上肺内病毒滴度降低;这种保护作用是通过将这种肽与干扰素β结合而增强的。
结合针对S2亚单位不同区域的抗病毒肽,可能在体外具有协同作用,并克服耐药的理论风险。重要的是,一种类似的融合抑制剂enfuvirtide,它与HIV的糖蛋白结合以阻止膜融合和HIV细胞进入,已经成功地用于治疗HIV-1感染。成功的药物开发包括对抗耐药性的措施,因此有利于抗病毒肽需在体内的进一步评价;尽管siRNAs在体外和SARS-CoV感染的恒河猴体内具有抗病毒活性,但由于缺乏可靠的给药方法,它们仍处于临床前的发展阶段。
另一类靶向S的抗CoV试剂是碳水化合物结合剂。格瑞弗森(Griffithsin)是从红藻中分离得到的一种抗病毒蛋白。它与病毒表面糖蛋白(如S和HIV糖蛋白)上的低聚糖特异性结合。它在体外和感染SARS-CoV的老鼠中抑制了广泛的CoV,包括SARS-CoV、HCoV-229E、HCoV-OC43和HCoV-NL63。不过,应进一步评估这些药物在人体内的最佳给药方式和安全性。
针对病毒包膜、膜、核衣壳和辅助蛋白
E、 M和N以及一些辅助蛋白不仅对病毒的组装是必需的,而且可能还具有抑制宿主免疫反应以促进病毒复制的额外功能。例如,辅助蛋白4a和4b,也可能是MERS-CoV的M和5,表现出干扰素拮抗活性,SARS-CoV-N作为RNA沉默的病毒抑制因子,抑制由短发夹状RNA或siRNAs引起的RNA干扰(表2)。靶向SARS冠状病毒E、M、N、ORF3a、ORF7a或ORF7b的siRNAs抑制病毒在体外的复制。然而,与抗CoV S siRNAs类似,这些siRNAs在更好的递送方法出现之前,都不适合人类使用。
另外,越来越多的靶向这些蛋白质的特定结合位点或功能的试剂正在通过结晶学和功能分析产生。例如,病毒蛋白Viroporin抑制剂六亚甲基阿米洛利可降低SARS-CoV和HCoV-229E中E的离子通道活性;PJ34可与HCoV-OC43中N的N末端区域的一个独特的核糖核苷酸结合囊结合。然而,由于这些蛋白的结合位点和功能是单个冠状病毒所独有的,因此这些试剂可能是窄谱的。
新型亲脂性噻唑烷衍生物,如LJ001和JL103,是一类结合膜的光敏剂,能产生单线态氧分子,诱导脂膜性质的改变,防止病毒膜与靶细胞膜融合。它们对许多包膜病毒表现出广谱的活性,并可能对冠状病毒有活性。
基于宿主的抗CoV治疗策略
增强宿主的固有免疫响应
宿主固有的干扰素应答是控制病毒感染后复制的关键。尽管CoVs能够抑制干扰素对免疫逃避的反应,但它们在体外仍易受干扰素治疗的影响。使用重组干扰素或干扰素诱导剂可增强干扰素应答(表3)。重组α-干扰素和β-干扰素可抑制体外及动物模型中SARS-CoV和MERS-CoV的复制。α干扰素或β干扰素与利巴韦林和(或)洛匹那韦-利托那韦等其他抗病毒药物的各种组合,已被用于治疗SARS或MERS患者。总的来说,由干扰素和利巴韦林组成的联合治疗并不能持续改善预后。体内外结果之间的明显差异,可能与这些药物的高EC50/Cmax比率以及症状出现和给药之间的延迟有关。这种延迟对MERS患者尤其重要,因为他们在症状出现和死亡之间的中间时间间隔比SARS患者短得多。在受试的重组干扰素制剂中,使用抗MERS-CoV的EC50/Cmax比率最低的重组干扰素β-1b,应在感染早期的临床试验中与其他有效的抗病毒药物联合评估。
聚肌苷:聚胞苷酸(poly(I:C)) 是一种dsRNA的合成类似物,能强烈诱导I型干扰素。在poly(I:c)给药前不久被表达人DPP4的腺病毒载体转染的BALB/c小鼠中,它显著降低了MERS-CoV的载量,尽管其在标准细胞培养保护实验中的作用尚未发表。在II期临床试验中,肌内注射聚赖氨酸和羧甲基纤维素稳定的poly(I:C),恶性胶质瘤患者的耐受性良好。硝唑沙尼是另一种有效的I型干扰素诱导剂,已用于人体寄生虫感染。它是一种合成的硝基噻唑-水杨酰胺衍生物,对包括犬冠状病毒、流感病毒、乙型肝炎病毒、丙型肝炎病毒、艾滋病病毒、轮状病毒、诺如病毒和黄病毒在内的RNA和DNA病毒具有广谱抗病毒活性。它已经在治疗HCV感染和流感的II期和III期临床试验中进行了评估,具有良好的安全性。在动物模型中,具有抗SARS-CoV作用的其他天然免疫调节剂包括抗菌肽rhesus θ-defensin 1和蛋白笼纳米粒protein cage nanoparticles,它们在诱导的支气管相关淋巴组织中引起宿主免疫应答。干扰素诱导剂和天然免疫调节剂与有效抗病毒药物的联合应用可能具有协同作用,不过应在动物模型中进行评估。
抑制与病毒复制有关的宿主信号途径
除了干扰素应答的直接增强外,其他细胞信号通路也被确定为潜在的抗CoV治疗靶点(表3)。亲环素类与SARS冠状病毒NSP1相互作用,调节钙调神经磷酸酶途径,在T细胞介导的适应性免疫应答中起重要作用。在体外,钙调神经磷酸酶抑制剂环孢素抑制多种冠状病毒。但由于其免疫抑制作用和标准治疗剂量下高EC50/Cmax比值,限制了其临床应用。新的非免疫抑制钙调神经磷酸酶抑制剂对HCoV-NL63有抗病毒活性,对SARS-CoV和MERS-CoV的活性需要进一步评估。类似地,调节其他细胞信号途径的药物,如激酶信号途径抑制剂,也表现出抗CoV活性,并且在商业上可用。然而,它们的毒性可能限制了它们在严重的冠状病毒感染患者中的使用。
抑制病毒复制依赖的宿主因子
冠状病毒利用特定的宿主因子进入和复制病毒(图2)。宿主受体可被特异性单克隆或多克隆抗体、肽或功能抑制剂靶向(表3)。例如,抗DPP4单抗在体外抑制MERS-CoV细胞进入。YS110是一种重组人源化IgG1抗DPP4单抗,在晚期实体瘤患者中似乎具有良好的耐受性。在SARS-CoV治疗中,小分子进入抑制剂如N-(2-氨基乙基)-1-氮丙啶乙胺(NAAE)在体外抑制ACE2和SARS-CoV介导的细胞-细胞融合的催化活性。ACE2关键片段类似的合成肽在体外也具有抗SARS-CoV的活性。然而,这些受体导向的化合物还没有在CoV感染患者身上测试过。它们的抗CoV活性可能是窄谱的,因为不同的CoV利用不同的宿主细胞受体。此外,必须评估免疫病理学的风险,特别是考虑到这些受体的多种基本生物学和免疫学功能。
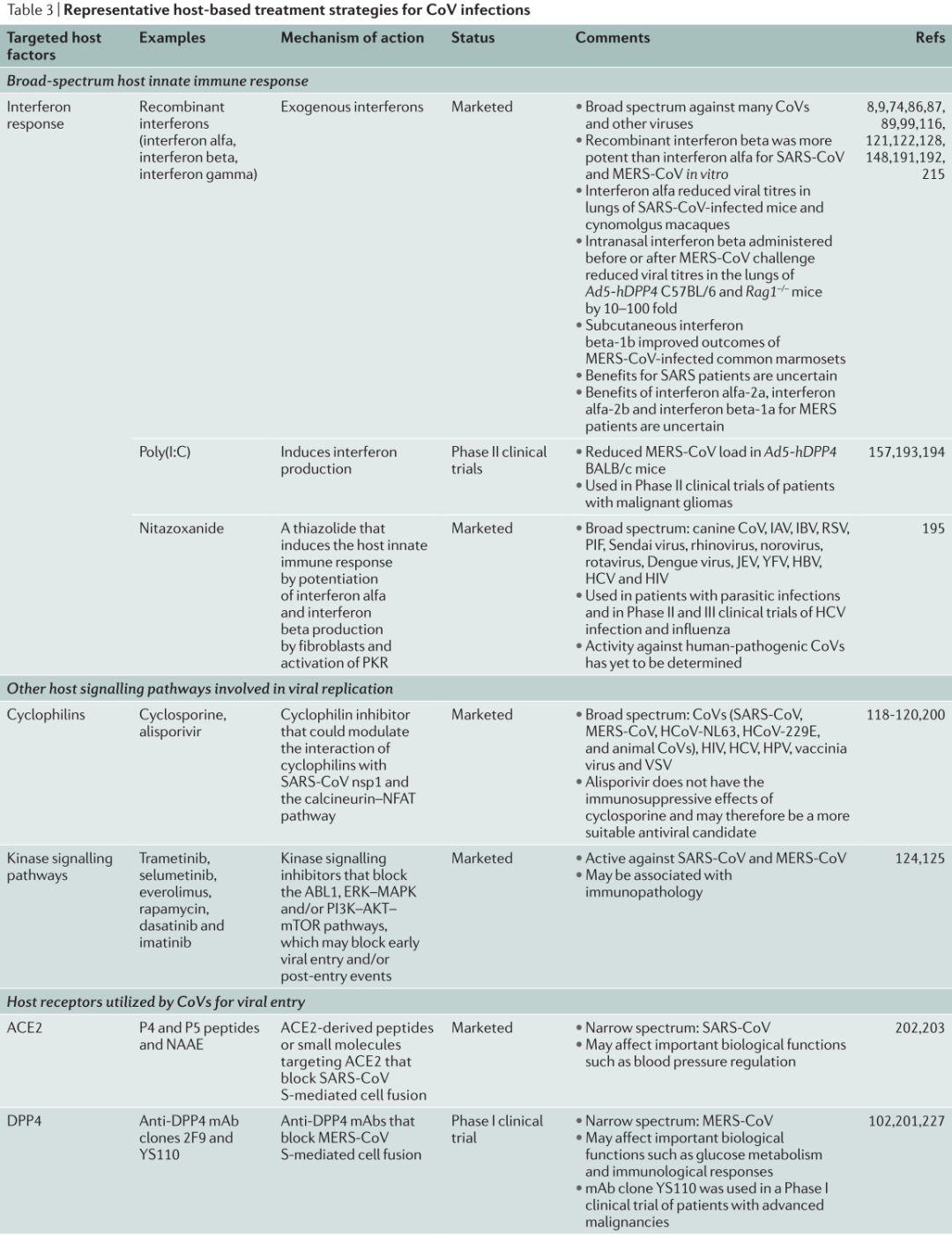
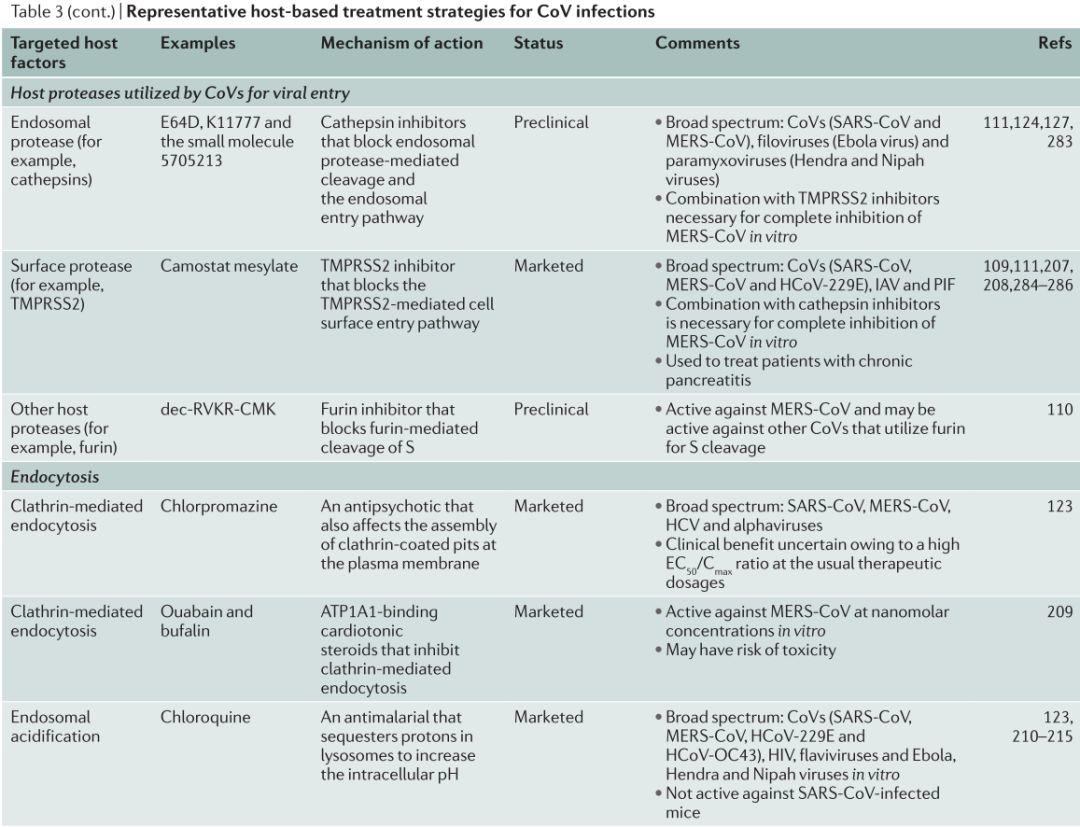
表3.基于宿主的CoV感染治疗策略
图片来源:Nat Rev Drug DisCov
CoVs通过内质体和(或)细胞表面途径进入宿主细胞,由切割和激活S的宿主蛋白酶促进。组织蛋白酶是半胱氨酸蛋白酶,参与内质体途径,可被组织蛋白酶抑制剂如K11777及其相关的乙烯基砜类似物抑制。这些化合物对动物模型中的各种寄生虫感染似乎是安全有效的,并且具有广谱的抗包膜RNA病毒的活性,例如CoVs(SARS-CoV、MERS-CoV、HCoV-229E和HCoV-NL63)、丝状病毒(埃博拉和马尔堡病毒)和副粘病毒。TMPRSS2是一种介导细胞表面进入途径的丝氨酸蛋白酶;卡莫司他(camostat mesylate)是一种合成的低分子量丝氨酸蛋白酶抑制剂,用于治疗慢性胰腺炎,副作用小。体外实验中,卡莫司他抑制SARS-CoV和MERS-CoV,提高SARS-CoV感染小鼠的存活率。另一种广泛表达的宿主蛋白酶Furin在MERS-CoV S介导的进入中也起重要作用,体外实验中,癸酰-Arg-Val Lys-Arg-氯甲基酮阻断furin,抑制MERS-CoV进入及细胞融合。
另一组候选抗CoV药物,靶向CoV在细胞进入过程中的内吞作用。氯丙嗪是一种用于治疗精神分裂症的抗精神病药物,在体外对丙型肝炎病毒、α病毒和许多冠状病毒,包括SARS冠状病毒和MERS冠状病毒都有活性。结合钠/钾转运atp酶亚单位α1的强心剂类固醇,比如乌巴因和布法林,可在纳摩尔浓度下,抑制网格蛋白介导的MERS-CoV内吞作用。然而,这些网格蛋白介导的内吞抑制剂的使用受到非常高的EC50/CMAX比值或毒性的限制。另外,高pH值也可以抑制细胞内吞作用。氯喹是一种抗疟疾药物,它能将质子隔离到溶酶体中,以增加细胞内的pH值,在体外对多种冠状病毒(SARS-CoV、MERS-CoV、HCoV-229E和HCoV-OC43)及其他RNA病毒具有广谱抗病毒活性。然而,它并没有显著减少SARS-CoV感染小鼠的病毒复制,可能是因为细胞表面途径没有同时被阻断。不同的蛋白酶和内吞抑制剂的组合的抗-CoV效应、药代动力学和药效学谱和毒性应在体内进一步评价。
MERS-CoV疫苗的研制
控制由新病毒引起的流行病,快速诊断和有效疫苗往往是抗病毒治疗的补充。尽管十多年来没有新的人类SARS病例,但由于人畜共患传染源在疫区的持续存在,中东地区仍继续出现零星病例和MERS群,并向其他区域蔓延。有效的MERS-CoV疫苗对于阻断从动物宿主和感染者到易感宿主的传播链至关重要。
严重急性呼吸综合征(SARS)和中东呼吸综合征(MERS)的流行表明,快速准确的实验室诊断对冠状病毒(CoV)感染的临床管理和流行病学控制至关重要。实时逆转录-聚合酶链反应(RT-PCR)可以定量病毒载量,有助于研究病毒的脱落模式,优化治疗和感染控制策略。SARS病毒载量的高峰出现在症状出现后的第10天,有助于预测临床恶化的时间和加强支持治疗的必要性。护理点核酸扩增试验,如RT-loop介导的等温扩增和RT-等温重组酶聚合酶扩增,适用于现场评估,特别是在资源有限的地区。同样,检测大量表达的CoV抗原(如核衣壳蛋白)的分析可用于快速、高通量的实验室诊断,而无需生物安全3级控制。大多数人和动物冠状病毒的全基因组序列的快速可用性,使设计新的RT-PCR分析、来源鉴定和对新出现的冠状病毒的分子监测所需的时间降至最低。这在MERS流行中得到了很好的证明,在从人类分离的MERS-CoV株的全基因组序列可用后,快速发展了针对独特基因区域的高度敏感和特异的RT-PCR分析。比较基因组学研究很快发现携带与人类分离的MERS-CoV株高度相似的CoV的蝙蝠和骆驼,这两种动物被确定为可能的CoV来源。对中东不同地区患者和动物的MERS-CoV基因组进行连续监测和分析,对于发现可能增加病毒在人与人之间有效传播能力的突变非常重要。小RNA测序的数据分析和锁定核酸探针的使用,使得新的检测方法得以发展,以CoV基因组中短而丰富表达的基因区域为靶点,如先导序列。随着CoV全基因组和诊断基因靶点数量的不断增加,使得能够同时检测多个CoV或特定CoV的多个基因靶点。世界各地临床实验室越来越多地使用这些多重分析法,将加强我们对CoV感染的流行病学变化的了解,并使高危患者和接触组的分层以进行早期治疗和预防。
除了提高急性临床诊断水平外,诊断进展还促进了CoV流行控制和抗CoV药物开发的其他方面。在细胞培养中从临床标本中分离出感染性病毒颗粒,在急性诊断CoV感染中的作用有限,因为大多数人的致病性CoV要么难以培养,要么很危险。尽管如此,最近的进展已经加强了它们在CoV发病机制研究中的应用,这对于确定新的治疗靶点非常重要。以前不可培养的HCoV-HKU1,现在可以从在气液界面上培养的人气管支气管上皮细胞和人肺泡II型细胞中分离出来。离体器官培养能够识别与SARS和MERS严重肺外和肺外表现有关的重要病毒和宿主因子。来自不同器官的可用人和动物细胞系的数量正在增加,这些细胞系提供了对组织和物种趋向性的洞察。同样,在成对的急性和恢复期血清样本中检测特异性抗CoV抗体主要用于血清流行病学研究和接触追踪,但不用于急性诊断。新的检测方法,如刺突糖蛋白(S)假颗粒中和法,不需要生物安全3级控制,可在大规模血清流行病学研究和暴发调查中实现高通量抗体检测。
先前在SARS动物模型中评估过的减毒活疫苗可能与免疫功能低下患者的播散性感染有关。灭活疫苗可能与动物攻击时的免疫病理学有关。这些方法对于MERS疫苗的开发是不利的,因为相当一部分严重的MERS患者有共病或全身免疫损害的情况。使用DNA质粒、病毒载体、纳米粒子、病毒样颗粒和重组蛋白亚单位的MERS的其他疫苗接种策略正在开发中,一些已在动物模型中进行了评估(表4)。在中东和大非洲之角等流行地区,为骆驼和骆驼接触高风险的非免疫个体提供安全有效的MERS-CoV疫苗,将是控制目前流行的MERS一项重要措施。
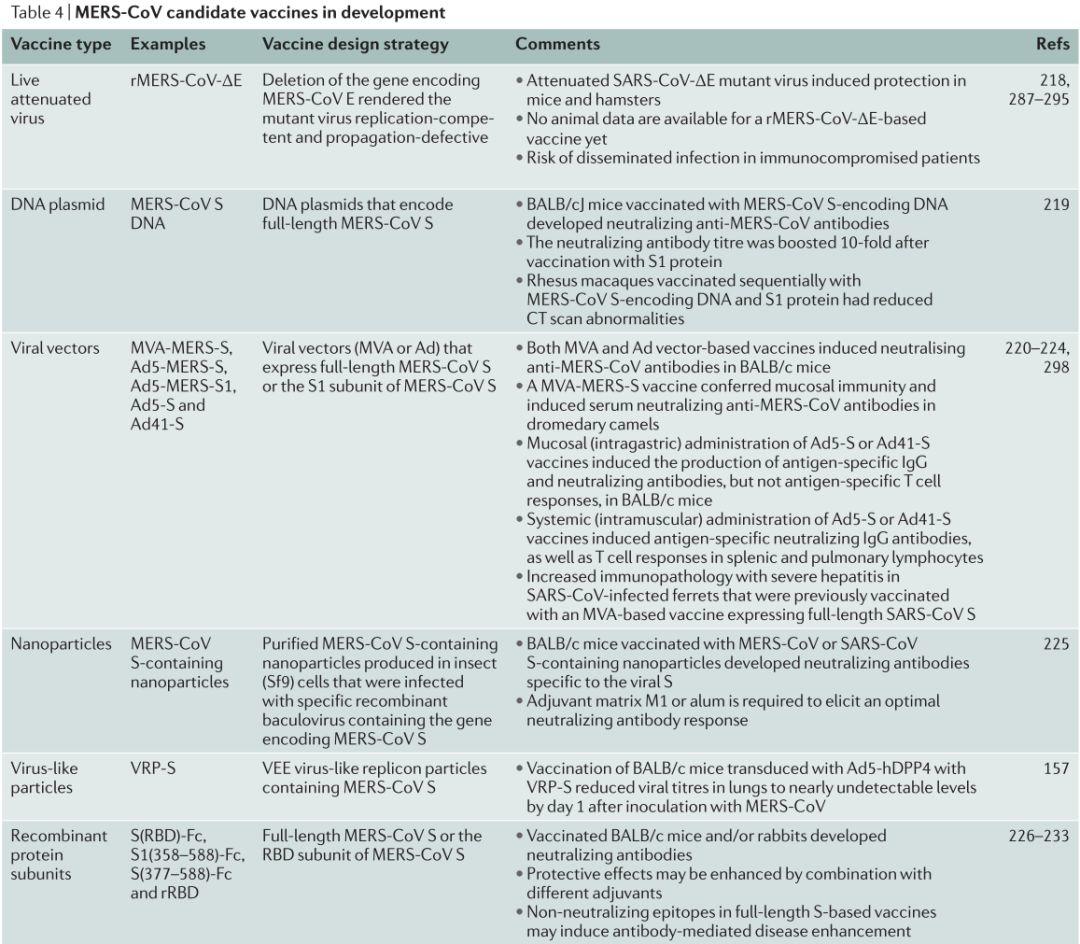
表4. MERS-CoV在研的候选疫苗
图片来源:Nat Rev Drug DisCov
展望与挑战
抗CoV药物试验动物模型
合适的动物模型对于检测抗CoV药物尤其重要,因为这些药物中的大多数尚未用于人类。与为HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1引起的轻度感染所建立的有限数量的动物模型相比,各种小动物和非人类灵长类动物模型被用来研究SARS和MERS的发病和治疗。确定ACE2和DPP4分别作为SARS-CoV和MERS-CoV的功能性受体,对建立具有代表性的严重人类疾病动物模型至关重要。一些不同的非人灵长类动物被发现对SARS-CoV有耐受性,但没有一个能持续复制严重人类疾病的特征,也没有观察到死亡率,这些模型主要有助于满足科赫的假设。小动物,包括年轻和年老的BALB/c和C57BL/6小鼠、T、B和/或NK细胞缺乏的敲除小鼠、金黄的叙利亚仓鼠和雪貂,可以有效地感染SARS-CoV,但很少有动物出现临床上明显的疾病。最有效的SARS小动物模型利用表达人ACE2和(小鼠)适应的SARS-CoV菌株的转基因小鼠,这些菌株能够在小鼠中引起致命疾病。这些ACE2转基因小鼠和鼠首病毒株的有限可用性仍然是检测抗SARS-CoV药物的主要障碍。
与SARS相似,非人类灵长类动物模型也被用来满足Koch的假设并研究MERS的发病机制。恒河猴只发展出一种轻微的自我限制性疾病,对MERS治疗的评价并不理想。相比之下,MERS-CoV感染的普通狨猴发展为一种播散性和致死性感染,与严重的人类疾病非常相似。然而,普通的绒猴数量有限,对这些小型灵长类动物的实验技术要求很高。因此,对其他小动物MERS模型进行了评价。与SARS-CoV不同,大多数小动物,包括BALB/c小鼠、金黄叙利亚仓鼠、雪貂和兔子,对MERS-CoV感染不敏感。
经鼻接种表达人DPP4的腺病毒载体后再接种MERS-CoV是一种快速使小鼠易受MERS-CoV感染的新方法,但该病相对较轻,仅限于呼吸道。表达人DPP4基因的转基因小鼠会发生严重的肺部和播散性感染,是目前治疗MERS的最佳小动物模型。在体外抗病毒试验中发现的抗MERS-CoV的潜在治疗方案应在这些转基因小鼠中进一步评估。
新型抗CoV药物临床开发中的一般挑战
在新型抗CoV药物的临床开发中,有许多病毒学和患者相关因素构成了重大挑战。首先,CoV是最多样化和最快速变异的病毒群之一,新的CoV在不可预测的时间反复出现。因此,特别现有的大多数药物可能对另一种新的CoV无效。尤其适用于病毒酶抑制剂、靶向S的单克隆抗体和抗病毒肽,以及靶向宿主细胞受体的药物。其次,目前可用于HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1感染的动物模型数量有限。即使对于SARS和MERS,使用合适的动物模型(如携带ACE2或DPP4转基因的小鼠和非人灵长类动物)进行的实验,也只能在少数指定的研究生物安全3级实验室中进行,而且这些实验在技术上要求很高。最后也是最重要的一点是,HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1引起的感染的临床轻微程度,以及没有新的SARS病例,这使得招募患者进入临床试验变得困难,降低了制药公司开发针对这些CoV感染的特定抗病毒药物的动机。在MERS-CoV首次被发现3年后,它对全球健康安全的持续威胁,为解决目前开发新型抗CoV药物的障碍提供了一个黄金机遇。
谨慎的做法是,建立一个由临床医生、病毒学家和药物开发人员组成的组织良好、多学科的国际合作网络,并作出政治上的承诺,以便使用已证明在体外和(或)动物模型中安全有效的抗CoV药物进行临床试验。
临床发展中治疗方案的优先顺序
尽管有大量的基于病毒和基于宿主的治疗方案的报道,这些方案在体外对SARS和MERS有很强的治疗作用,但在可预见的将来,只有少数方案可能在临床环境中发挥其潜力。大多数药物都有一个或多个主要的限制,首先,许多药物在临床相关剂量下具有较高的EC50/Cmax比值。这类药物的例子包括环孢素、氯丙嗪和干扰素α。其次,有些有严重的副作用或引起免疫抑制。例如,大剂量利巴韦林的使用可能与溶血性贫血、中性粒细胞减少、致畸性和心呼吸窘迫有关。用霉酚酸酯治疗的梅斯科夫感染的普通绒猴比未治疗的对照组在肺部和肺外组织中的病毒载量更高,从而发展成致命的感染。靶向宿主信号通路或受体的药物可能引起免疫病理学改变。此外,缺乏可靠的体内给药方法,对于siRNAs和其他以前没有在人类中使用过的药物来说尤其有问题。
展望未来,在进行中的MERS流行的临床试验中,应进一步评估的最可行的选择包括单药疗法或包括洛匹那韦-利托那韦的联合疗法,干扰素β-1b和(或)单克隆抗体和靶向MERS-CoV S的抗病毒肽。这些药物在非人类灵长类动物或小鼠模型中对MERS具有保护作用。此外,它们要么是上市药物(洛匹那韦-利托那韦和干扰素β-1b),或已成功用于其他感染(如用于呼吸道合胞病毒感染的帕利珠单抗和用于艾滋病毒感染的恩福韦肽)。从长远来看,新型广谱泛冠状病毒抗病毒药物的开发可有效对抗多种冠状病毒,可能成为循环和新出现的CoV感染的最终治疗策略。
参考文献:
Zumla A, Chan J F W, Azhar E I, et al. Coronaviruses—drug discovery and therapeutic options[J]. Nature reviews Drug discovery, 2016, 15(5): 327.