引言
当前2019-nCoV疫情紧急,目前除了抗病毒小分子药物、抗体疫苗等大分子药物、中药等正在进行临床试验外,肽类药物也是一个重要的研究方向。2019年4月复旦大学联合上海科技大学、美国Scripps研究所及中国疾控中心、纽约血液中心在Science Advances发表论文,详细描述了广谱抗冠状病毒多肽抑制剂EK1的研发。希望对当前新型冠状病毒2019-nCoV的药物研发有所帮助。

研究背景
冠状病毒(CoV)
冠状病毒是带有正向单链RNA的包膜病毒,与各种天然宿主(如蝙蝠,竹鼠等)有关。CoV由α,β,γ和δ四部分组成,而β进一步由A,B,C,D组成。其中,六种CoV可以感染人类,称为HCoV,分别是α组中的HCoV-229E(229E)和HCoV-NL63(NL63),β亚组A中的HCoV-OC43(OC43)和HCoV-HKU1(HKU1),β亚组B的严重急性呼吸综合征CoV(SARS-CoV)和β亚组C的中东呼吸综合征CoV(MERS-CoV)。
冠状病毒感染史
在本世纪,SARS-CoV和MERS-CoV在人类在蔓延,并导致严重的肺部疾病,病死率高得惊人。2002年,SARS-CoV感染首次在中国出现,然后迅速在全球流行,在30多个国家和地区传播,感染8327例,死亡775人(死亡率接近10%)。2012年,MERS-CoV出现在沙特阿拉伯,并传播到整个中东地区。2015年,第二次MERS-CoV大流行在韩国发生,并出现了第三代和第四代感染病例超级传播事件。 截至2018年8月,世界卫生组织报告了2229例经实验室确诊的MERS-CoV感染病例,包括27个国家的791例死亡(约35%的病死率)(世界卫生组织:www.who.int/emergencies/mers-cov/en/)。同时,其余的普通HCoV(例如229E,OC43和NL63)通常会感染人的上呼吸道并引起普通感冒,但它们对儿童,老年人和免疫功能低下的患者仍会造成严重甚至致命的疾病。这些情况表明,即使是常见的HCoV也可能对人类构成致命威胁。HCoV正在不断迅速发展。具有新型基因组的OC43分离株正在被不断重新鉴定。
HCoV感染机制
类SARS冠状病毒(SL-CoV)和类MERS冠状病毒(ML-CoV)的存在对全世界的公共卫生构成了巨大的威胁。研究确定了某些类SL-CoV,例如SL-WIV1-CoV和SL-SHC014-CoV,其刺突蛋白(S)与SARS-CoV非常相似。这些SL-CoV可以通过使用相同的SARS-CoV受体,即血管紧张素转化酶2(ACE2)直接进入人类细胞,而无需进行适应。此外,研究还表明ML-CoV,Tylonycteris bat CoV HKU4在将两个单一突变(S746R和N762A)引入其S蛋白后借助外源蛋白酶识别MERS-CoV受体CD26从而感染人体细胞。从历史的角度来看,人畜共患的冠状病毒具有强大的威力,它能够越过物种壁垒迅速而不可预测地感染人类,正如HCoV那样。因此,开发仅靶向单个HCoV的特定药物对新出现的HCoV无效,需要找到有效的广谱抗病毒药物应对HCoV。但是由于目前尚无可用于临床的广谱抗HCoV药物,我们就需要根据现有HCoV搜索共同或比较保守的靶标位点。
HCoV共有蛋白-S糖蛋白运作机制
S糖蛋白是一种I型跨膜糖蛋白,在介导病毒感染中起着重要作用,是所有HCoV共有的蛋白。S蛋白由两个亚基S1和S2组成(图1B)。S1亚基通过其受体结合结构域(RBD)与细胞受体结合,随后S2亚基发生构象变化,使融合肽插入宿主靶细胞膜。S2亚基中的七肽重复序列1(HR1)区域形成同源三聚体配体,该表面暴露了与七肽重复序列2(HR2)结合表面上的三个高度保守的疏水凹槽。这种六螺旋束(6-HB)核心结构是在融合过程中形成的,有助于使病毒膜和细胞膜紧密结合,从而使病毒进行融合并进入细胞(图1B)。因此,S蛋白是开发药物的重要靶蛋白。S1 RBD更是非常好的靶标位点,此外,RBD特异性抗体和基于RBD的疫苗在之前的研究中都表现出了有效的抗病毒活性或阻断病毒与宿主受体结合中的保护机制。但是,从进化的角度来看,冠状病毒的RBD属于高度易变区域的一部分,因此不是广谱抗病毒抑制剂研发的理想靶点。相反,SL-CoV–SHC014的S蛋白。S2亚基中的HR区在各种HCoV之间是相对稳定的,并可以通过形成介导病毒融合的6-HB在HCoV感染中发挥关键作用。此外,位于HR1螺旋中“ e”和“ g”位置的残基与HR2螺旋中“ a”和“ d”位置的残基可以相互作用,因此HR1和HR2之间的相互作用模式在CoV之间是稳定的。先前的研究已经报道了来源于一些包膜病毒(包括HIV-1,呼吸道合胞病毒(RSV),埃博拉病毒,副粘病毒SV5,尼帕病毒)的I类病毒融合蛋白的HR2(或C端HR)区域的肽和鼠肝炎病毒(MHV)可以竞争性结合病毒HR1(或N端HR)并有效抑制病毒感染。因此,可以推测HR1也可能是开发针对高致病性HCoV的融合抑制剂的良好靶标。
广谱抗冠状病毒融合多肽EK1的发现简介
研究表明衍生自SARS-CoV和MERS-CoV S蛋白的HR2区域的多肽可以竞争性地抑制病毒6-HB的形成,从而阻止病毒融合和进入宿主细胞。例如,源自SARS-CoV刺突蛋白HR2区域的肽CP-1能够以类似于针对MERS-CoV感染的MERS-HR2P的方式抑制SARS-CoV的进入。 但是,这些肽缺乏针对异源HCoV的广谱抗病毒活性。例如,CP-1和MERS-HR2P肽不能分别交叉抑制MERS-CoV和SARS-CoV感染。另一方面,CoV融合核心HR区域分为两组:短HR(例如MERS-CoV,SARS-CoV和OC43 HR)和长HR (例如229E和NL63 HR)。短HRs和长HRs之间的差异在于长HRs中插入了14个氨基酸,这进一步增加了设计广谱肽融合抑制剂的难度。为了解决这一挑战,本文成功筛选了具有广谱融合抑制活性的肽OC43-HR2P。此外,修饰的OC43-HR2P肽EK1在抑制多种HCoV感染方面表现出了很大潜力。体内研究表明,经鼻途径施用EK1具有很高的保护作用和安全性,突出了其临床潜力。此外,EK1与来自不同HCoV的HR1的复合结构的研究解释了HR1-EK1相互作用的机制,进一步表明HR1区域可以作为广谱pan-CoV融合抑制剂发展的有效靶点。
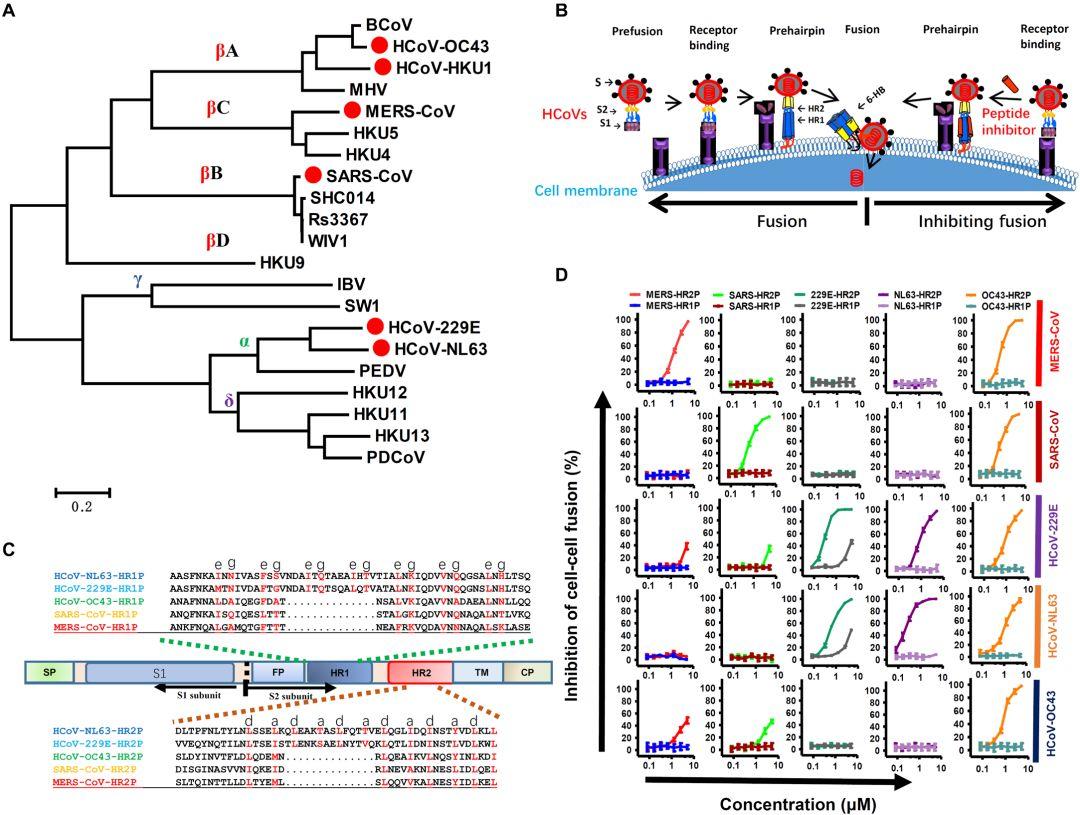
图1. HR1P和HR2P融合抑制活性
图片来自SCIENCE ADVANCES
(A)用来自四个基因组的代表性CoV的S序列创建的树状图。HCoV用红色实心圆圈表示。
(B)HR2P肽的抗病毒机制。
(C)HCoV S蛋白的示意图。SP,信号肽;FP,融合肽;HR,七肽重复域(HR1和HR2);TM,跨膜结构域;CP,胞质结构域。设计的肽的相应序列(HR1P和HR2P)。
(D)HR2P肽有效抑制由MERS-CoV,SARS-CoV,229E,NL63和OC43的S蛋白介导的细胞间融合。
研究结果
HR衍生肽抑制多种HCoV的S蛋白介导的细胞间融合
基于6-HB融合核心结构,我们先前曾报道过分别来自MERS-CoV HR1和HR2的肽MERS-HR1P和MERS-HR2P,并且这两种多肽与HCoV显示出了良好的相互作用。本文通过序列比较找到了多个HCoV的稳定HR区,然后合成了HR1和HR2衍生的肽,称为HR1P和HR2P。 并且两个α-HCoV的HR1P和HR2P都插入了14个氨基酸,即229E和NL63。为了系统地评估这些肽对不同HCoV的抑制活性,通过由多种HCoV的S蛋白介导的多种细胞-细胞融合测定法对抑制剂活性进行检测。细胞-细胞融合测定表明MERS-HR2P对MERS-CoV S蛋白介导的细胞融合具有抑制作用,其50%抑制浓度(IC 50)为1.01μM,而对其他HCoV ,即使浓度高达5μM,S的抑制活性也很小。SARS-HR2P以0.52μM的IC50特异性抑制SARS-CoV S介导的细胞间融合。另一方面,衍生自两个α-HCoVs的HR2P肽,即229E和NL63,对α-HCoVS介导的细胞融合具有强效且广泛的抑制作用,IC50值范围为0.13至0.51或分别从0.21至0.56,但对S-介导的融合蛋白,包括对α-HCoV(包括MERS-CoV,SARS-CoV和OC43)没有有效的抑制作用。 此外OC43-HR2P表现出广泛而有效的融合抑制活性,针对MERS-CoV,SARS-CoV和OC43的IC50值分别为0.39、0.54和0.66μM。出乎意料的是,OC43-HR2P是一种由α-HCoVHR2衍生的肽,因此短于229E-HR2P和NL63-HR2P的14个残基表现出了针对H-HCoV的有效活性,在229E-S介导的细胞-细胞融合IC 50值为0.84,NL63-S介导的细胞-细胞融合的IC50为0.94μM。在所有HR1P中,只有229E-HR1P对229E-S和NL63-S介导的细胞融合具有中等程度的抑制作用。因此,与HR1P相比,所有HCoV HR2衍生的肽均表现出优异的自特异性融合抑制活性,而OC43-HR2P对against-HCoV和α-HCoVS介导的细胞间融合均表现出广泛有效的融合抑制活性。文中还通过圆二色谱测量了OC43-HR2P和HCoV-HR1P的δ螺旋度,发现这些肽的螺旋度有限,范围为11.3至42.3%。相比之下,OC43-HR2P和每种HR1肽的混合物分别表现出高ε-螺旋性(70.9%至86.7%),熔融转变温度(T m)值在48.5°至91.5°C的范围内。S1E),进一步表明OC43-HR2P可以结合不同HCoV的HR1并形成稳定的复合物,从而阻断S蛋白介导的融合。
发现OC43-HR2P修饰多肽EK1,具有更高的溶解度和良好的融合抑制活性
在螺旋的i至i + 3或i至i + 4位上,将带负电荷和正电荷的氨基酸Glu(E)和Lys(K)引入HIV-1融合抑制肽可以形成分子内EK或KE盐桥,增加肽的稳定性,使肽的溶解性和抗病毒活性大大提高。使用类似的设计,研究通过在肽的适当位点引入Glu或Lys来进一步增加OC43-HR2P的序列,以加强其溶解度,从而提高该肽的抗病毒活性。此外,根据MERS-CoV S 6-HB的结构,在一些预期不会参与HR1结合的位点引入了突变,例如4Q,14Y,32D和36L,以进一步增强肽的融合抑制活性(表S2)。在一系列优化的肽中,肽EK0-1,EK0-2,EK0-3和EK1在细胞-细胞融合测定中显示出逐渐增加的溶解度和出色的抑制活性。最终的肽EK1表现出最有效的泛CoV抗病毒融合活性,IC 50值在0.19至0.62μM的范围内(表S2)。在某些HCoV细胞-细胞融合测定中,EK1表现出比自体肽(例如MERS-HR2P和SARS-HR2P)更有效的抑制活性。类似于其祖先OC43-HR2P。源自OC43的短6-HB融合核心的EK1也能够有效抑制由229E和NL63 S蛋白介导的细胞-细胞融合,这两个蛋白都具有长时间的融合核心。这些结果进一步强调了EK1的广谱抗HCoV潜力。此外,EK1还具有优异的药物特性和在磷酸盐缓冲盐水(PBS)和水中的溶解度,与原始OC43-HR2P相比,其分别增加了478倍和3.5倍。这些结果共同为后续开发EK1作为潜在的治疗药物奠定了基础。
EK1多肽有效抑制多种CoV细胞融合,并阻断真实CoV感染
SL冠状病毒,包括WIV1,Rs3367和SHC014冠状病毒,都具有潜在的人类感染潜力。为了进一步评估融合抑制活性的广度(如EK1所示),建立了由这些SL-CoV的S蛋白介导的细胞-细胞融合测定。SL-CoV的RBD的受体结合基序(RBM)具有多样性,它在结合细胞受体中起着重要作用,并且是开发CoV特异性抗体或疫苗的有效靶点。SHC014 CoV的RBM与SARS-CoV仅具有80%的相似性和64%的同一性,并且靶向SARS-CoV RBD的抗体不能防止由SHC014 S蛋白介导的感染。,SL-CoV的HR1和HR2序列与SARS-CoV的HR1和HR2序列100%相同。相应地,EK1表现出比自体肽SARS-HR2P更高的抑制活性,对三种被测SL-CoV的S蛋白介导的细胞融合具有抑制作用(图2,F至H),而EK1杂乱的肽对这些CoV S蛋白中的任何一种介导的细胞间融合均没有抑制活性(图2,A至H)。本文使用了伪病毒分析(伪病毒分析是模仿病毒进入靶细胞过程的良好模型,并且在以前的研究中已广泛用于评估抗病毒剂对相关CoV感染的抑制活性。)来评估EK1对不同假型HCoV的抑制活性。在MERS-CoV假病毒感染试验中,EK1和MERS-HR2P均显示抑制活性,IC 50值分别为0.26和1.06μM(图2I)。同样,EK1和SARS-HR2P也有效阻断了SARS-CoV假病毒感染,IC 50值分别为2.23和2.81μM(图2J)。同时,EK1表现出对假型229E,NL63和OC43感染的抗病毒活性,IC 50值分别为3.35、6.02和1.81(图2,K至M)。与细胞-细胞融合测定结果一致,EK1和SARS-HR2P均以IC 50值为2.25和3.05抑制假型Rs3367病毒感染,并以IC 50值为2.10和2.73阻止WIV1假病毒感染。分别为(图2,N和O)。相反,EK1对VSV-G介导的病毒感染没有抑制活性(图2P)。EK1肽对这些伪病毒中的任何一种都没有抑制活性(图2,I至P)。由于未能组装假型SHC014,未对该病毒进行假病毒感染检测。总体而言,EK1可以有效阻止所有HCoV和SL-CoV的假病毒感染,进一步表明EK1具有广谱抗病毒活性,可抵抗泛HCoV感染,包括α-HCoV,s-HCoV和SL-CoV。研究组开发了针对MERS-CoV和SARS-CoV的Blam-Vpr(Blam-Vpr测定法是一种敏感模型,用于表征抗病毒剂对病毒-细胞膜融合的抑制机制和活性。该测定法已被广泛用于评估包括HIV-1,埃博拉病毒和肝炎病毒在内的各种病毒的膜融合活性。)检测方法,以进一步阐明了EK1的融合抑制机制。发现EK1以剂量依赖性方式分别有效地抑制了MERS-CoV Blam-Vpr病毒粒子和SARS-CoV Blam-Vpr病毒粒子进入Huh-7细胞和ACE2-293T细胞的进入, 因此证实EK1确实是HCoV融合抑制剂。随后,进一步评估了EK1和NL63的抑制活性。 发现EK1可以在细胞水平上有效抑制这些HCoV的感染和复制,并呈剂量依赖性(图2,Q至T)。EK1甚至超过了自体OC43-HR2P(IC 50 = 0.93)或MERS-HR2M2 [IC 50 = 0.23; 这是针对OC43或MERS-CoV的优化的MERS-HR2P肽],IC 50值分别为0.62和0.11。 同时,EK1还对229E和NL63感染表现出同样有效的抑制活性,与229E-HR2P(IC 50等于0.56)和NL63-HR2P(IC 50等于59)相比,IC 50值分别为0.69和0.48和 0.14)(图2. S和T)。由于在大多数病毒学实验室中全球禁止操作活SARS-CoV,无法测试EK1对SARS-CoV复制的抑制活性。
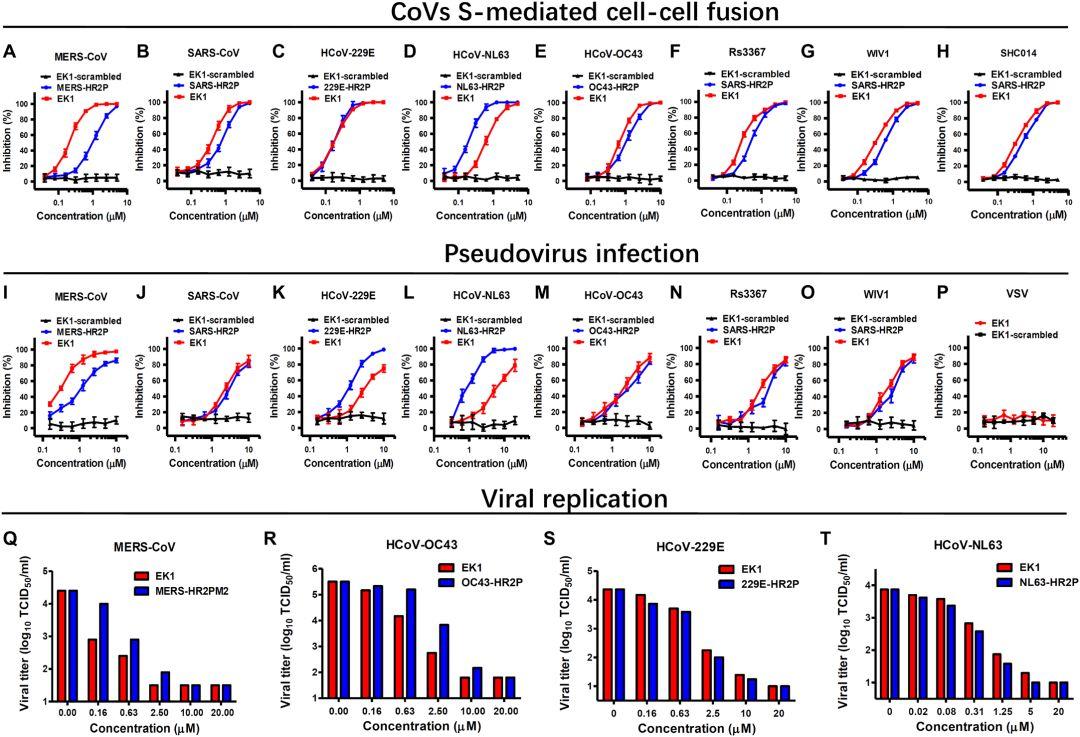
图2. EK1对多种HCoV的S蛋白介导的病毒感染有效
图片来自SCIENCE ADVANCES
(A到H)EK1在MERS-CoV(A),SARS-CoV(B),229E(C),NL63(D),OC43(E),Rs3367的S蛋白介导的细胞-细胞融合中的抑制活性 (F),WIV1(G)和SHC014(H)。(I至P)EK1在伪病毒感染试验中对MERS-CoV(I),SARS-CoV(J),229E(K),NL63(L),OC43(M),Rs3367(N),WIV1( O)和VSV(P)。(Q至T)EK1对MERS-CoV(Q),OC43(R),229E(S)和NL63(T)的活HCoV复制的抑制活性。
EK1在体内表现出广泛的抗HCoV活性
呼吸道是HCoV感染的主要目标组织。为了研究EK1肽的临床前潜力,通过鼻内途径给药并评估了其在呼吸道中的分布。我们观察到Cy5-EK1的荧光信号主要在小鼠的上呼吸道和下呼吸道(图3,A和B)。与PBS处理的小鼠相比,经Cy5-EK1处理的小鼠的肺显示出明显更高的荧光信号(P <0.0001,n = 3)(图3,C和D)。总体而言,这些结果表明EK1(鼻内)可广泛分布于整个呼吸道并富集于肺中。我们还注意到,在某些动物中,鼻内施用的Cy5-EK1可以在一些肺外器官中大量检测到,包括肝脏,肾脏和脾脏,这表明EK1可以进入血液循环和其他器官。该观察结果表明,鼻腔内施用EK1也可能有益于多器官感染或HCoV的全身感染,这两者在MERS-CoV感染中很常见。
接下来,评估了EK1在体内对OC43和MERS-CoV感染小鼠模型的保护作用。在OC43感染的小鼠模型中,我们在以10 2 TCID 50(50%组织培养感染剂量)的HCoV-OC43攻击之前或之后,以5 mg / kg的剂量EK1或PBS处理新生小鼠30分钟。从感染后5天开始,病毒对照组的小鼠体重下降,小鼠死于感染后10 dpi死亡,死亡率为100%(图3,E至G)。相比之下,EK1预防组和治疗组中小鼠的最终存活率分别为100和66.7%(图3E),它们的体重呈正常状态(预防性)或在16 dpi时迅速恢复(治疗性)(图3E)。3F)。同时,我们以5 dpi测试了所有组小鼠大脑中的病毒滴度。在病毒对照组中很容易检测到感染性病毒,而在EK1预防性小鼠中感染性病毒的滴度低于检测极限(2 log TCID 50 / g),而在EK1治疗性小鼠中则非常低(图3G)。但是,在EK1治疗期间死亡的小鼠的脑中的病毒滴度与未进行EK1治疗的病毒对照小鼠的脑中的病毒滴度高,而在接受EK1治疗方法的存活小鼠及那些小鼠中的病毒滴度正常对照小鼠中的两只均不可检测。一致地,在EK1治疗期间死亡的小鼠的大脑表现出与病毒对照小鼠相似的组织病理学变化,即空泡化,变性和浸润的数量相似。相比之下,接受EK1治疗的存活小鼠的大脑和正常对照小鼠的大脑没有显示出明显的组织病理学变化。
为了评估EK1对抗MERS-CoV感染的预防和治疗潜力,利用了特征明确的转基因(Tg)小鼠,其在全球范围内表达人二肽基肽酶IV(DPP4)病毒受体。在用10 4 TCID 50的MERS-CoV攻击之前或之后,我们用200μgEK1或PBS处理小鼠30分钟。同样,在MERS-CoV攻击之前或之后用EK1处理的Tg小鼠的体重减轻微不足道,并在16 dpi时迅速恢复,而未治疗的小鼠在9 dpi内感染之前逐渐减轻了体重,死亡率为100%(图3, H至J)。相比之下,EK1预防组和治疗组的存活率分别为100%和75%(图3,H至J)。当将肺部感染性病毒的产量用作评估EK-1对MERS-CoV感染的功效的终点时,我们无法从EK1预防组和治疗组中回收任何感染性病毒,与未治疗组形成鲜明对比控件(图3J)。总之,这些结果表明, EK1多肽对HCoV感染具有广泛而有效的预防和治疗功效。
EK1的安全性和低免疫原性
安全性对于临床应用中EK1的开发非常重要,因此,我们首先测试了EK1对各种靶细胞的体外细胞毒性。EK1在浓度高达1 mM时没有细胞毒性,它比抑制任何HCoV S介导的细胞-细胞融合和假病毒进入的IC 50高200倍以上。然后,我们进一步研究了其在体内的细胞毒性。我们每天通过鼻内途径连续给小鼠注射PBS,低剂量EK1(20 mg / kg)或高剂量EK1(100 mg / kg),并记录接下来2周的体重变化。高剂量组和低剂量组中经EK1处理的小鼠均正常生活,与PBS处理的小鼠相比,体重增加/减少无明显差异。同时,我们用酶联免疫吸附法(ELISA)鼻内给药2周后测量小鼠血清中EK1特异性抗体。在EK1处理组或PBS处理组中均未检测到EK1特异性抗体。
根据鼻腔给药后EK1的分布情况,我们推测EK1可以穿透气血屏障进入血液循环,并富集于一些重要器官,例如肝脏和肾脏。因此,我们进一步检查了小鼠血清中丙氨酸转氨酶的水平。ALT和肌酐在EK1和PBS治疗组之间的所有时间点均无显着差异(P> 0.05),这表明高剂量或低剂量经鼻应用EK1不会影响小鼠的肝和肾功能。给药4周后EK1和PBS处理组的组织病理学变化。与用PBS处理的对照小鼠相比,用不同剂量的EK1处理的小鼠的肺,肝,肾和脾切片的苏木精和曙红染色未显示病理异常。这些器官均未显示出细胞变性,坏死或炎性因子浸润的证据。因此,EK1似乎可以通过鼻部应用安全。
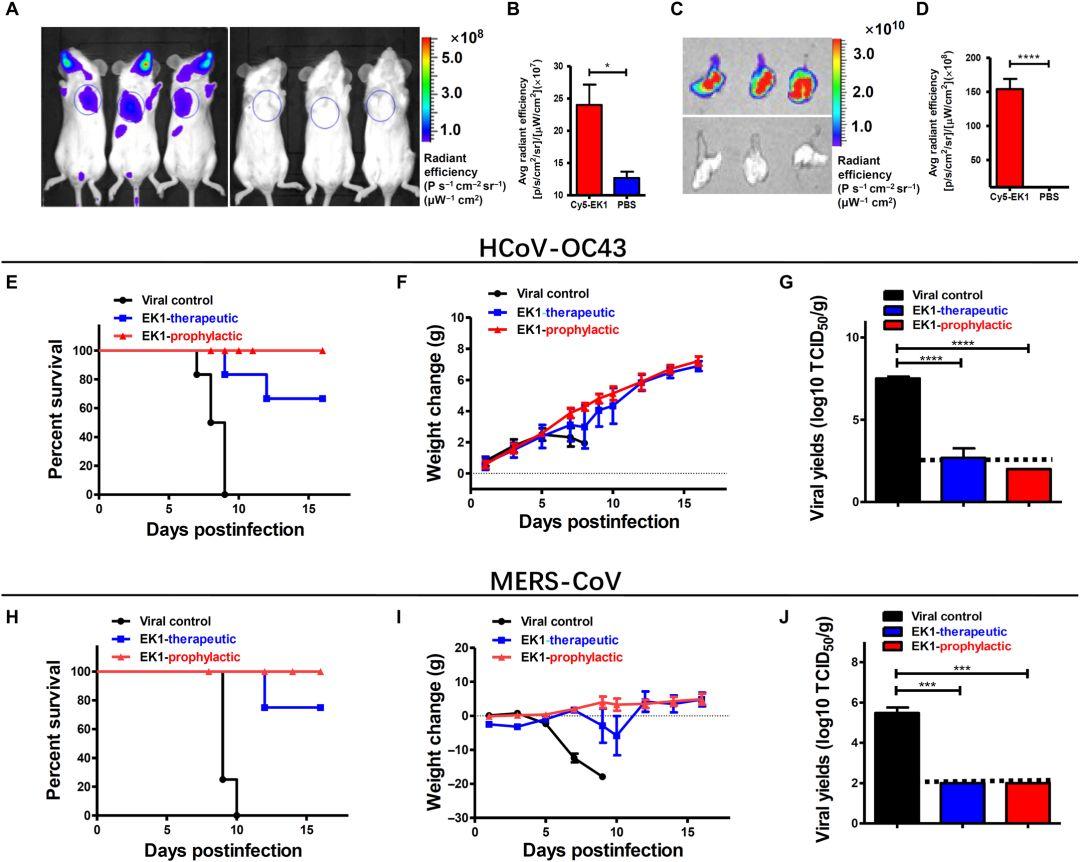
图3. EK1在小鼠中对OC43和MERS-CoV感染的体内预防和治疗效果
图片来自SCIENCE ADVANCES
(A和B)PerkinElmer的IVIS Lumina K系列III对Cy5-EK1或PBS处理的小鼠的成像以及统计分析。
(C和D)通过统计分析对那些小鼠的肺部成像。
(E到G)EK1在体内的抗OC43功效。用OC43攻击的3天大的乳鼠的生存曲线。
(E)在用OC43(102 TCID50)攻击之前或之后,用EK1(PBS中5 mg / kg)或PBS处理新生小鼠30分钟。
(F)在OC43攻击之前和之后30分钟用EK1或PBS处理的新生小鼠的体重变化。
(G)每组小鼠脑中的病毒滴度。
(H至J)EK1在体内的抗–MERS-CoV功效。用MERS-CoV攻击的小鼠的生存曲线。
(H)在用MERS-CoV(104 TCID50)攻击之前或之后,在PBS或PBS中用200μgEK1处理表达人类DPP4的小鼠。
(I)每组小鼠的体重变化。
(J)每组小鼠肺中的病毒滴度。
EK1广泛CoV抑制活性的结构基础
为了研究EK1肽对pan-CoV抑制作用的结构基础,我们将EK1与来自三个代表性HCoV的HR1肽复合形成了结晶,包括最具致病性的SARS-CoV和MERS-CoV,以及b-HCoVs229E。其HR1比α-HCoV的HR14长14个氨基酸。HR1(MERS)-L6-EK1,HR1(SARS)-L6-EK1和HR1(229E)-L6-EK1的晶体结构通过分子置换解决并分别精制至最终分辨率3.3、3.3和2.2Å 。在所有三个结构中,EK1以倾斜和反平行的方式紧密地插入两个相邻HR1螺旋之间形成的疏水槽中(图4,A至C),产生了一个6-HB结构,类似于相应HCoV的3HR1-3HR2后融合状态。值得注意的是,EK1的结合位点与天然HR2的结合位点一致。这些结果表明,EK1的存在将阻止HR2与其相应的3HR1核心结合,从而阻止3HR1-3HR2 6-HB的形成,这是宿主-病毒膜融合过程中必不可少的步骤。因此,施用EK1肽会阻止这些HCoV进入细胞(图2)。
在所有三个结构中,EK1肽均具有混合的二级结构构象(图4,A至C)。EK1的中心区域折叠成五匝螺旋,通过广泛的疏水相互作用与两个相邻的HR1螺旋堆积在一起(不同HCoV的3HR1核心以静电表面表示,而EK1上的残基参与了疏水堆积棒状; EK1上的残基L12,E15,M16,L19,A22,I23,L26,S29和Y30位于EK1的五匝螺旋内,并与3HR1核形成强疏水相互作用;图5A)和极少的静电或极性相互作用(残基E13,E15,K18,E20,E27,E28和Y30位于EK1的五匝螺旋区内,并通过侧链至侧链亲水相互作用与HR1残基相互作用;图6A )。EK1的其余部分采用扩展的构型,只是在HR1(229E)-L6-EK1结构的EK1的C端(大约E35)处形成了一个额外的圈(图6,右图)。在EK1的延伸区域中,侧链(HR1残基)和主链(EK1残基)之间的极性相互作用占主导地位(比较图6,B和A)。这些侧链与主链的极性相互作用大多数都聚集在EK1螺旋区域的两端,它们交织成广泛的氢键网络,可能有助于将EK1螺旋区域固定在正确的寄存器中(图6B)。EK1延伸区域中的疏水残基也将其庞大的侧链插入3HR1核心表面上的疏水口袋中(残基L2,I5,V7,L10,I31和L36;图5A),从而进一步增强了EK1将区域扩展到3HR1内核。
3HR1核的表面上都存在疏水口袋和隆脊(图5A)。相应地,我们观察到EK1和3HR1核心之间存在两种疏水相互作用。特别是,某些EK1残基将其疏水侧链插入3HR1核的口袋中(图5A,显示为橙色棒状模型,以下称为“掩埋残基”),而其他EK1残基则将其侧链堆积在疏水基上。3HR1磁芯(图5A,显示为黄色棒状模型,以下称为“垄堆积残留物”)。在所有HCoV中,HR1上的残基与EK1上的掩埋和山脊堆积残基介导了疏水相互作用。在图5B(下图)中,HR1残基用橙色和黄色阴影表示,并且与EK1进行极性和静电相互作用的大多数HR1残基在所有HCoV之间也显示出高度相似性[图5B,HR1残基用青色和红色框出]。因此,正如我们在HR1(OC43)-L6-EK1,HR1(HKU1)-L6-EK1和HR1的同源模型中观察到的那样,EK1能够与来自OC43,HKU1和NL63的HR1形成相似的疏水和亲水相互作用HR1(NL63)L6-EK1。EK1和3HR1核心之间广泛且高度保守的疏水和亲水相互作用共同赋予EK1结合来自不同HCoV的3HR1核心的能力,因此能够阻止不同HR2与其对应的3HR1核心缔合的能力(图2)。
EK1肽在细胞-细胞融合和假病毒感染检测中均胜过MERS-CoV的自身衍生HR2。因此,研究组还比较了EK1和MERS-HR1之间的相互作用(图5A和6,左图)与MERS-HR2和MERS-HR1之间的相互作用。EK1和MERS-HR1之间的大多数疏水相互作用类似于MERS-HR2和MERS-HR1之间的相互作用。然而,EK1与MERS-HR1形成了更多的侧链至侧链亲水相互作用比MERS-HR2更好,这可能是其在细胞融合和伪病毒感染检测中的IC 50更好的原因(图2)。与α-HCoVs的HR1相似,HCoV的序列比对显示α-HCoVs的HR2区也存在14个氨基酸的插入(图1C)。这样的插入使得α-HCoV的HR2螺旋比α-HCoV的HR2螺旋长四匝。EK1的螺旋区域只有五匝长,比229E-HR2中的九匝螺旋长得多。尽管如此,EK1延伸区域中的掩埋残基及其在229E-HR2中的等价物都将其侧链整齐地插入了相应的疏水性口袋,尽管这些残基位于EK1的延伸区域中,而它们的等价物仍在229E-HR2中的a螺旋区域。因此,与229E-HR2和229E-HR1之间的疏水性相互作用相比,EK1和229E-HR1之间的疏水性相互作用丝毫没有受到损害。此外,EK1和229E-HR1之间总共发生12种极性和静电相互作用,包括5个侧链-侧链和7个侧链-主链相互作用。这些广泛的疏水和亲水相互作用共同保持了EK1对长HR1 HCoV的高亲和力。 EK1可以形成短(SARS-CoV和MERS-CoV)和长(229E)HR1的6-HB结构,突出了其广泛的结构相容性,可容纳来自不同HCoV的HR1,从而巩固了其对泛CoV的广谱抑制作用。
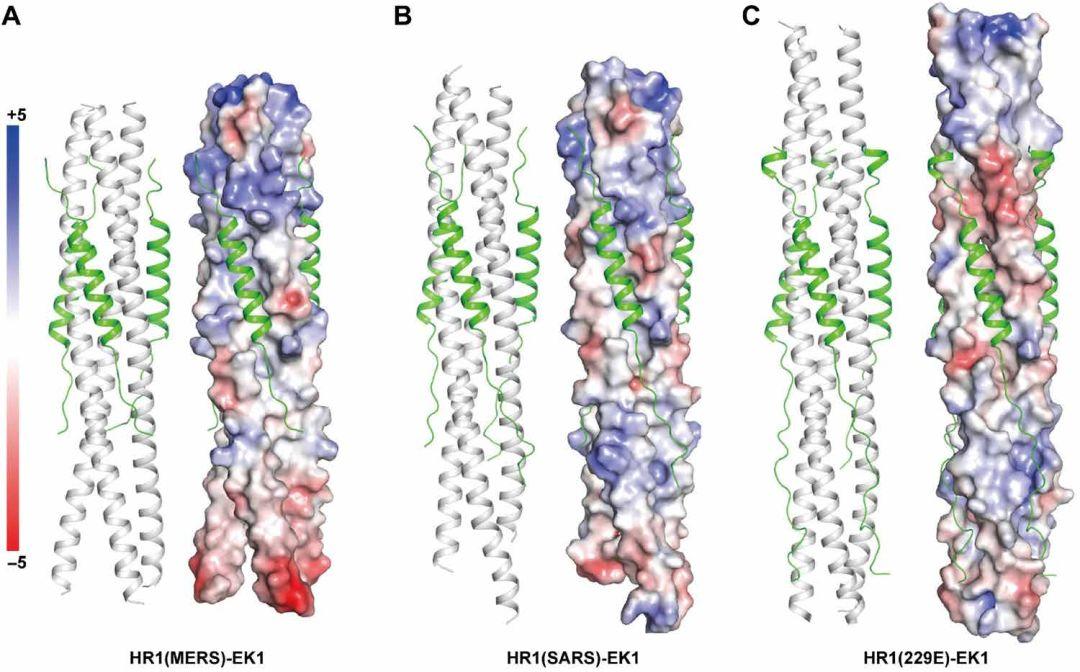
图4. EK1与HCoV的相互作用
图片来自SCIENCE ADVANCES
并排的带状图和静电表面表示法说明EK1恰好适合MERS-CoV(A),SARS-CoV(B)和229E(C)3HR1磁芯的两个相邻HR1螺旋之间形成的疏水凹槽。EK1肽显示为相应的HCoV 3HR1核的白底绿带(左)和静电(右)表示。疏水表面为白色,碱性为蓝色,酸性为红色。
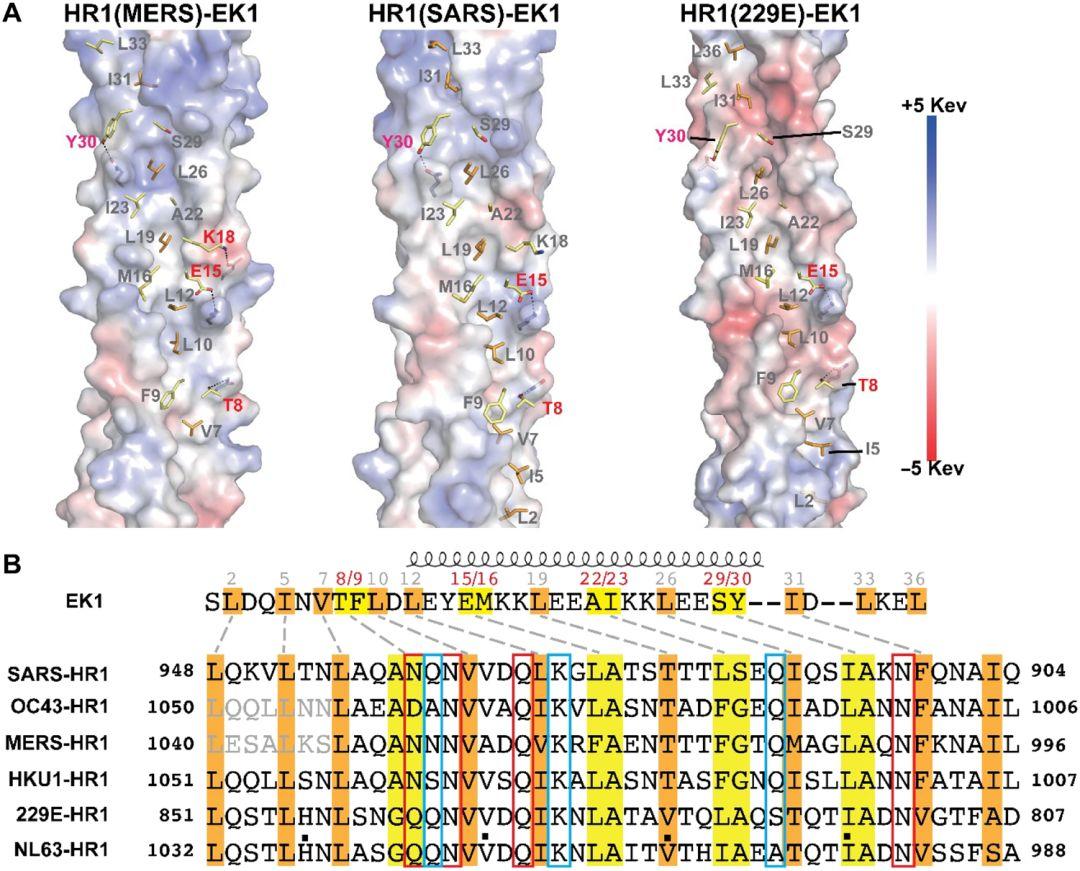
图5.在不同的EK1-HR1配合物中,EK1和3HR1疏水核之间的疏水堆积在很大程度上是保守的
图片来自SCIENCE ADVANCES
(A)3HR1显示为静电表面。在3HR1核心的疏水表面深凹的位置(口袋),将超过70%的侧链溶剂可及表面(SAS)掩埋到这些口袋中的EK1残留物显示为橙色棍状模型。在3HR1核心的疏水表面相对平坦的位置(山脊),将淡黄色的棒状模型显示为EK1残基相对于这些山脊堆积了50%至70%的侧链SAS。EK1残基被标记,其中红色标记的残基与3HR1核形成疏水和亲水相互作用。
(B)与EK1相互作用涉及的HR1残基在不同的HCoV之间保持保守。用虚线链接的EK1和HR1残基位于3HR1三重螺旋上的同一层。埋藏的EK1残留物以橙色阴影表示,而装填岭的EK1残留物以浅黄色阴影表示。介导3HR1磁芯组装的HR1残留物用橙色阴影表示,而与脊堆积有关的那些阴影用黄色阴影表示。介导保守的侧链与侧链和侧链与主链与EK1残基的亲水相互作用的HR1残基分别用青色和红色框突出显示。
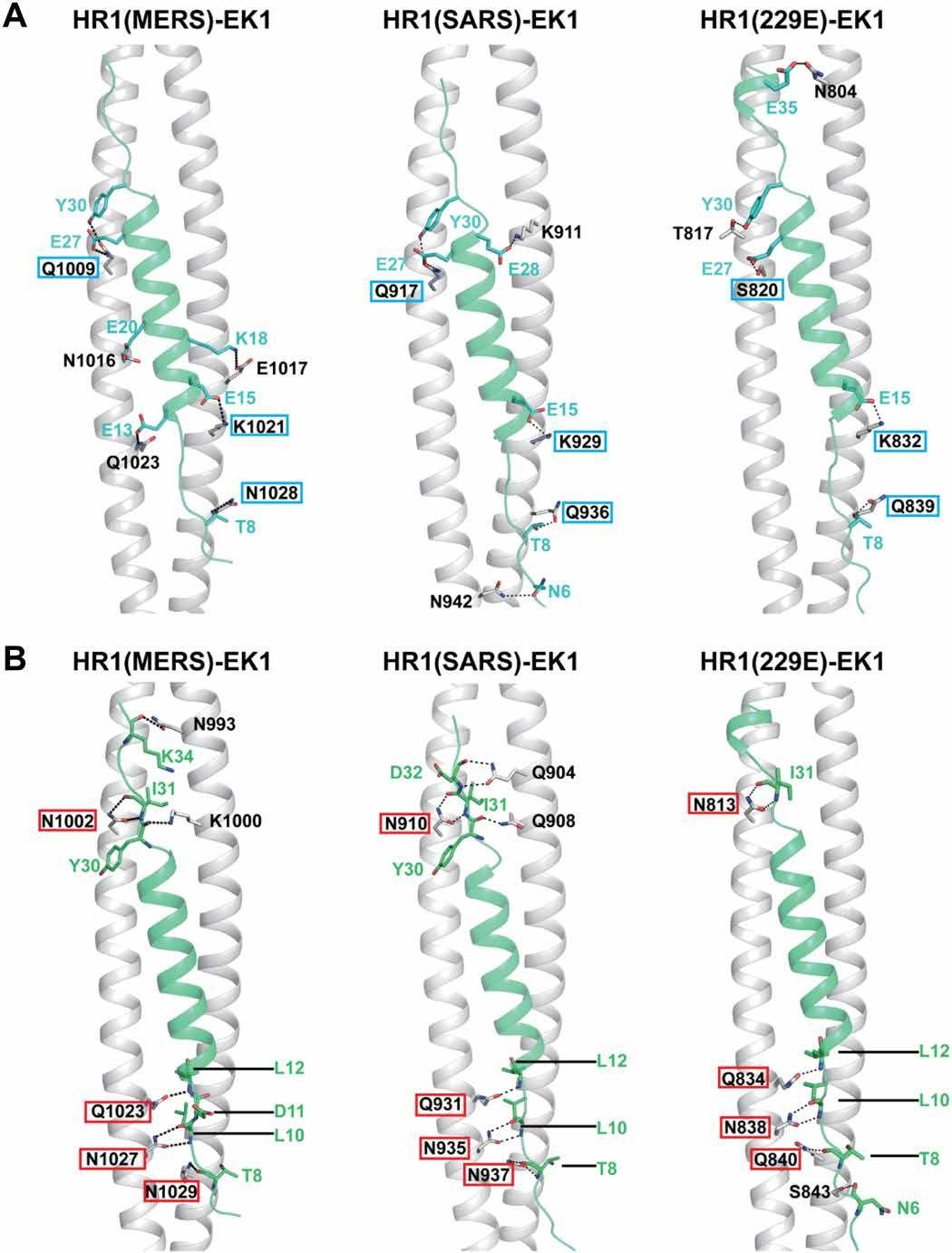
图6. EK1和3HR1核之间的高度保守的亲水相互作用
图片来自SCIENCE ADVANCES
(A)EK1和HR1之间的侧链至侧链亲水相互作用。这些相互作用涉及的EK1和HR1残基的侧链分别显示为青色和灰色棒状模型,并且类似地用颜色编码。至少四对这种亲水性相互作用在不同的EK1-HR1配合物中是保守的:Y30EK1与Q1009MERS(左),Q917SARS(中)或T817229E(右)形成相似的极性相互作用;E27EK1与Q1009MERS(左),Q917SARS(中)或S820229E(右)形成相似的极性相互作用;E15EK1与K1021MERS(左),K929SARS(中)或K832229E(右)形成盐桥;T8EK1与N1028MERS(左),Q936SARS(中)或Q839229E(右)进行类似的交互。上面提到的保守HR1残基用青色框突出显示。
(B)EK1和HR1之间的主链至侧链亲水相互作用。这些相互作用涉及的EK1和HR1残基分别显示为绿色和灰色棒状模型。为了清楚起见,未显示HR1残基的主链原子。与侧链到侧链的相互作用相似,主链到侧链的相互作用在不同的EK1-HR1配合物中也高度保守。红色框突出显示了参与保守相互作用的HR1残基。
总结与讨论
对于CoV的突变和多样性,研制广谱抑制剂药物和寻找稳定结合位点迫在眉睫。
尽管已经提出了S蛋白的RBD作为开发特异性抗体和疫苗的有效靶标。例如,RBD特异性抗体CDC2-C2表现出针对MERS-CoV感染的抑制活性。但是,单抗体CDC2-C2的使用可能导致MERS-CoV RBD中突变的出现。且CoV S RBD在整个进化过程中都是高变的,不同HCoV中宿主受体使用的明显差异。即使当同一宿主受体被不同的HCoV使用时,它们也经常靶向宿主受体上的不同结合位点。因此,针对RBD的特异性抗体或疫苗不可避免地缺乏针对HCoV感染的广谱活性。例如,Menachery等发现,尽管SHC014与SARS-CoV具有高度同源性并且可以结合相同的宿主受体ACE2,但SARS-CoV RBD特异性抗体不能保护小鼠免受SHC014 S蛋白的嵌合病毒感染。目前新出现的人类冠状病毒爆发与新的预防性治疗或疫苗开发之间存在时滞,临床上尚无有效且广谱的抗HCoVs药物或疫苗。因此,迫切需要开发新的广谱的药物并寻找稳定不易发生突变的结合位点,从而为将来可能爆发的HCoV做好准备。
确定泛HCoV融合抑制靶位点,发现并证实EK1的抑制活性
在1990年代初期,据报道,一系列源自HIV-1gp41 HR2(或CHR)结构域的肽,例如SJ-2176,DP-178(后来的T20)和C34,具有对HIV- 1 gp41介导的膜融合和HIV-1感染的抑制作用,低纳摩尔水平的IC 50值。随后,还报道了许多病毒融合抑制肽,这些肽与来自其他包膜病毒(包括RSV,埃博拉病毒,副粘病毒SV5和Nipah病毒)的I类膜融合蛋白的HR2序列重叠。2003年,博世(Bosch)等人发现从MHV S蛋白HR2区衍生的可溶性HR2肽可抑制病毒细胞进入,这表明CoV的S糖蛋白是I类融合蛋白,在S蛋白介导的膜融合过程中具有形成6-HB的能力。在2004年,Bosch和Jiang小组独立报告说,SARS-CoV S蛋白的HR2区衍生的肽可能与其HR1区的肽相互作用形成6 HB,并抑制了SARS-CoV S蛋白介导的膜融合和SARS- CoV感染具有中等效力。在2014年,Lu等人报道,源自MERS-CoV S-HR2的肽可竞争性抑制6-HB的形成,从而阻止病毒与宿主细胞融合。在以前的研究中,发现MERS CoV特异性融合抑制剂MERS-HR2P不能阻断SARS-CoV假病毒感染,也没有表现出任何广谱抑制活性。因此,尚不清楚6-HB是否是广谱抗HCoV抑制剂发展的良好靶标位点。
为确定泛HCoV融合抑制靶位点,并优选开发出针对人类呼吸道中多种HCoV感染的潜在泛HCoV抑制剂,研究组已成功建立了多个HCoV S介导的细胞-细胞融合测定法,以确定HR1P和HR2P之间的抑制谱,分别来自HCoV的HR1和HR2。发现OC43-HR2P具有对所有HR1P的广谱结合活性,并表现出对所有HCoV S介导的细胞-细胞融合的融合抑制活性。然后进一步优化了OC43-HR2P,以提高其抗病毒活性和溶解性。在各种体外模型,即细胞-细胞融合测定和假型或活病毒感染测定中,优化的肽EK1对HCoV和SL-CoV的感染表现出广泛而有效的融合抑制活性。接着评估了鼻腔给药对OC43和MERS-CoV小鼠模型的EK1的预防和保护作用。EK1在这些小鼠模型中表现出有效的预防和保护作用,并具有可接受的体内安全性。此外,体内药代动力学分析和安全性研究帮助我们为将来的潜在人体临床试验获取有用的数据。HR2衍生的肽在抑制相应病毒细胞融合中的效力差异很大。例如,抗HIV-1肽T20的效力比抗SARS-CoV肽SC-1效力高约900倍,但仅比抗MERS-CoV肽HR2P强30倍。众所周知,HIV-1和SARS CoV分别主要通过血浆和内体膜融合进入靶细胞,而MERS-CoV可以通过血浆和内体膜融合感染其靶细胞。因此,在效能上看到的巨大差异表明,只有有限数量的EK1肽可以进入内体来抑制病毒与细胞的融合。因此,增加融合抑制肽的细胞渗透性有望增强这些肽的效力。研究组最近报道了将烃钉合或棕榈酸基团(C16)添加至MERS-CoV融合抑制肽显着改善了其抗病毒效力和药代动力学性质。在不久的将来,将使用类似的方法来改善EK1的抗病毒活性。
最近的研究报道了几种新兴的SL-CoV,包括WIV1,SHC014和Rs3367,具有通过进一步进化或与SARS-CoV直接基因重组而感染高毒力人类的潜力。我们发现这些SL-CoV的HR序列与SARS-CoV的HR序列相同,并且我们预测EK1可以预防这些SL-CoV的感染。结果表明EK1有效抑制SL-CoV S蛋白介导的细胞间融合。此外还评估了EK1对WIV1和Rs3367假病毒感染的抗病毒作用,发现EK1对这两种SL-CoV表现出有效的抑制活性。CoV家族中的某些动物CoV非常接近HCoV,例如牛冠状病毒(BCoV)和MHV。这些CoV的HR序列与OC43的HR序列非常相似,这表明肽EK1也可能对这些病毒有效。一个有趣的问题是,为什么只有OC43的EK1和HR2表现出“泛CoV”抑制活性,而HR2的HR2其他HCoV则没有。H-HCoVs的HR2比α-HCoVs的HR2长得多(图1C),并且229E和NL63的HR2对接在α-HCoVs的3HR1核上导致严重的空间碰撞(图未显示)。因此可以理解,为什么229E和NL63的HR2对α-HCoV没有广谱活性(图1D)。
同时,来自OC43,SARS-CoV和MERS-CoV的EK1和HR2之间的序列比对为SARS-HR2和MERS-HR2的抑制范围有限提供了线索。尽管大多数介导疏水性(橙色和黄色阴影)和侧链至侧链亲水相互作用(青色框)的残基在EK1和不同HR2之间保守,但序列可变性确实存在于位置V7,Y30和一些其它部位。因此,我们将分析重点放在了不同HCoV的3HR1内核中的这些残留物及其周围的环境。在MERS(HR1)-EK1和SARS(HR1)-EK1的两个已解决结构中,V7 EK1的侧链都整齐地装配在这两个3HR1核心的疏水性口袋中。不过,在先前报告的SARS-CoV融合核结构中,A1156 SARS(相当于SARS-CoV中的V7 EK1)将松散地占据相同的空腔,而T1257 MERS(相当于由于Thr残基的极性,MERS-CoV中的V7 EK1无法完全掩埋其侧链。因此,EK1和OC43-HR2中的Val与Ala(在SARS-HR2中见)或Thr相比,在疏水位置上更适合于疏水腔。总的来说,我们观察到EK1和3HR1岩心之间有四个脊堆积作用。S29Y30 EK1结合的脊在MERS-CoV和SARS-CoV中被极性和带正电荷的残基包围,但在229E中被极性和带负电荷的残基包围,周围残基的侧链显示为棒状模型。在此位置,EK1和OC43-HR2中的极性对“ Ser-Tyr”似乎比SARS-HR2中的“ Ser-Leu”对更能适应不同HCoV中相反的静电环境。此外,Tyr的芳香环还可能与不同HCoV中的HR1侧链形成额外的极性相互作用(图6A)。同样,与Met(在EK1和OC43-HR2中)相比,与Ele(在SARS-HR2中)相比,与E15M16 EK1结合的脊也表现出更好的形状互补性。总体而言,似乎EK1和OC43-HR2在上述所有关键位置均具有更多的最佳氨基酸选择,这很可能说明了它们独特的泛CoV抑制活性。
在自然状态下,CoV表面上存在的S蛋白没有活性。受体结合的靶细胞蛋白酶通过切割暴露的酶靶位点激活S蛋白,使S2亚基自由介导病毒融合和进入。CoV可通过两种途径进入靶细胞:一种是胞吞途径,另一种是在细胞表面直接融合。例如,当SARS-CoV通过内吞途径进入靶细胞时,其S蛋白可以被内体中的pH依赖性半胱氨酸蛋白酶组织蛋白酶L切割并激活。另一方面,最近的研究表明,SARS-CoV S蛋白也可以被位于细胞表面的跨膜蛋白酶丝氨酸2(TMPRSS2)和人气道胰蛋白酶样蛋白酶裂解和激活,从而激活和活化允许S蛋白在质膜上介导SARS-CoV感染。根据这一发现,松山等人报道说,HR2肽有效抑制SARS-CoV进入细胞,而溶酶体试剂则完全不能抑制。同样,TMPRSS2也具有通过绕过内吞途径并直接激活其在细胞表面的S蛋白来促进MERS-CoV进入的能力。最近,一些研究报道了TMPRSS2可在人呼吸道上皮细胞表面高度表达,甚至与几种CoV受体(如ACE2和DPP4)有关。因此,质膜融合途径似乎是人类呼吸道中HCoV感染的首选。先前的研究发现,鼻腔给药特异性融合抑制剂HR2PM2可有效抑制MERS-CoV和MERS-CoV感染。其他研究也报告说,目前229E和OC43的临床分离株对细胞表面TMRRSS2非常敏感,但对内体组织蛋白酶不敏感。总体而言,对于当前循环的HCoV或新兴的HCoV,人类呼吸道中的细胞表面融合途径似乎非常重要。因此,肽融合抑制剂和鼻内给药策略是预防通过气道感染HCoV的极佳选择,这是HCoV快速建立感染并广泛传播到其他器官的关键部位。当前,正在传播的HCoV对人类构成潜在威胁。而且,几乎可以肯定的是,其他人畜共患的冠状病毒将来也会传播给人类。因此,具有广谱抑制活性的HCoV特异性药物的可用性对于预防和控制未来的HCoV流行很重要。靶向峰值HR1保守位点的EK1融合抑制剂肽,而不是高变RBD区,对多种HCoV感染具有有效且广泛的抑制活性。通过鼻腔给药,EK1表现出有效且广泛的抗HCoV活性,在体内具有令人满意的安全性。因此,EK1作为抗多种HCoV感染的抗病毒剂,尤其是用于婴儿和老年人以及免疫力低下的患者(可能更易受HCoV感染),有望作为进一步开发的抗病毒药物。同时,这项研究为开发具有潜力和广度的肽融合抑制剂提供了线索和方法,以抑制其他高致病性包膜的具有I类膜融合蛋白的其他病毒的感染,例如埃博拉病毒和马尔堡病毒,亨德拉病毒和尼帕病毒以及流感病毒。
参考文献
A pan-coronavirus fusion inhibitor targeting the HR1 domain of human coronavirus spike. Shuai Xia, Lei Yan, Wei Xu, Anurodh Shankar Agrawal, Abdullah Algaissi, Chien-Te K. Tseng, Qian Wang, Lanying Du, Wenjie. Sci Adv 5 (4), eaav4580. DOI: 10.1126/sciadv.aav4580