
引言
候选药物激发疗效所需的最佳药代动力学(PK)高度依赖于靶向药理学,这种关系在药物发现的早期阶段常常无法很好地表征。围绕PK和药效的一般假设会误导化合物筛选和化合物设计,使其吸收、分布、代谢和排泄(ADME)或分子特性不理想,最终可能增加消耗,并增加先导和先导优化时间线。本工作介绍了基于模型的靶向药理学评估(mTPA),一种结合了基于生理学的药代动力学/药效学(PBPK/PD)建模、敏感性分析和机器学习(ML)的计算方法,该方法可以用于阐明PK、效价和专门针对靶向药理学的ADME。给出了常见的PK/PD关系的示例,以说明其应用,并讨论了采用这种方法来指导早期发现药物的实用性和效益。
背景
一种成功的候选药物能够提供预期的治疗效果,将不良影响最小化,并通过实际的给药计划来给药。通常只对少数具有候选药物动力学和效价特性的化合物进行重复剂量药效研究,以详细评估药理学性质。在PD方法之前使用此PK的一个挑战是,在早期发现中,理想PK驱动程序的标准并不明显。疗效在很大程度上取决于诸如未结合药物在作用部位的时间进程,药物与靶标相互作用方式的特征以及药物动力学的动力学等因素。对于发现过程中经常遇到的复杂新颖的药理机制,最佳的PK驱动程序不仅难以直观地推论出,而且也无法很好地适应上述驱动程序类别。从而错误地评估最佳PK驱动程序的功效并导致优化工作方向错误以及发现延迟。虽然可以通过使用工具化合物进行广泛的体内药理研究来补救此问题,但这将占用大量资源,并且不符合3R的原则,因此,在早期发现期间进行研究通常不切实际。
本文介绍了基于模型的靶向药理学评估,这是一种用来识别基于生理学的药代动力学和药效K、吸收、分布、代谢和排泄和特定目标的物理化学特性的计算方法。mTPA的主要步骤如图1所示。该方法目前正在葛兰素史密斯克莱恩的药物发现的早期阶段实施。PBPK/PD模型应用于大量的虚拟化合物,并根据模拟的药理学反应对建模结果进行分类。建模结果根据模拟药理反应进行分类。敏感性分析和决策树模型应用于结果数据集,以识别最有可能引发预期药理效果的化合物组合。通过在发现早期实施这种方法,研究人员可以定义生物学特定的PK和ADME,在先导物优化之前筛选策略,从而更早地识别出更高质量的候选药物,并减少从目标识别到候选药物选择的时间。
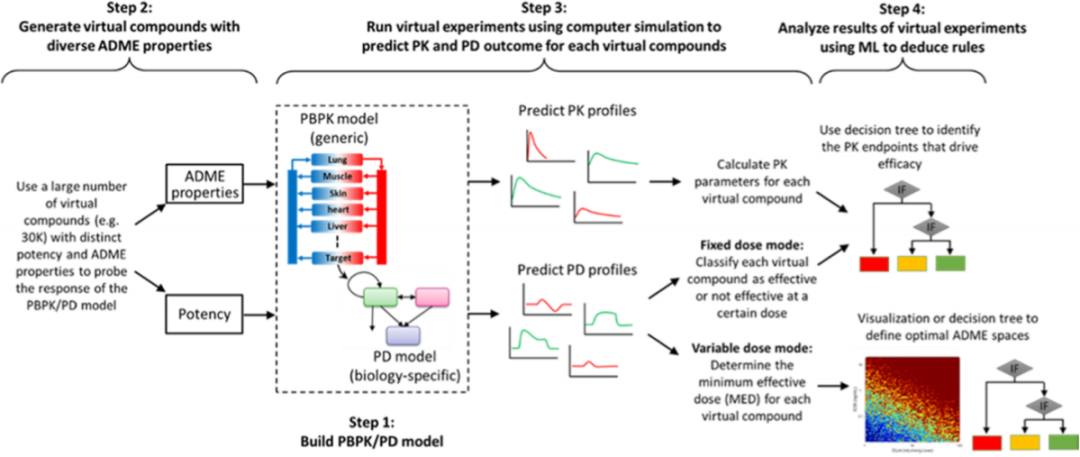
图1. mTPA使用计算机模拟和机器学习
来确定PK和ADME驱动程序的功效
图片来源于JMC
结果
1. 确定最佳PK驱动因素
为了说明所提出的计算方法在PK驱动因素方面的应用价值,在固定给药方案下,本文建立了四个PBPK/PD模型(图2),来模拟30000个虚拟化合物的相关反应。在这些模拟中假设药理作用是由靶组织中的尚未结合的药物的浓度驱动的。在这些模拟中,假设目标组织处于快平衡状态。随后讨论了缓慢平衡靶组织的影响每个化合物的PD值,分类为“有效”或“无效”:对于直接、间接和前体活化PD模型,疗效定义为在2周治疗方案的最后一天对PD终点的50%抑制,而对于肿瘤生长抑制,有效治疗定义为治疗2个月后100%肿瘤生长抑制。在对每种化合物的反应进行分类后,使用决策树分析确定哪些血液PK终点是疗效的关键驱动因素。决策树分析的结果表明,对于所检查的四种类型的PK/PD关系中的每一种,达到疗效所需的最佳PK终点是不同的(图3)。药效的PK驱动因素对靶向生物学具有高度特异性,即使对于相对简单的PD模型也是如此。在药物发现过程中可能遇到的更复杂的情况下,可能很难直观地确定最佳的PK驱动因素。在这些情况下,决策树分析是识别PK驱动因素的有用工具。
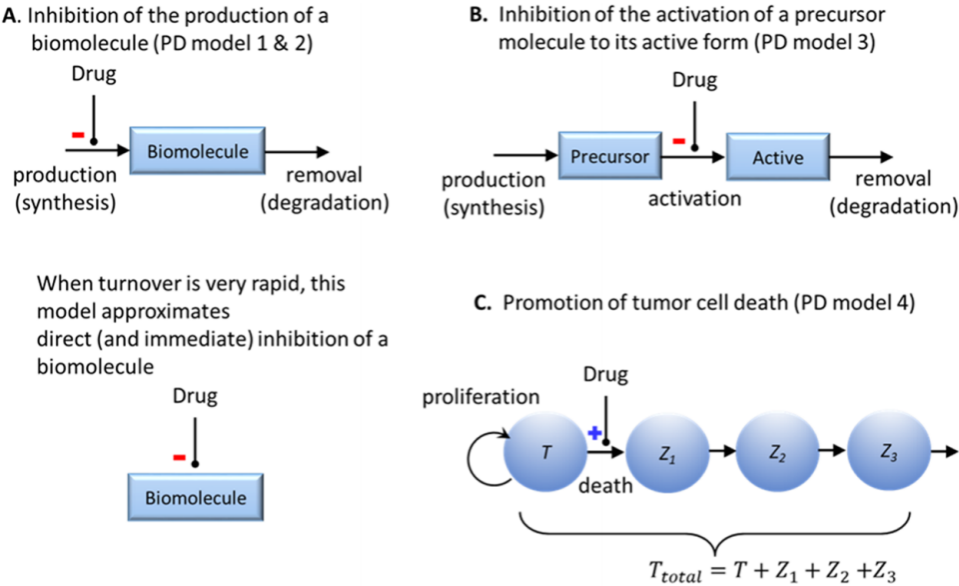
图2. 四个PBPK/PD药效学模型
用于证明所提出的计算方法的实用性
图片来源于JMC
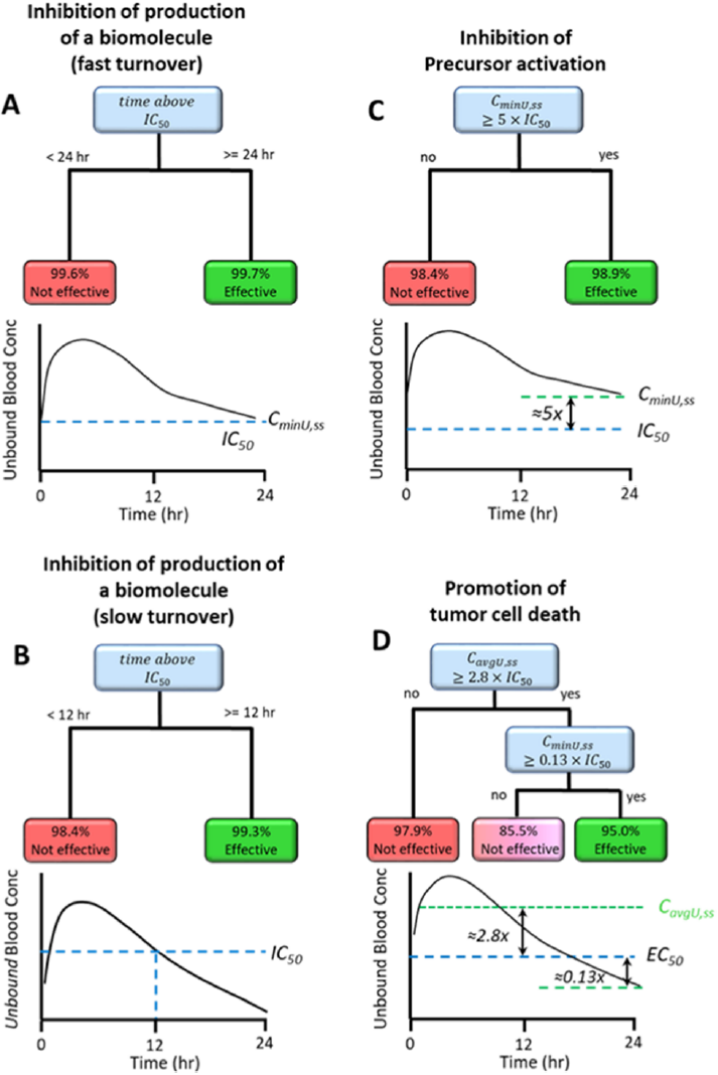
图3. 图2描述的四种药理学机制中
每种类型的PK驱动因素的决策树结果
图片来源于JMC
2. 确定最佳ADME效价空间以最小化剂量
图4展示了通过抑制前体蛋白的激活来探索剂量−ADME特性关系的过程。探索性敏感性分析表明,最小有效剂量对半抑制浓度和内在清除最敏感,其次是渗透性和溶解性。其次是组织分割,这会影响分布体积,因此影响半衰期。ADME空间说明了MED和ADME属性之间的关系。结果表明在体外筛选期间应优先考虑的ADME特性,并定量地定义了有效化合物的最佳参数空间。该分析强调了将药物设计作为一个多参数优化来考虑,而不是对每个单独的属性设置单变量阈值的重要性。效力本身并不是临床疗效的唯一决定因素。使用一个固定的效力阈值作为选择标准可能会丢失许多具有可接受的临床剂量的化合物。如果不考虑渗透性和溶解度的阈值,那么渗透性和溶解度的相互依赖性可能会导致化合物的分类错误。图5表明,探索由相互作用的ADME特性定义的复合参数是提供化合物选择定量标准的另一种方法。认识到ADME性质的相互权衡,复合分类不仅根据单个的ADME性质,还要根据它们之间的成对相互作用。
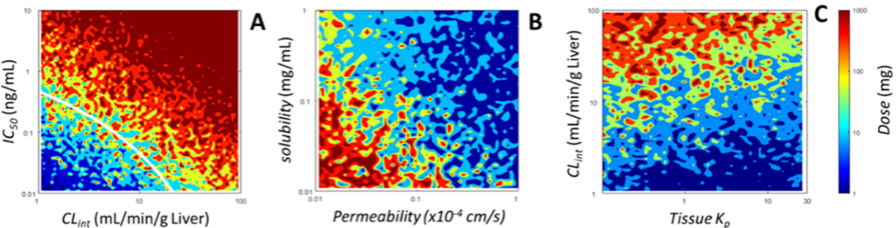
图4. 最小剂量的最佳ADME空间
图片来源于JMC
图5. 使用复合属性定义最优的ADME空间
图片来源于JMC
实验部分
1. PBPK/PD建模
基于生理学的药代动力学(PBPK)建模已成为药物发现的关键组成部分。PBPK模型是将特定物种的已知生理学与复合ADME特性相结合,以估计血液、血浆和组织中的浓度和时间分布。它们在药物发现中的主要效用在于“自下而上”方法,其中描述吸收、分布和消除的参数是根据体外测量的值或使用定量结构−活性关系预测的。
2. PKPD模拟实验
使用蒙特卡罗模拟生成30000个虚拟化合物来进行实验。在这种情况下,30000种虚拟化合物被认为适合达到决策树的输出和灵敏度分析中的稳定性。更复杂的PD模型可能需要更多的样本来产生具有代表性的结果分布。虚拟PK/PD实验在两种模式下进行:分别是固定计量模式和非固定计量模式。
3. 决策树建模
由布雷曼等人开发的分类树算法被用来使用虚拟化合物的PD响应来构建决策树。每个化合物根据其模拟反应进行分类,建造了两组决策树。一个使用描述性的PK参数来识别PK驱动程序的有效性。另一种树使用效力和ADME特性作为输入特性来确定有效性的最佳分子空间。
4. 敏感性分析和可视化
使用布里曼所描述的平均降低精度方法进行灵敏度分析,以识别MED对可视化最敏感的ADME特性。简言所述,建立了利用部分最小二乘(PLS)回归从ADME特性预测最小有效剂量的模型。通过计算参数随机排列后PLS模型精度的降低来评估参数的灵敏度。
5. 软件
所有的PBPK/PD模型、模拟、分析和可视化都在MATLAB版本9.7R2019b和模拟生物学版本5.9中完成,并使用内部编写的函数。
讨论
在过去的几十年里,人们越来越多地使用PBPK和PD模型来提高药物发现和开发的成功率。机器学习也在药物发现和开发的所有阶段有了越来越多的应用。mTPA是这两种强大方法的结合。它本质上是PBPK/PD模型的反向应用;不是使用该模型来预测具有已知PK性质的化合物的有效性,而是用来确定在合理剂量下达到特定PD反应需要的PK/ADME性质。这是通过用数千种具有广泛ADME性质的虚拟化合物的PBPK/PD模型来实现的,以查看哪些组合产生所期望的药理学结果。机器学习算法以其能够从大数据集中提取模式而闻名,然后被用来识别有效虚拟化合物的共同PK、ADME和分子性质。决策树建模是一种有监督的机器学习算法,它表示观察结果和它提取的结果之间的关系。目前的分析证明了最佳PK和ADME特性与靶向药理学的依赖性,以及如何使用mTPA来识别PK驱动程序以传递有效性及实现所需临床剂量的相应ADME特性。
1. 在药物发现中的应用程序
在发现早期使用MTPA能够筛选或优化化合物,以获得适合特定目标生物学的最佳PK和ADME。根据正确的PK/ADME参数空间来评估化合物,可能会减少消耗,并缩短发现时间。在优化工作真正开始之前确定PK终点驱动有效性很重要。该方法不仅仅是一种使用QSAR驱动的PBPK/PD模型对潜在的化合物进行实际筛选和排序的方法。相反,mTPA有目的地生成一个可解释的模型,可以指导科学家关注哪些特性进行合理设计,从而优化对药理学结果影响最大的化合物特性。这种方法的成功取决于建立一个PBPK/PD模型,它可以合理地捕捉到影响剂量/有效性的关键信息。另一方面,也必须防止过度参数化,因为一个参数的过度拟合会导致mTPA分析结果的错误。
2. 挑战和限制
实现mTPA需要克服几个挑战。首先,mTPA分析的有效性取决于PD模型的准确性,但缺乏药物作用机制的详细知识,对目标通路动力学不理解,缺乏验证模型的数据,以及从体外分析推断体内效力的难度。其次,模型参数化的不确定性以及在分析mTPA结果时如何解释这种不确定性的问题。这种不确定性会使化合物的分类和排序复杂化,并影响ADME效力空间的准确性。然而,这些挑战是可以克服的。PBPK/PD模型不需要像用于定量预测人类剂量的模型那样精确,它可以区分化合物到广泛的分类组、确定哪些化合物属性是最重要的药理结果、指出这些属性应该如何改变来增加疗效,减少剂量等。PD模型的质量和准确性也将随着发现工作的进展而提高。但它仍然可以用来评估、并提供关于应该优化哪些参数的意见。
3. 未来的方向
利用机器学习算法来识别有效的虚拟化合物的分子特性的工作正在进行中。使用生物学特异性PD模型作为自动分子生成的目标函数也正在探索中。此外,分析的范围也在扩大,用于确定化合物的性能,平衡安全性和有效性。通过基于模型的药物发现和开发原则,定量PBPK/PD/QSP模型在药物发现决策中的应用在过去十年中显著增长。这使得药物的发现可以被临床疗效的预测所指导,此外化合物的特性可以优化以获得临床成功。早期剂量预测为候选分子成功的可能性提供了衡量标准,该模型使设计策略成为可能,测量和预测的特性可以直接与预测的剂量相关联。
参考文献
Emile P. Chen, Robert W. Bondi, and Paul J. Michalski, Model-based Target Pharmacology Assessment (mTPA): An Approach Using PBPK/PD Modeling and Machine Learning to Design Medicinal Chemistry and DMPK Strategies in Early Drug Discovery, Journal of Medicinal Chemistry, 2021, 64, 6, 3185-3196. DOI: 10.1021/acs.jmedchem.0c02033.