
介绍
甲基硫代腺苷磷酸化酶(MTAP)基因位于CDKN2A肿瘤抑制剂附近,在大约15%的癌症中与CDKN2A共编码,从而导致肿瘤治疗效果降低,但目前没有有效的分子靶向治疗方法。MAT2A在肿瘤的代谢和表观遗传学中具有重要作用,它会产生甲基供体S-腺苷酸蛋氨酸(SAM)。最近的研究表明,使用RNA干扰消耗MAT2A会导致因MTAP缺失导致的癌症得到治疗。对此的解释为:PRMT5的活性受到MTA的抑制,PRMT5酶的催化活性降低,并且它很容易因SAM水平的降低而被进一步抑制。尽管靶向MAT2A对由MTAP缺失的引起的癌症中是有益的,但设计有效MAT2A抑制剂一直具有挑战性。本文介绍了AG-270的药物发现,AG-270是目前临床开发中的一种口服的生物利用度高的MAT2A抑制剂。此类MAT2A抑制剂具有变构作用,底物不具有竞争性,并通过阻断产物释放来抑制MAT2A活性。此外本文还报告了临床前研究的结果,描述了这类抑制剂的体外和体内特性。
结果与讨论
1. 通过片段筛选发现MAT2A抑制剂
使用质谱超滤分析筛选了一个> 2000个片段的数据库以结合MAT2A蛋白二聚体。最终鉴定出31个片段,命中率为1.55%,随后在正交酶法中进行了验证并进行SPR分析。在这些片段中,化合物1在620μM下对MAT2A表现出弱的酶抑制作用(图1A),这与弱的SPR传感图一致(图1B)。进行了命中扩增相似性搜索,并购买了54种市售化合物并测试了MAT2A的酶促抑制作用,然后进行了SPR结合。在虚拟命中中,有2种被确定为最有效的MAT2A抑制剂(图1A),IC50为1.5μM,显示出良好的剂量依赖性SPR信号,解离常数为70μM(图1B)。使用化合物2进行的动力学显示了针对ATP和L-蛋氨酸的非竞争性抑制方式,表明结合位点位于催化活性位点之外(图1C)。
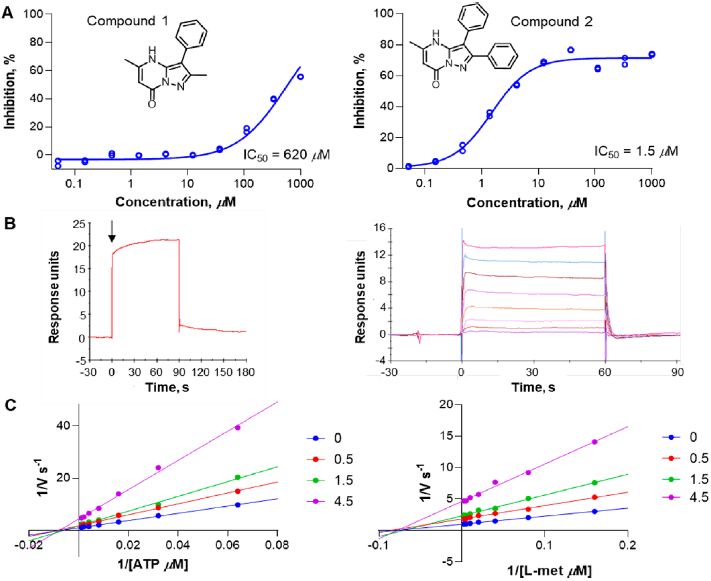
图1. MAT2A的命中与识别
图片来源于JMC
2. 基于结构设计产生有效的MTAP-Null选择性的MAT2A抑制剂AGI-24512
结构分析表明,大部分疏水残基占据化合物2的R1和R2取代基周围结合位点的区域。在R1和R2位置形成靶向取代基,从而产生初始SAR(图2和图3)。R2基团的初步探索集中在探查R2结合口袋的性质。使用一种HCT116 MTAP的细胞分析法,通过测量浓度越来越高的更有效化合物处理后MAT2A产物SAM的丰度,来评估癌细胞中MAT2A的抑制作用。结构分析还可评估抑制剂结合对MAT2A活性位点的影响。活性位点具有环状α-螺旋环结构,该结构覆盖了活性位点的入口并在SAM结合时关闭。在所有与抑制剂结合的MAT2A共晶体结构中,均在活性位点观察到SAM,并且在闭合位置保留。该先导化合物AGI-24512在细胞分析中得到了充分表征,并成为重要的体外工具,使进一步的细胞研究能够评估MAT2A生物学性质。研究结果表明AGI-24512处理后MAT2A蛋白的上调。该途径反馈机制并未阻止AGI-24512的抗增殖活性。MTAP无效基因型癌细胞生长的这种药理学选择性降低证实了我们先前针对MAT2A的遗传工具的观察结果,表明对MAT2A酶功能的药理学抑制是一种可行的治疗方法。

图2. 化合物2与MAT2A和反应产物SAM(PDB代码7KCE)的共晶结构
图片来源于JMC
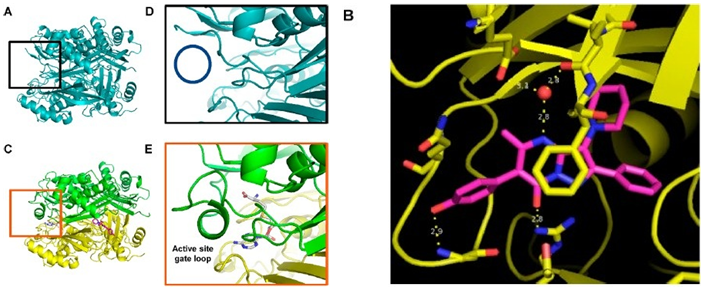
图3. MAT2A-SAM-AGI-24512的共晶结构
图片来源于JMC
3. 主要候选药物AGI-25696的发现
对AGI-24512药代动力学特性的初步评估,在此阶段,所有化合物在临床前物种和人微粒体中均显示出快速的氧化代谢,因此重点在于改善代谢稳定性。首先在R3位置生成包含其他氢键受体的类似物,以研究其维持酶效能同时改善其代谢稳定性的能力。尽管大多数化合物都显示出良好的酶促作用,但只有在R1处掺有苯基取代基的AGI-25696才能产生非常稳定的类似物,该首个代谢稳定的类似物在150 nM时表现出良好的细胞活性(图4),并在体内进行了进一步的分析。
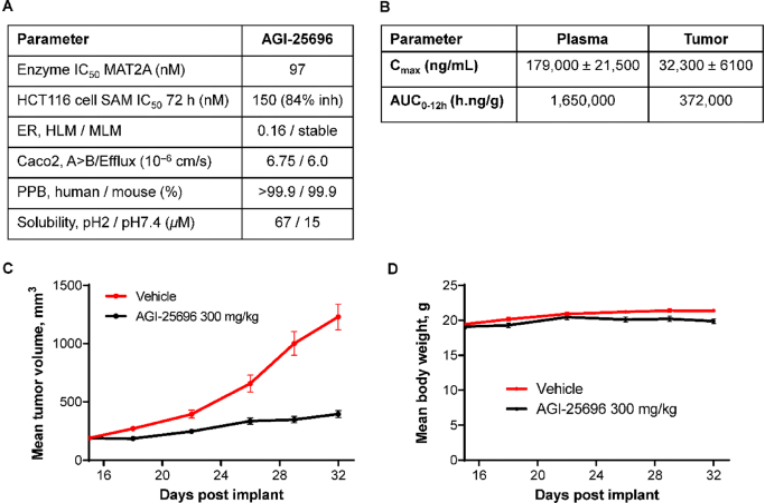
图4. 用体内工具分子对MAT2A进行药理靶向可选择性地阻断体内无MTAP的肿瘤的生长
图片来源于JMC
4. 临床候选药物AG-270的发现
AGI-25696的PPB很高,而在Caco-2分析中却有很高的流出比(图4),据推测,这种化学型的弱酸性性质是由图5中描述的互变异构驱动的,有助于高血浆蛋白结合。由于酸性质子可以位于三个不同的位置,因此可引起与血浆蛋白结合的各种模式。
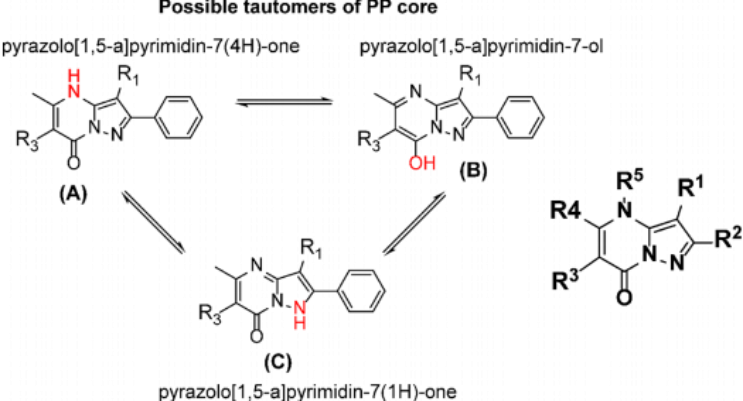
图5. 互变异构体对物理化学性质负责吗?假设:AC的三种可能的互变异构体在支架的不同位置共享酸性质子,这可能会增加每种化合物与血浆蛋白结合的能力
图片来源于JMC
5. 核心的N-甲基化虽可降低PPB,但也会降低最大抑制百分比
消除了酸性质子并阻断了互变异构的N甲基化类似物如表1所示,但是,类似物28和29显示MAT2A的最大抑制百分比从> 90%降低到了< 70%。在其他R5类似物中也观察到了这种趋势,因此,这种提高游离分数的策略在维持抑制剂的全部功效方面并不成功。在整个发现程序中,酶促变构抑制作用IC50与72小时细胞分析EC50的相关性很好,但与最大抑制百分率的相关性不强。
表1. N-甲基化改善PPB自由分数
表格来源于JMC
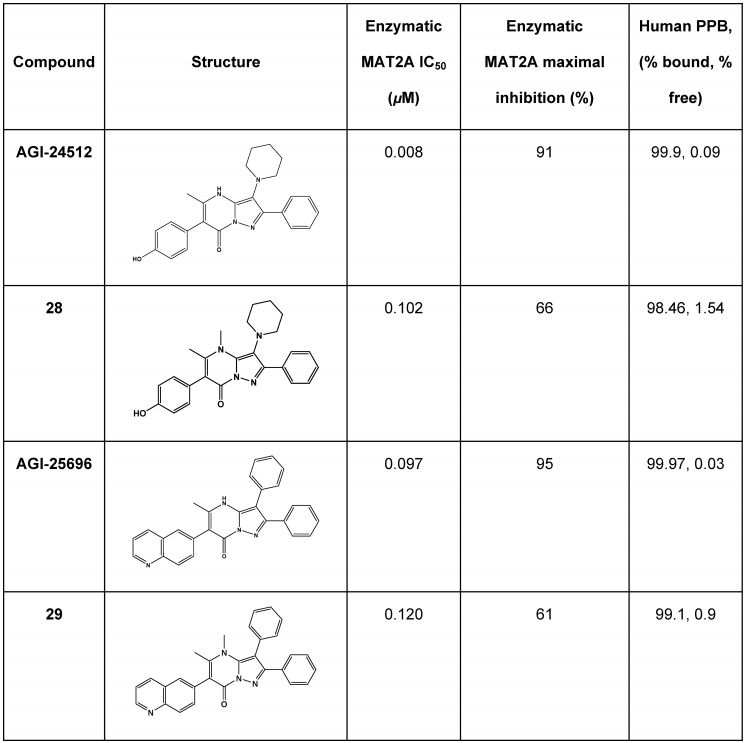
6. 通过分子内氢键掩蔽核心N- H可提高最大抑制百分比,但会影响其他ADME参数
确定了该类似物与MAT2A(MAT2A-SAM-34)的共晶结构(图6A),分辨率为1.24Å。注意到残基Gln190的酰胺羰基与R4处的NH,Ile332的主链羰基与R4的吡唑的氢以及R4吡唑的sp2(芳族)氮与分子之间的分子内氢键之间存在新的相互作用。然后假设该分子内氢键负责通过掩盖酸性氢来改善最大抑制作用并降低PPB(表2)。该策略成为一种对抑制剂具有更大抑制作用且比N-甲基化程度更低的人PPB的更可行方法。在药物化学中已经采用了类似的内部氢键策略来掩盖极性,并已被用来改善多种结构类别的某些物理化学参数。在R3上带有4-羟苯基的类似物显示出低纳摩尔酶促效能和高百分比最大抑制作用(表3)。该化合物(MAT2A-SAM-35)的共晶体结构以1.24Å的分辨率测定,证实了预期的结合模式(图6B)。此外,在34和AGI-24512的晶体结构中观察到的所有相互作用在35中都继续保持,验证了对MAT2A抑制剂相互作用的累积结构理解。合成了35个类似物,在改变了R1和R3的同时将氨基吡唑取代基保持在R4上(表3)。这些先进化合物的表征包括细胞测定,该测定在72小时内测量了MTAP无细胞中SAM的产生,以解释MAT2A上调以及细胞增殖测定。还测量了微粒体稳定性和PPB。
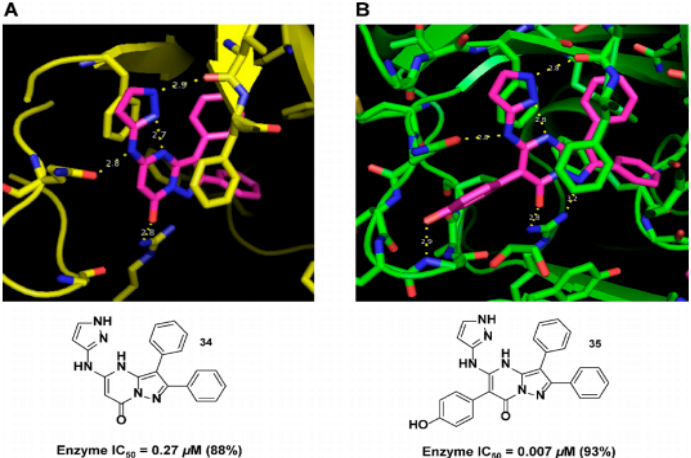
图6. 分子内氢键可提高最大抑制百分数
图片来源于JMC
表2. R4基团的探索
表格来源于JMC
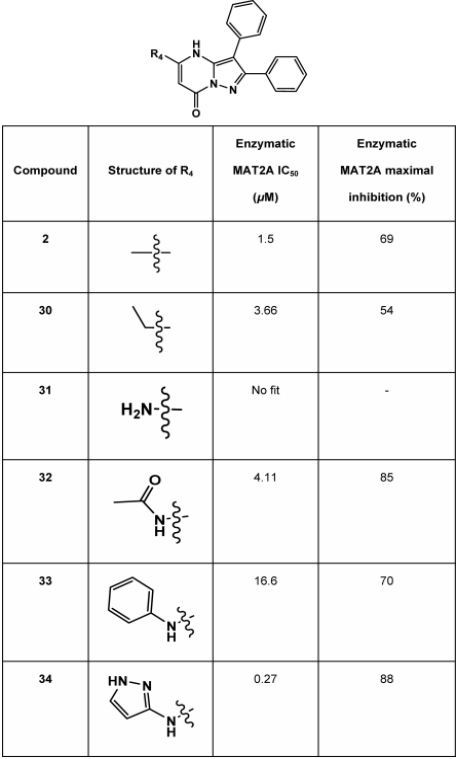
表3. 进一步R4探索提高了细胞效能
图片来源于JMC
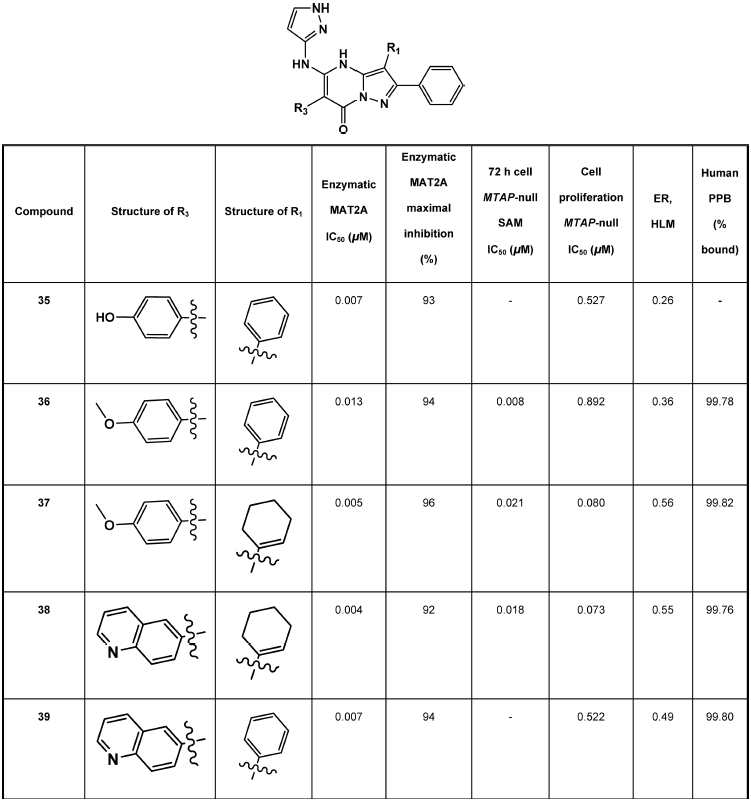
7. 掩盖核心N- H并减少氢键供体的数量产生AG-270
在R4处进行进一步修饰可在内部氢键成功掩盖极性。掩盖极性和减少氢键供体的数量需要同时进行。效能和类药性综合最佳的化合物是AG-270,将R4处的2-吡啶与R1处的环己烯结合在一起。AG-270的测得pKa为8.56,大大高于AGI-25696的测得pKa 6.3。通过来自R4取代基的2-吡啶的分子内相互作用掩盖酸性氢(pKa = 6.3)的影响是使互变异构体稳定至大部分所需的互变异构体,其中氢保留在R5的核心氮上。这在酶和细胞分析中均具有良好的效能,同时将游离级分提高至1.54%(表4)。以1.32Å的分辨率确定MAT2A·SAM·AG-270的共晶体结构,并确认了设计模式(图7)。维持了在35的共晶结构中看到的预期相互作用,并验证了内部氢键,表明结合的构象是AG-270的低能构象体。根据所使用的方法,对该生物活性构象进行的能量计算证实其处于全局最小值或接近全局最小值。此外对AG-270的ADME特性,体外辅助药理学和口服生物利用度进行了进一步表征,AG-270的特性总体上是令人满意的,因此AG-270的总体优越性能使其成为详细体内分析的选择(表5)。
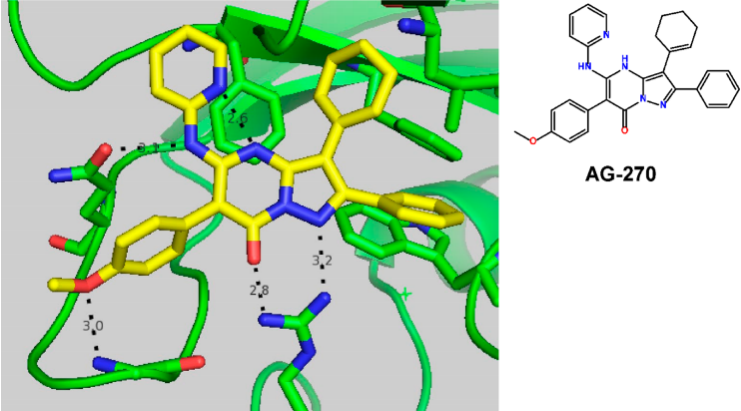
图7. AG-270与MAT2A的共晶结构(PDB代码7KCC)
图片来源于JMC
表4. 最终R4探索生成具有平衡性质的化合物
表格来源于JMC
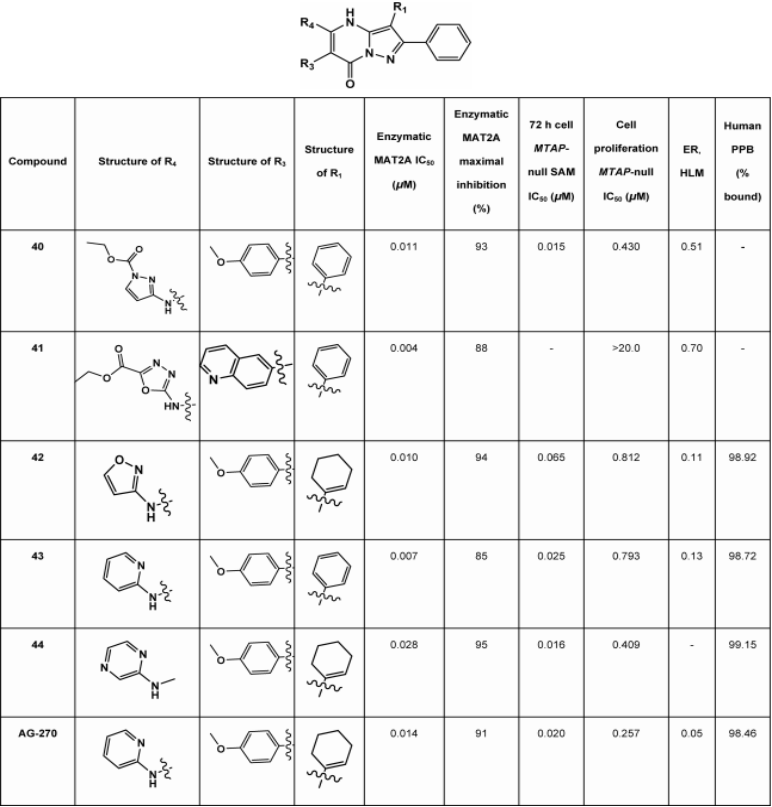
表5. AG-270的特性
表格来源于JMC

结论
对癌细胞中MTAP丢失的研究表明,MTA积累使MAT2A和SAM的生产对酶PRMT5具有依赖性。然而,现有的PRMT5的临床阶段抑制剂无法解决这种MTAP依赖性作用,可能是因为现有的抑制剂具有与MTA21不同的SAM非竞争机制,因此不能选择性抑制MTAP-null的增殖。相反,MTAP-WT癌细胞可通过MAT2A抑制作用降低SAM水平并提升MTA协同作用,从而选择性抑制MTAP缺失细胞中的PRMT5,从而抑制细胞生长。因此,通过限制SAM,抑制MAT2A可以选择性抑制MTAP无效的癌细胞和肿瘤中PRMT5的活性,限制PRMT5抑制作用的潜在毒性比已知的PRMT5抑制剂具有更大的治疗前前景。本文描述了通过结构导向设计发现MAT2A的有效和选择性抑制剂的过程。此外,证明了MAT2A的抑制作用可抑制体内MTAP缺失的癌症的生长,从而验证了MAT2A作为治疗靶点的意义。
参考文献
1. Zenon Konteatis, Jeremy Travins, Stefan Gross, et al, Discovery of AG-270, a First-in-Class Oral MAT2A Inhibitor for the Treatment of Tumors with Homozygous MTAP Deletion, J. Med. Chem., 2021, 64, 8, 4430-4449. DOI: 10.1021/acs.jmedchem.0c01895.
2. Peter Kalev, Marc L. Hyer, Stefan Gross, et al, MAT2A inhibition blocks the growth of MTAP-deleted cancer cells by reducing PRMT5-dependent mRNA splicing and inducing DNA damage, Cancer Cell, 2021, 39, 2, 209-224. DOI: 10.1016/j.ccell.2020.12.010.