先睹为快
靶点
二酰基甘油脂肪酶diacylglycerol lipase (DAGL)
小分子配体
三氮唑杂环抑制剂DH376及5个类似物
计算方法
同源模建(homology modeling)
共价对接(Covalent Docking)
分子动力学模拟(Molecular Dynamics)
计算软件
YASARA;Schrödinger;Desmond
单位与作者信息
莱顿大学Mario van der Stelt教授
发表杂志
Journal of Medicinal Chemistry
计算流程
通过共价对接手段,将1-5化合物对接到模建的DAGL蛋白受体中,再用分子动力学模拟分析5个复合物的相互作用特征。
背景

在过去的十年中,人们重新对共价抑制剂的开发产生了兴趣,这些共价抑制剂可用于多种药物靶点,包括丝氨酸水解酶和激酶超家族。共价不可逆抑制剂先以可逆的方式与蛋白质结合,经过一个时间依赖的化学反应,使酶失活(图1)。共价不可逆抑制剂的发现过程中,通常侧重于优化IC50值来确定的效价,然而,固有的高反应性可能导致与同一酶家族的其他成员的特异性结合,正如最近发现的BIA 10-2474抑制剂的严重副作用。应用特异性常数k=(Kinact / Ki)很好的避免IC50值的测定和时间依赖性的问题,可以用来指导抑制剂的优化。
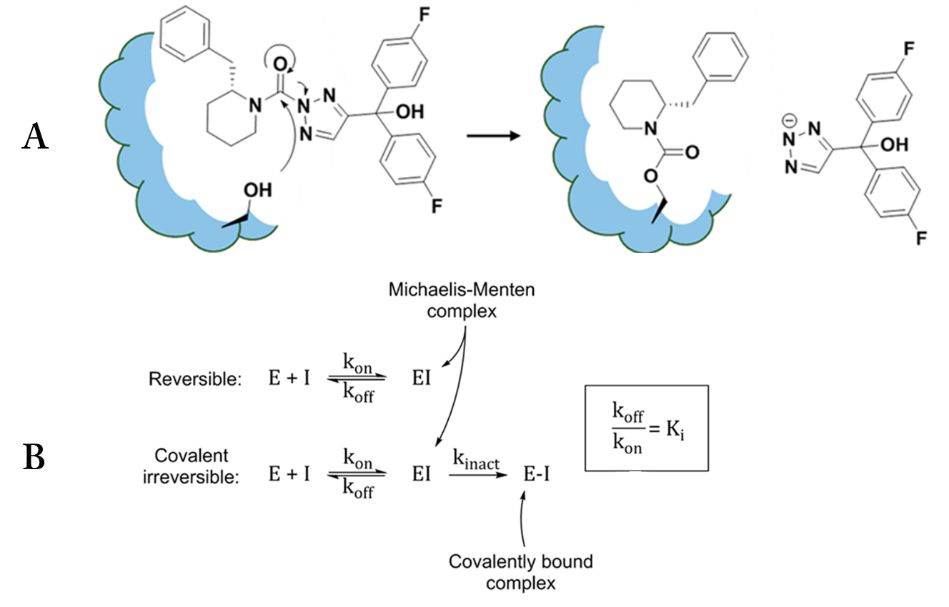
图1. A. 三唑类尿素抑制剂对丝氨酸水解酶的作用机理; B. 可逆、不可逆的反应方程式
图片来源JMC
二酰甘油脂肪酶(DAGL)是一类丝氨酸水解酶,负责合成内源性 2-氨基酰甘油。调节DAGL的活性对代谢性和神经炎症性疾病的治疗具有重要意义。目前有一类三唑类尿素DAGL抑制剂,它们通过形成稳定的氨基甲酸盐加合物,不可逆地结合催化丝氨酸,三唑部分作为离开基团排出,但是这些化合对其他丝氨酸水解酶也有抑制作用。为了研究三唑杂环在抑制剂活性中的确切作,作者合成了5个DH376抑制剂的衍生物(图2),建立了一种基于替代底物的方法来测定DAGL的三唑脲抑制剂的结合动力学参数和反应活性,并利用分子动力学进一步探讨了结合亲和力的显著差异。
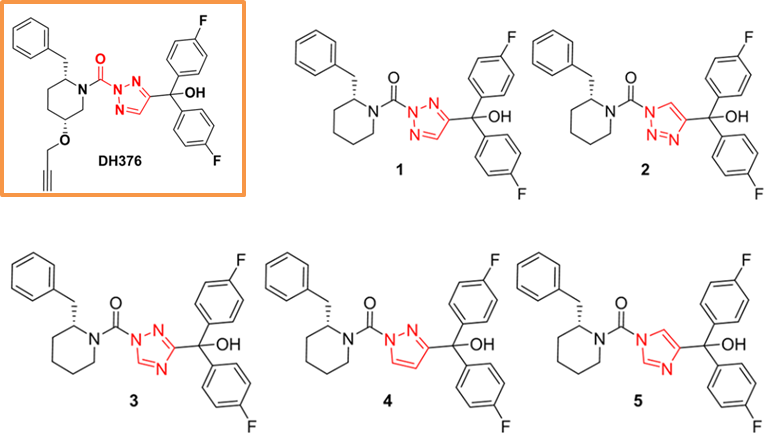
图2. DH376抑制剂及其五个类似物的结构图示
图片来源JMC
结果部分
替代底物的方法测定DAGL的三唑脲抑制剂的结合动力学参数和反应活性的流程和结果如图3所示。1和2均为低纳米摩尔抑制剂,4为中等活性,3和5的活性较差,最出乎意料,3和4三唑3和吡唑4抑制剂与DH376具有差不多活性和失活率,这与Pka的5个数量级差异形成鲜明对比。通过图4的线性关系图可以看出,活性IC50值与Ki和Kinact 有很好的相关性,R2分别为0.73和0.77(图4a,b),并且Kinact 与Pka没有明显的线性关系(图4c),这表明,离去基团的Pka与失活的速率无关。五种抑制剂的IC50值差异较大的主要原因是吡唑和1,2,4-三唑类化合物与1,2,3-三唑类抑制剂的结合亲和力较低。
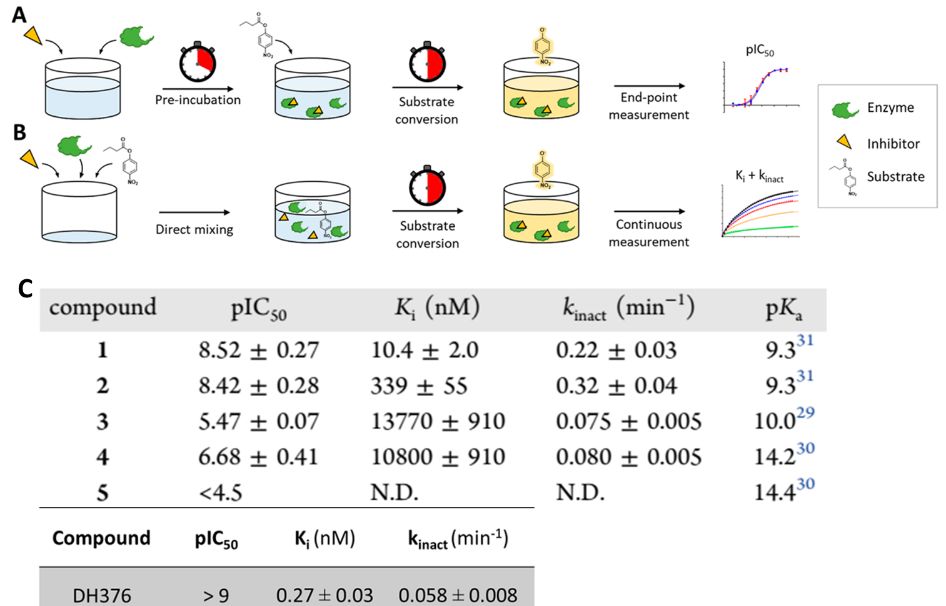
图3. 化合物1抑制剂的结合动力学测定流程图(A-B)和结果C
图片来源JMC
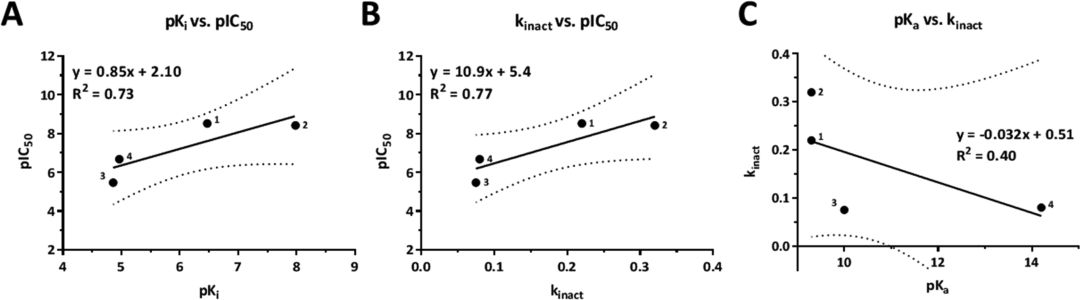
图4. 化合物1抑制剂的结合动力学测定流程图(A-B)和结果C
图片来源JMC
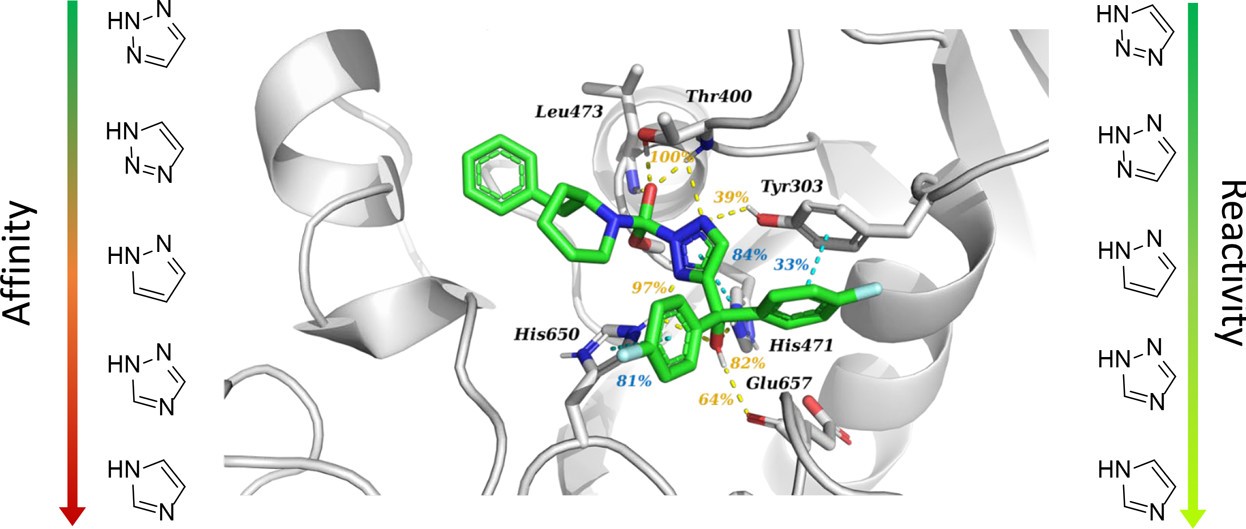
为了进一步了解这种差异背后的原因,通过共价对接手段,将1-5化合物对接到模建的DAGL蛋白受体中,再用分子动力学模拟分析5个复合物的相互作用特征。所有复合物的构象都能很好地在MD模拟中稳定。分析复合物的结合模式(图5),可以发现化合物1和2的高效能主要来源于与His650形成的氢键,而且化合物1还与His471形成稳定的pi-stacking 作用,与Tyr303形成氢键作用;化合物3和5仅通过水桥与His650作用,而且可以观察到三氮唑环发生90度的旋转,完全失去了与His650的相互作用,减弱了与蛋白的结合力,从而活性很小。
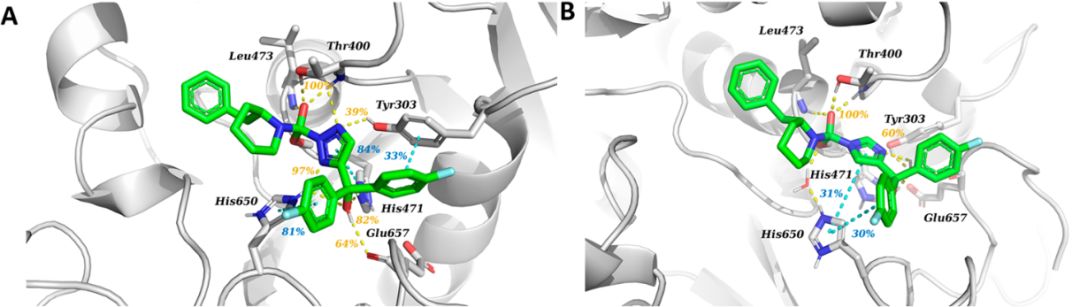
图5.复合物MD模拟的代表性结构结合模式图;高效1,2,3-三唑1(A)和非活性咪唑5(B)。
图片来源JMC
总结
综上所述,本文[1]作者发展了一种动力学方法来研究三唑脲杂环核在共价不可逆的DAGL抑制剂的影响,研究发现,离去基团的Pka与抑制剂的反应性无关,但氮原子在杂环中的位置和数量对其结合亲和力有重要影响,这些发现与模建的DAGL复合物的分子动力学模拟中的观察结果一致。本文结果有望用于指导丝氨酸水解酶不可逆抑制剂的优化。
参考文献:
Janssen, Antonius PA, et al. “Structure Kinetics Relationships and Molecular Dynamics show crucial role for heterocycle leaving group in irreversible diacylglycerol lipase inhibitors.” Journal of medicinal chemistry 62.17 (2019): 7910-7922.