引言
TrmD是一种细菌特异性的甲基转移酶。Mg离子是TrmD的发挥催化活性所必需的,但目前对TrmD结构中Mg离子的位置及其发挥的作用尚不清楚。研究人员通过分子动力学(MD)模拟,确定了酶活性位点合理的Mg离子结合口袋,Mg离子和两个天冬氨酸和一个谷氨酸以及S-腺苷甲硫氨酸(SAM)协调作用。通过实验突变研究验证了计算结果,该研究证明了Mg离子结合残基对于催化活性的重要性。量子力学计算表明,只有当Mg束缚在模拟代表性结构的位置上时,才会发生甲基转移过程,该研究为基于靶向Mg离子结合TrmD 的抗菌药物发现提供了新的策略。

背景
甲基转移反应在多种生理过程中起着至关重要的作用。他们最经常使用甲基供体S-腺苷甲硫氨酸(SAM)进行甲基转移。SAM的甲基是带电荷的moiety部分的一部分,其热力学不稳定,使甲基取代基对亲核试剂具有高度反应性。因此,通常在没有金属离子协助的情况下发生由甲基转移酶催化的甲基转移。即使在需要金属离子的极少数情况下,它们的作用通常也仅限于稳定底物和提高选择性,但不直接参与化学键的实际断裂和形成。例如,这与激酶催化的磷酰基转移反应相反,后者严格要求二价金属离子使ATP的γ-磷酰基相对于底物“在线”取向,以形成正确的催化几何结构。
两个高度保守的氨基酸D169和R154对于TrmD活性展现发挥重要的作用,D169能从G37的N1中提取质子;R154能够和带负电的D37形成稳定的相互作用。但是,由于TrmD晶体结构均不含Mg离子,催化机理的细节仍不清楚,依赖Mg离子的催化过程也难以通过光谱研究,研究人员因此采用分子动力学(MD)模拟和量子力学(QM)结合的计算方法来探究Mg离子与酶的确切结合位置及其在催化中的作用
模拟结果
1:Mg离子在TrmD的活动位点优先结合
TrmD的每个单体都包含两个域(N和C端)和它们之间的柔性连接子。催化三联体嵌入在N末端结构域中(图1)。TrmD与其他甲基转移酶的区别在于,一次仅可操作一个活性位点,每个二聚体仅结合一个tRNA。
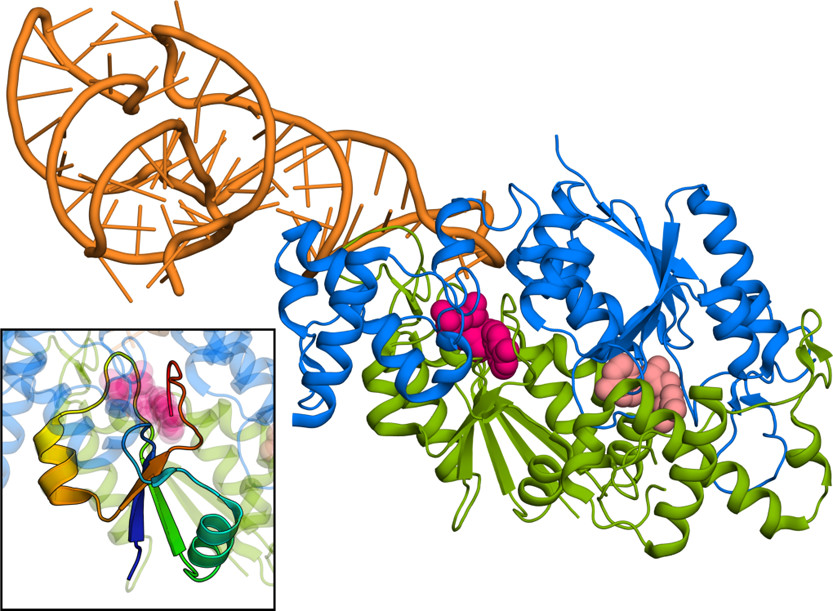
图1. TrmD-tRNA-SFG复合物的晶体结构
图片来源 ACS Catalysis
在模拟中,Mg离子自发地和结合到两个复合物的活性位点,但位置出乎意料。Mg离子和三个酸性残基(E116,D169和D177)的羧基相互作用,而与G37并无相互作用(图2A)。此外,研究人员对TrmD复合物结构进行了类似的模拟,此时体系中没有Mg离子的条件下, Na +离子是溶剂中仅有的带正电的离子。模拟结果表明Na+也经常出现在结合位点。但与Mg离子相比,它可以同时结合两种单体上 (图2B)。尽管在TrmD的晶体结构中未发现Mg离子,但由于Mg离子(和Na +)与水分子之间的电子密度相似,因此存在这样的可能性:被误认为结晶水。实际上,有一些例子表明Mg离子和其他离子被错误地识别为水。 因此,使用表征水分子与周围原子之间相互作用数量的方法,研究人员根据TrmD的X射线结构中研究了结晶水,发现水分子的位置对应于研究人员在MD模拟中确定的Mg离子和Na +的位置(图2 C)。在每种情况下,水都与SAM和酸性残基的羧酸基团接触,这表明它们实际上可能是金属离子。此外,TrmD-tRNA-SFG(PDB ID:4yvi)的晶体结构在配体的蛋氨酸部分附近包含未分配的电子密度(图2 D)。它的位置几乎完全对应于通过上述程序确定的水的位置。因此,结晶水可能是被研究人员一直忽视的与酶结合的金属离子。
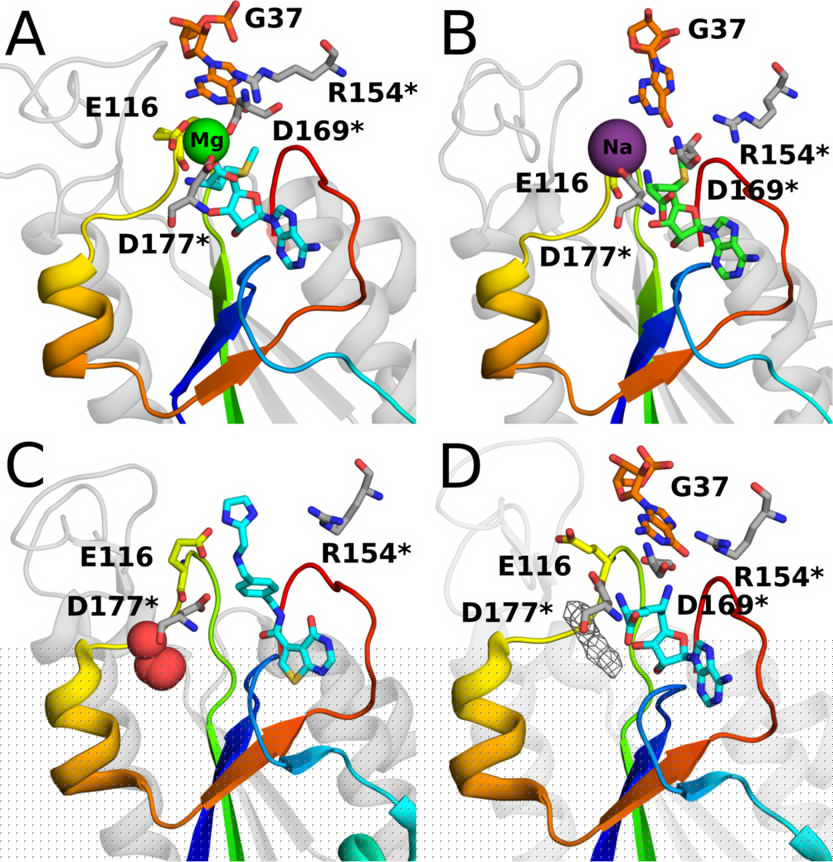
图2. TrmD的活动区域
图片来源 ACS Catalysis
2:Mg离子结合改变活性部位的构象
为了评估Mg离子TrmD的结构,研究人员对复合物进行了10次独立的MD模拟,并从一开始就将Mg离子放置在事先确定的结合位点。在模拟过程中,没有观察到金属离子离开结合位点,因为和周围的负电荷的残基的羧基形成了静电相互作用。模拟表明,Mg离子的存在改变了活性位点的结构。最值得注意的是,D169远离G37,残基之间的距离达到5.5 Å,从而允许水分子存在于两者之间。此外,R154远离G37 的O 6原子, SAM的甲基也远离G37 的N 1原子(图3)。
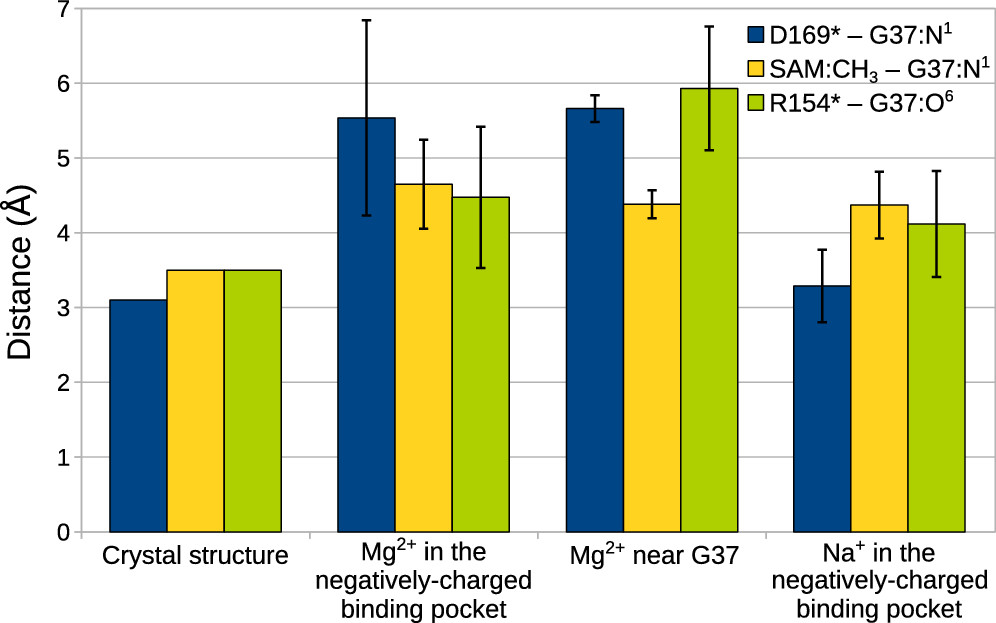
图3. TrmD活性位点的重要距离取决于正离子的存在和位置
图片来源 ACS Catalysis
Mg离子结合的影响超出了活性位点残基位置的改变。TrmD与SAM的二元复合物的模拟表明,Mg离子对于促使甲基供体形成弯曲的构象也至关重要。尽管在没有tRNA的情况下,SAM的甲硫氨酸部分在活性位点相当灵活,在开放构象和弯曲构象之间转移,但其通过羧酸酯基与Mg离子配位稳定了弯曲结构。相反,当存在的是Na +时无法形成这种稳定作用,而Na +在模拟中大大促进了开放构象(图4)。因此,Mg离子通过影响SAM的构型来影响催化的过程。由于开放和弯曲构象之间的转换,研究人员探究了Mg离子结合改变了这两种状态下SAM结合的能量。研究人员分析了TrmD中SAM处于开放状态和弯曲状态的氢键网络,发现两个状态中氢键的数目大致恒定,这与先前观察到的Mg离子结合不影响SAM对酶的亲和力一致。但是,研究人员观察到两种状态的氢键类型不同,反映了它们之间的差异。例如,SAM中甲硫氨酸部分的氨基与D177 *的羧酸根之间的氢键对弯曲形式具有特异性,而R154 *与SAM的羧基之间的氢键则对开放形式具有特异性 。因此,Mg离子结合甚至在tRNA结合之前就将甲基供体约束为弯曲构象。
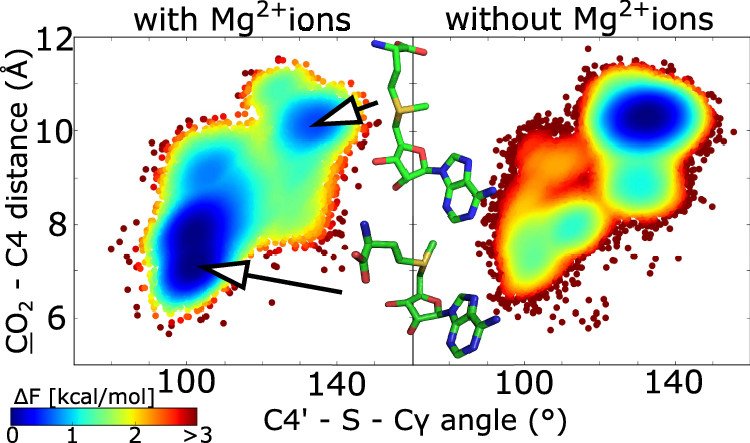
图4. 包含镁离子(左图)和不包含(右图)时全酶模拟时,SAM构象空间的自由能势能面
图片来源 ACS Catalysis
3:量化(QM)计算
MD模拟的结果显示,Mg离子优先结合到活性位点的带负电荷的口袋,该口袋由E116,D169 *,D177 *和SAM的羧酸盐组成。研究人员从MD模拟中为金属离子的这个位置选择了8个不同的代表构象,并使用它们来构建用于QM计算的活动位点模型。在能量上最有优势的模型(就能垒高低而言)由9个氨基酸(P58,G59,E116,V137,L138,T139,R154 *,D169 *,D177 *),SAM,G37和五个水分子组成(总共194个原子)。在初始构型中,Mg离子通过D169 *,D177 *和SAM的羧酸盐的氧原子和三个水分子进行配位,并在整个反应步骤中保持排列。在该模型中,D169 *与G37 的N 1质子通过桥接的水分子相互作用。质子从G37 的N 1转移到D169 *的羧酸盐的能垒为8.5 kcal / mol(TS1,图5)。最终的中间结构是优化过程中的最小能量,在进行零点能量(ZPE)校正后,该中间结构比先前的过渡状态提高了约1 kcal / mol 。质子转移后,质子化的D169 *离开G37,与SAM的羧酸基团形成氢键。在O 6原子产生的负电荷被R154 *稳定,R154 * 在此阶段通过氢键和堆积与核碱基直接相互作用。
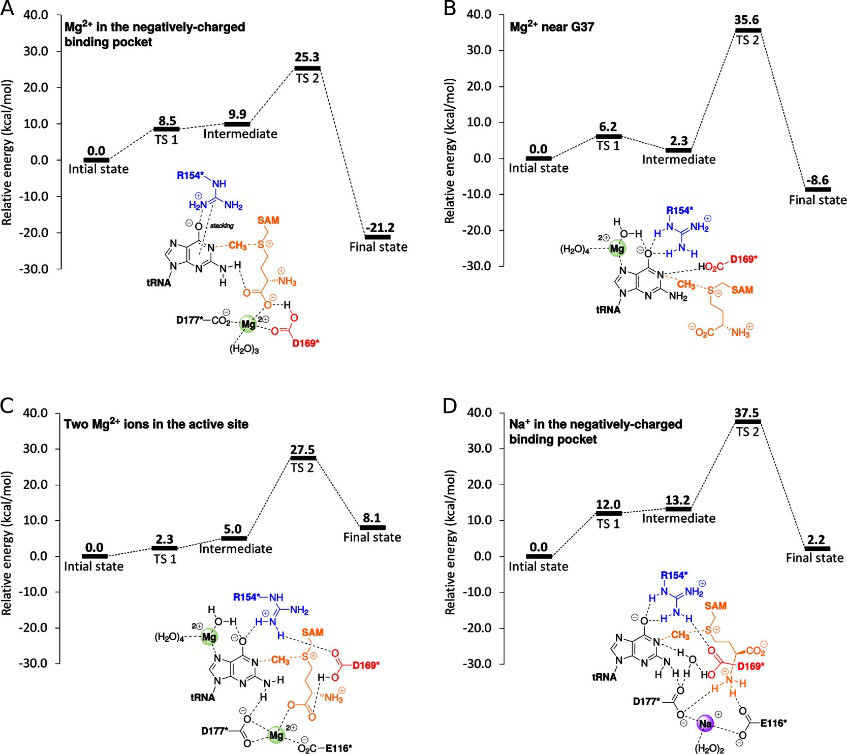
图5. 取决于金属离子位置的甲基转移反应通路能量图
图片来源 ACS Catalysis
结论
使用MD模拟和QM计算的组合方法,研究人员研究了Mg离子的结合位点,并揭示了其催化潜力。在MD模拟中,Mg离子优先与带负电荷的口袋中的酶的活性位点结合,并诱导催化氨基酸残基和SAM甲基供体的构象变化。QM计算证明,只有在Mg离子结合获得的几何形状中,活性位点才具有催化作用。这些结果还通过实验性突变研究得到了验证,该研究证明了Mg离子的重要性-结合残基用于催化活性。从方法论的角度来看,这项工作也很重要。它提供并验证了一种策略,该策略整合了MD模拟和QM计算各自的优势,来研究Mg离子依赖的反应,其中难以用光谱学方法研究金属离子常常掩盖了对催化机理的认识。
参考文献
Agata P. Perlinska, Marcin Kalek,* Thomas Christian, Ya-Ming Hou,* and Joanna I. Sulkowska*, Mg2+-Dependent Methyl Transfer by a Knotted Protein: A Molecular Dynamics Simulation and Quantum Mechanics Study. ACS Catal. 2020, 10, XXX, 8058–8068