
引言
AZD9291也称为奥希替尼, 是治疗非小细胞肺癌(NSCLCs)的三代靶向药,对具有T790M介导耐药性的表皮生长因子受体(EGFR)突变的非小细胞肺癌具有高度的疗效。尽管AZD9291作为“明星”产品,但由于与EGFR T790M突变激酶的结合方式尚未确定,所以关于AZD9291对T790M突变体的耐受性和优先结合机制仍不明确。在这里,作者采用分子动力学(MD)模拟,观察到AZD9291可与T790和T790M突变体的EGFR激酶自发结合。模拟生成的结构模型表明,AZD9291与T790M的结合模式与T790不同,AZD9291与T790M中的门控残基(Met790)形成范德华相互作用,而与T790中的Thr790没有相互作用,这解释了AZD9291与T790M的结合具有更高的亲和力。最后实验测定的AZD9291与EGFR T790M复合晶体结构和MD模拟生成的模型是一致,进一步验证了MD模拟的结果的可靠性。作者认为,结合模式上看似微小的差异,可能会产生实质性的影响,因此了解AZD9291选择性的结构基础可能会大大有助于此类新药的开发。
先睹为快
作者信息
北京大学基础医学院生物物理系云彩红教授
David E. Shaw Research Group的单一兵教授和David E. Shaw
靶点
EGFR L858R (简称T790)、EGFR L858R/T790M (简称T790M)
计算方法
分子动力学模拟(MD simulations)
计算流程
为了研究AZD9291与EGFR激酶之间的相互作用,作者对AZD9291与T790M和T790的自发结合过程进行了无偏MD模拟。MD模拟从未结合态开始,将三个AZD9291分子任意放置在模拟系统中。每个体系都平行跑了17个模型,时长均为10µs。通过对MD轨迹的分析,探究AZD9291与EGFR的相互作用特征。
AZD9291与EGFR T790M的结合机制研究
为了研究AZD9291与EGFR激酶之间的相互作用,作者对AZD9291与T790M和T790的自发结合过程进行了无偏MD模拟(图1a)。MD模拟都是从未结合态开始,将三个AZD9291分子任意放置在模拟系统中。作者首先模拟了AZD9291与T790M的结合,在17个独立的时长10µs模拟中,观察到8个结合状态(图1d)。如图1c, 其中有4个模拟轨迹中,AZD9291分子呈现稳定的翻转构象(flipped),即吲哚的苯环指向门控残基。其他4个体系,AZD9291以未翻转的方式(un-flipped)结合,类似于之前报道的晶体结构。两种构象的相同点在于都维持了AZD9291与Met 793的“铰链”氢键,不同之处在于,在翻转构象下,吲哚部分旋转约180°,使得吲哚的苯基指向Met 790的侧链。接着作者模拟了AZD9291与T790的结合,同样进行17个独立的10µs模拟,8个AZD9291分子达到了稳定的结合状态。模拟结果显示,在这8个结合状态中,有7个是未翻转的状态(图1c)。
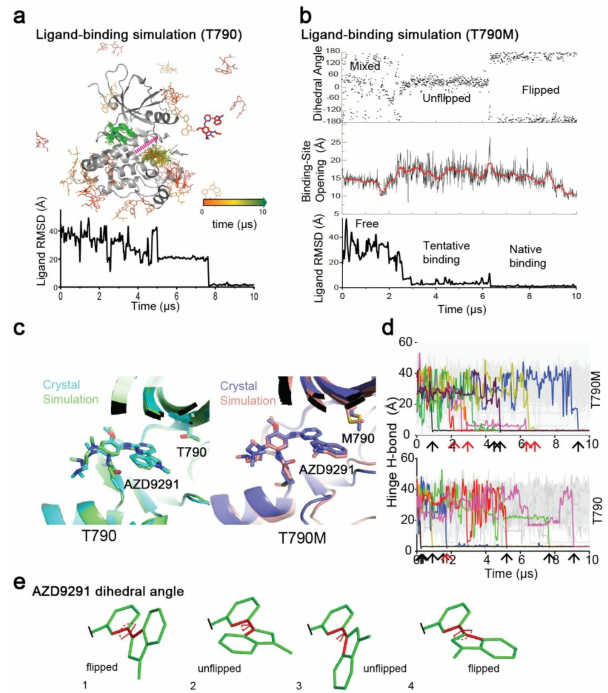
图1. AZD9291与T790和T790M的 MD模拟结果
图片来源于JMC
进一步分析结合过程,AZD9291首先以非翻转构象进入结合位点,进入结合位点后,AZD9291和结合位点的构象均出现明显波动,当AZD9291采用翻转构象后,波动开始减弱(图1b)。AZD9291在进入结合位点并接近Met790后,采用翻转构象的事实表明,T790M通过与AZD9291在结合过程中相互作用来诱导翻转姿势。并且,翻转构象可为自由能(~0.4 kcal mol−1)提供有利的熵贡献。同时,作者发现AZD9291对EGFR的不同结合模式,不仅可以稳定复合物结构,还促进了共价键的形成。作者测量了Cys797的巯基和AZD9291弹头之间的距离(图2),来衡量共价键形成的效率,结合模式中翻转构象中的距离明显小于未翻转构象(分别小于4 Å 和7 Å),说明翻转构象促进了共价键的形成,更有利于米氏复合物的形成。
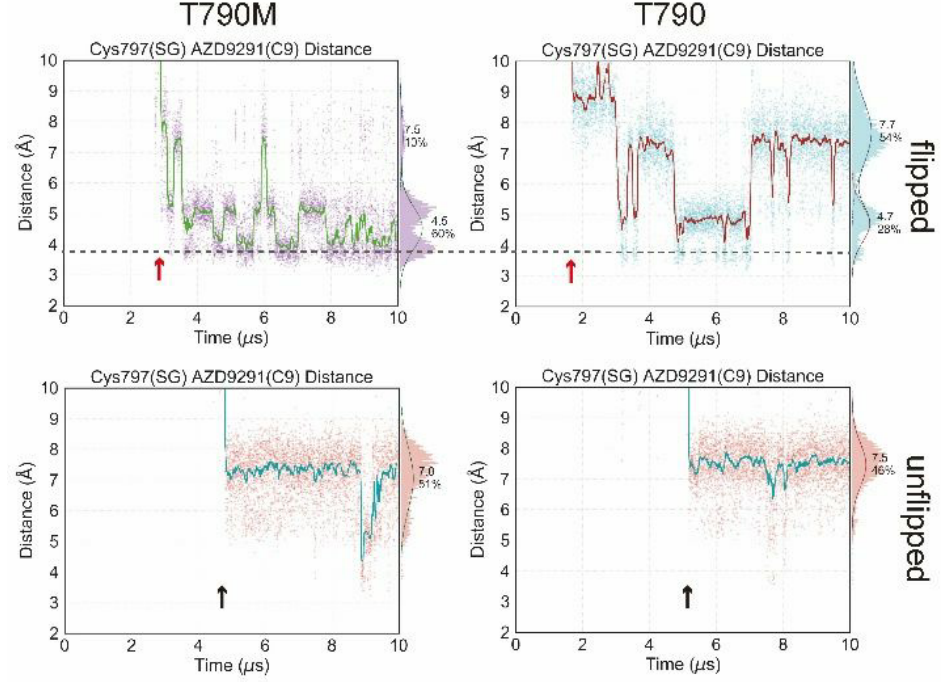
图2. MD模拟过程中AZD9291的弹头与Cys797(SG)的距离分布
图片来源于JMC
最后,作者通过实验测定EGFR T790M与AZD9291的复合晶体验证了MD模拟生成的结构模型的可靠性。AZD9291在这种共晶结构中采用的翻转构象与MD模拟中采用的翻转构象相同,此时,吲哚和Met 790侧链之间有利的范德华相互作用可能比未翻转的姿势更强,如图3a所示。值得注意的是,在T790/AZD9291结构中,虽然α C-out的非活性构象在ATP结合位点产生了一个更大的口袋(相对于EGFR的α C-in活性构象),理论上很容易容纳吲哚的翻转,但AZD9291仍然保持未翻转的结合模式(图3b)。这一观察结果再次表明,AZD9291的翻转构象是由T790M中Met790侧链与AZD9291的吲哚基团相互作用引起的。T790M/AZD9291中的EGFR激酶采用了在以前晶体结构中未观察到的独特构象(图4),在这种结构中,C-螺旋是扭结的(kinked),螺旋的N-端半部分(残基753-759)从螺旋的αC-in位移了4-7Å,而其余的C-螺旋(残基760-768)保持αC-in的位置;A-loop的部分残基(残基867-872)形成了一个与N-lobe密切相关的短螺旋(图4c)。尽管具有独特的C-螺旋构象,T790M/AZD9291的整体构象与EGFR的活性构象(图4a,黄色)比非活性构象(图4b,青色)更为相似。
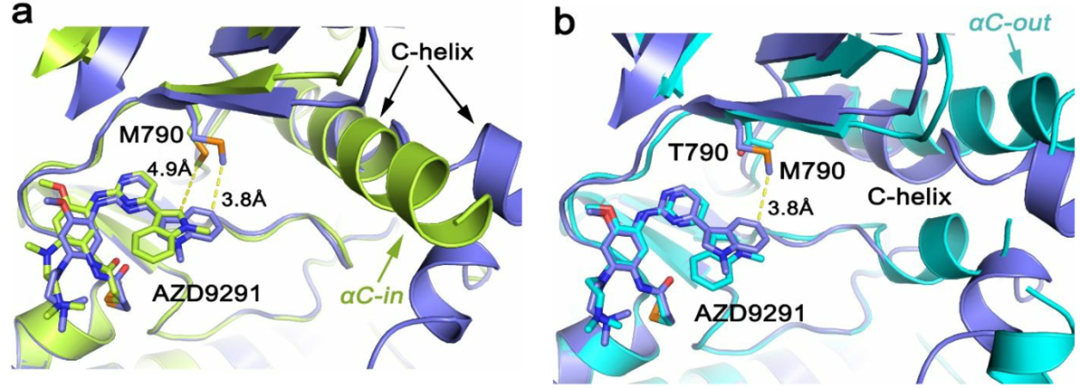
图3. AZD9291在复合晶体结构中的结合模式示意图
图片来源于JMC
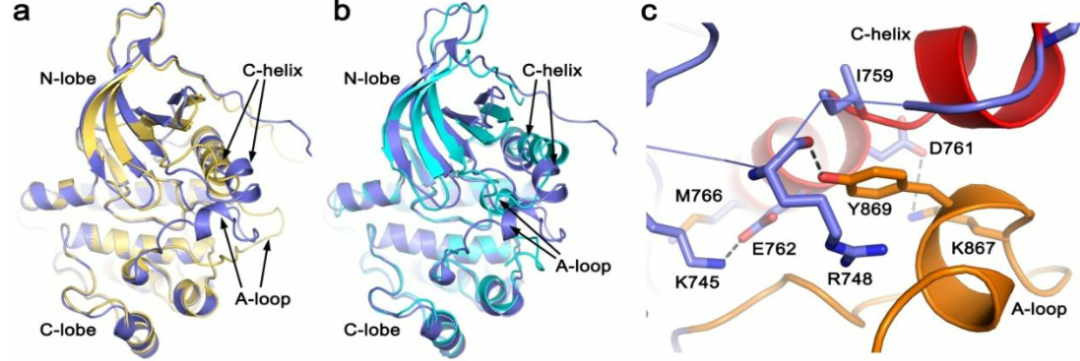
图4. T790M/AZD9291中EGFR激酶的独特C-螺旋构象
图片来源于JMC
结论
在这项工作中,作者通过MD模拟和X射线晶体学共同揭示了AZD9291与EGFR激酶T790M突变体的一种先前未知的结合模式。结果可以总结为以下三点:
(i)当AZD9291与EGFR T790M结合时,与野生型EGFR(Thr 790)结合模式相AZD9291倾向于采用另一种结合构象,即吲哚旋转约180º。
(ii)AZD9291以翻转构象与T790M结合时,增加了化合物与Met 790之间的范德华相互作用,可能使其对T790M具有更高的亲和力。
(iii)AZD9291与T790M的翻转结合模式,使化合物的弹头(丙烯酰胺)更接近EGFR 的Cys 797侧链,可能促进化合物与EGFR之间共价键的形成。
参考文献
Xiao-E Yan, et al. Structural Basis of AZD9291 Selectivity for EGFR T790M. J. Med. Chem.(2020).