背景介绍
细胞凋亡是细胞内重要的生理过程,这一过程能够帮助维持细胞稳态和代谢平衡。BAX蛋白是Bcl-2家族的促细胞凋亡成员,它通过引起线粒体外膜的透化来触发细胞凋亡,当细胞质中的BAX被BH3-only蛋白激活后便会释放凋亡信号因子,从而使细胞凋亡。然而目前为止,BAX蛋白的激活机制尚不清楚,它与激活剂的结合模式也只能通过简单的分子对接工作来进行探究,因此目前缺乏对BAX蛋白激活机制的深入了解,这大大阻碍了更有效的BAX激活剂的开发。在前人的基础上,本篇文章通过分子动力学模拟对BAX蛋白表面的潜在结合位点以及相关激活剂与其相结合的结合机制进行了探究。
主要内容
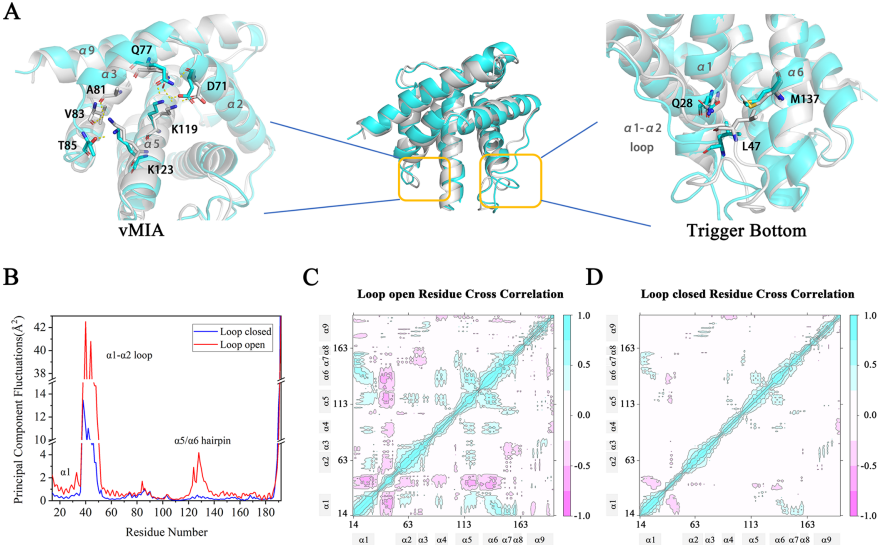
上海复旦大学药学院王任小团队通过50微秒的分子动力学模拟对BAX蛋白表面潜在的结合位点及其激活机制进行了研究。分子动力学模拟揭示了BAX蛋白潜在的多种结合位点,这与相关的实验结果相吻合,由此证明了BAX蛋白结构的复杂性。文章选择了三种BAX激活剂(BAM7、BTC-8和BTSA1)作为研究对象。为了实现更完整的采样,这三种BAX激活剂与BAX蛋白结合的分子动力学模拟以并行的方式在BAX上的三个主要结合位点(trigger位点、S184位点和vMIA位点)上进行模拟。此外,分子动力学模拟还揭示了几个神秘的口袋,比如trigger位点的底部口袋和vMIA位点的内部口袋。分子动力学模拟结果表明BAM7激活剂和BTSA1激活剂可以进入trigger底部口袋,从而增强α1-α2 Loop的运动,这可能是BAX激活的关键因素。此外,基于结构的研究还表明在α9-截断的BAX结构上可以清晰地观察到典型的疏水凹槽,这也得到了相关实验结果的证明,表明BAX的完全激活可能需要两个位点的参与。本文相关的研究成果以“Analysis of the Binding Sites on BAX and the Mechanism of BAX Activators through Extensive Molecular Dynamics Simulations” 为题发布在计算信息学期刊J. Chem. Inf. Model.上。
图表汇总
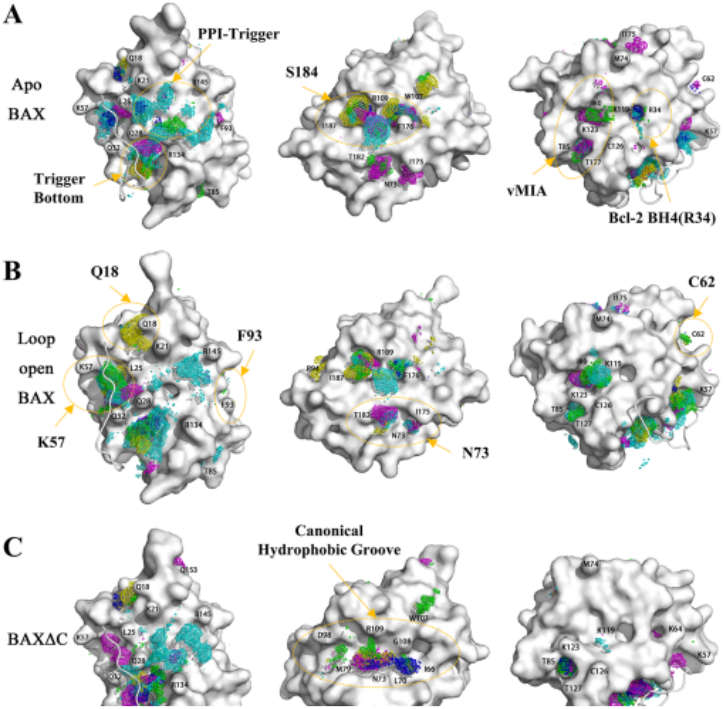
图 1. apo BAX、Loop-open BAX和BAXΔC的分子动力学模拟结果。图片来源于JCIM

表 1. BAX 上结合位点的MixMD排名结果。表格来源于JCIM
本文选取具有代表性的BAX蛋白采用并行的动力学模拟方法对其与激活剂分子相互作用机制进行了研究,在BAX蛋白上的三个主要结合位点处进行了50微秒的分子动力学模拟探索它们在早期激活阶段与BAX激活剂的可能结合模式。此外,该文章基于结构的晶体结果可以作为指导以发现更有效的小分子BAX激活剂,同时该文章的分子建模结果也可为进一步探索BAX激活机制、发现更有效的BAX激活剂提供帮助。
参考文献
Guoqin Feng, Xiangying Zhang, Yan Li, and Renxiao Wang,Analysis of the Binding Sites on BAX and the Mechanism of BAX Activators through Extensive Molecular Dynamics Simulations, J. Chem. Inf. Model., 2021, ASAP. DOI:10.1021/acs.jcim.0c01420.