
引言
Toll样蛋白(TLRs)是一类分子模式识别受体,是天然免疫系统的一部分。他们识别特定的感染分子,并启动有效的免疫反应。TLR7和TLR8均位于内体膜处,可识别内体腔内富含胍/尿苷的单链RNA(ssRNA)。TLR7主要在浆细胞样树突状细胞(PDCS)和B细胞中表达,而TLR8则在单核/巨噬细胞和中性粒细胞中表达。在自身免疫性疾病,如系统性红斑狼疮(SLE)或干燥综合征,有广泛的免疫细胞参与。因此,有效的双TLR7/8拮抗剂可作为治疗此类疾病的一种方法。
先睹为快
作者及单位
诺华生物医学研究中心Thomas Knoepfel
研究靶点
Toll样蛋白7、8
计算方法
分子对接
计算软件
Glide
计算流程
作者首先通过高通量筛选的方法在时间分辨荧光共振能量转移(TR-FRET)下选取竞争性效果高于荧光标记物2的化合物,随后选取活性较好的3号化合物,结合分子对接计算结果以及比较TLR7蛋白与TLR8蛋白结构差异,对3号化合物进行改造优化,最后结合对接模型以及SAR研究对先导化合物三个位置优化改造,最终发现了化合物27为最有效的TLR7/8双靶点拮抗剂。
高通量筛选及基于结构的药物设计
作者通过时间分辨荧光共振能量转移(TR-FRET)法对诺华化学数据库近5万小分子进行筛选,这些化合物与荧光探针2在20μM下比较竞争能力,在剂量反应实验中确定了大约1500个化合物的效价。基于外周血单细胞(PBMCs)环境,对1500个化合物进行分析,吡啶酮化合物3被认为具有较好的结合效果。将化合物3对接于TLR8结构域,化合物3的吡啶酮羰基与Gly351的骨架NH形成关键氢键,喹唑啉核心位于口袋的疏水部分,与Phe455和Phe454侧链面对面接触。同时模型显示了一个由残基PHE346、Tyr348和Val378的侧链定义组成的疏水腔。4号化合物在喹唑啉的8位上接入甲基使得对TLR8的竞争性加强,但发现对TLR7的竞争性减弱。作者将TLR8和TLR7蛋白叠合确定与TLR8蛋白中的Glu427作用为主要影响因素。因此,将4号化合物中的喹唑啉改为吲哚环,5号化合物整体缩小,末端不能与Glu发生作用。同时吲哚环避开了TLR7中的Ser531空间位阻影响。化合物5在PBMCs中对TLR4和TLR9同样存在较好的拮抗作用,作者分析认为是非目标效应引起的。吡啶酮上的甲基被认为是影响这一效应的关键,于是对吡啶酮上的甲基进行改造。最后认为化合物8具有等效TLR7/8拮抗作用。
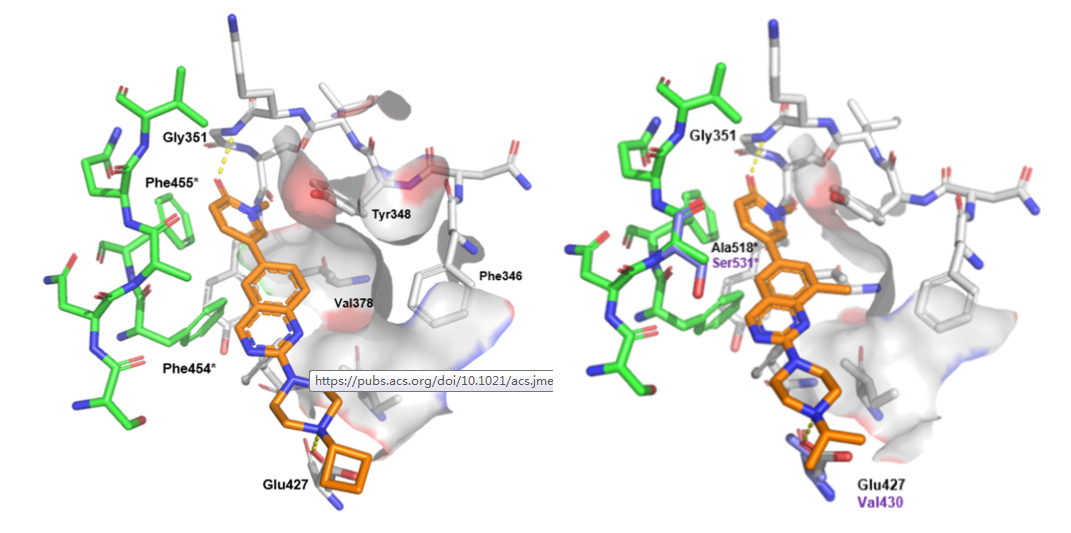
图1. 化合物3与TLR8作用方式图;化合物4与TLR7/8作用方式图
图片来源JMC
先导化合物的优化改造
在先导化合物8的基础上,作者对先导化合物结构上的三个区域(R、R,和R,,)进行优化设计。在吡啶酮位置上(R),结合模式显示吡啶酮的6位甲基存在一定空间限制。作者认为在5,6位置上接入环,在二重环的约束下使得6位有轻微的缩小从而更适合口袋。吲哚环上7位的取代(R,)对拮抗剂效果有着重要的影响,三氟甲基与甲基的引入会增强拮抗效果。位于结合口袋暴露于溶剂部位的哌啶位置(R,,),作者认为该位置的改造对提高活性并没有很直接的作用。对于哌啶位置通过引入氟或芳构化调节pKa研究酸碱度对活性影响。
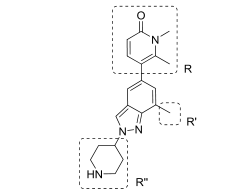
图2. 先导化合物改造优化图
图片来源JMC
活性验证
通过对先导化合物的设计,优化后的化合物27是一种在人PBMCs和血液中具有很强作用的双TLR7/8拮抗剂。此外,化合物27对其他人类TLR亚型和IL1R驱动的细胞因子通路的选择性很强,总选择性谱>1000倍。化合物27在小鼠和人肝微粒体中具有良好的理化性质以及在体外ADME谱,具有良好的溶解度、被动通透性和低清除率。各组动物口服不同剂量的化合物27,两小时后从循环中测定IFNα蛋白质和化合物水平,并显示剂量依赖性抑制INFα释放。这些数据与化合物27在小鼠血液中的体外疗效一致,IFNα抑制作用IC50=180nM。这些结果表明,化合物27是一种有效的TLR7通路抑制剂,有进一步发展成为TLR7/8双重竞争性抑制剂的潜力。
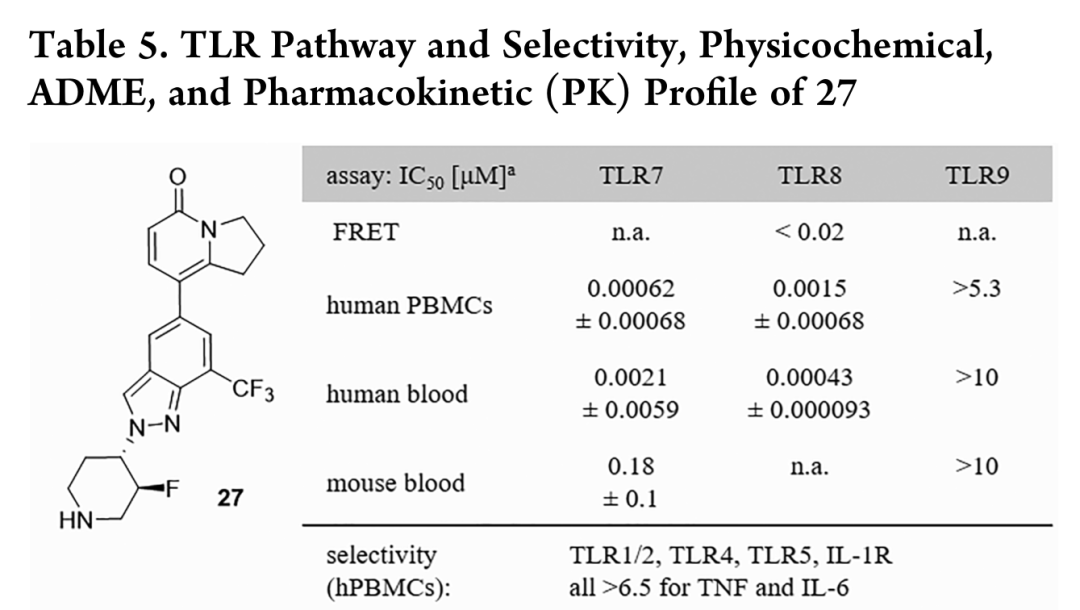
图3. 设计优化的TLR7/8双重拮抗剂
图片来源JMC
参考文献
Knoepfel T, Nimsgern P, Jacquier S, et al. Target-Based Identification and Optimization of 5-Indazol-5-yl Pyridones as Toll-like Receptor 7 and 8 Antagonists Using a Biochemical TLR8 Antagonist Competition Assay. J Med Chem. 2020;63(15):8276-8295. DOI: 10.1021/acs.jmedchem.0c00130