

抑制 PPARγ Ser273 磷酸化但缺乏经典 PPARγ 激动作用的化合物已成为更安全的抗糖尿病疗法。通过虚拟筛选发现了化合物10,实验证实它是一种有效的 PPARγ 结合剂和 CDK5 介导的 PPARγ Ser273 磷酸化的体外抑制剂。
背景
噻唑烷二酮类(TZDs)PPARγ 激动剂如罗格列酮和吡格列酮是有效的降糖药,但受副作用影响限制了它们的使用。其正向抗糖尿病作用主要是通过抑制CDK5 介导的 PPARγ Ser273 磷酸化,而副作用与经典的 PPARγ 激动有关。完全激动剂(如TZDs 1和2)激活PPARγ的机制为PPARγ配体结合域(LBD)远端羧基末端螺旋12 (H12)组成的分子开关。通常情况下,一个TZD、羧基或配体的其他极性部分与Ser289 、His323、 His449,和Tyr473形成氢键,从而介导H12的稳定使其能结合H3和H11并形成共激活-结合位点的关键部分,称作AF2表面。相反,部分PPARγ激动剂与PPARγ配体结合口袋的一个区域结合,这个位置远离 H12 并激活受体变构,独立于与H12的直接相互作用。因此,这些激动剂会有较低程度的H12稳定作用,这被认为导致辅因子的不同招募,从而影响活化受体配体复合物的转录谱。
阿斯利康公司通过虚拟筛选发现的化合物10在报告基因测定实验中显示出可忽略的PPARγ 激动。并且其药代动力学特性与口服给药相容,可以进行临床前体内试验,7天的治疗表明ob/ob糖尿病小鼠模型的胰岛素敏感性有所改善。
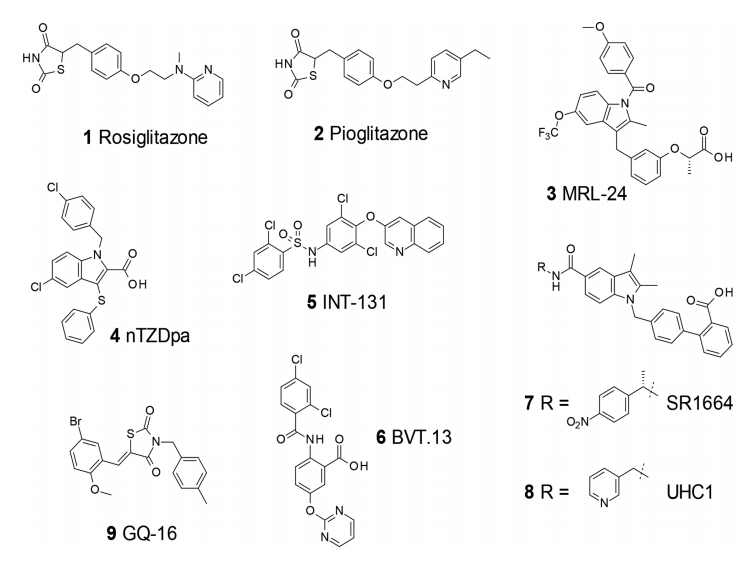
图1. 代表性 PPARγ 配体:完全激动剂(1 和 2)、部分激动剂 (3-6) 和 PPARγ 磷酸化抑制剂 (7-9)。 图片来源:ACS Med. Chem. Lett.
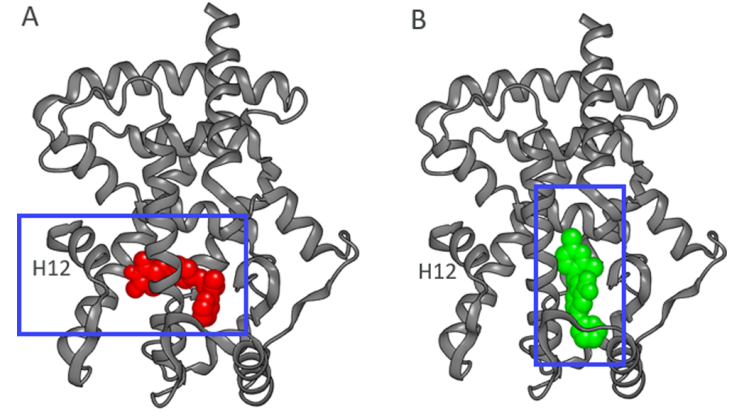
图2.完全激动剂1(红色,A图)和部分激动剂6(绿色,B图)与PPARγ LBD复合体的空间填充模型。 图片来源:ACS Med. Chem. Lett.
研究团队在靶点验证实验中,观察到了之前发现的化合物SR1664 7在ob/ob 小鼠中不耐受,因此试图找出结构上不相关的、具有最小的 PPARγ 激动作用的PPARγ Ser273 磷酸化抑制剂。
基于完全激动剂相互作用并稳定AF2区域而部分激动剂则没有的假设(这导致与完全激动剂相比AF2表面构象稳定性的降低),作者进行了筛选。针对部分PPARγ激动剂4和6所占据的形状和体积进行虚筛。这两个配体符合不与AF2区相互作用的标准,而是占据了靠近β片的结合袋的远端部分。此外,通过占用结合口袋的非重叠体积,它们增加了被探测口袋的体积,从而增加了潜在命中率。
虚筛在阿斯利康公司的数据集上进行,首先使用快速3D shape-based对接软件FRED,随后使用更准确的对接算法软件Glide SP。由Glide分数排名结合目测检查,选择2943个化合物进行单次重复浓度-反应测试,使用人PPARγ时间分辨荧光能量转移(TR-FRET)结合实验和PPARγ报告基因激动剂实验。
201个化合物被认为有活性(PPARγ结合亲和力<1 μM, PPARγ激动效率<25%),命中率为7%。进一步使用内部衍生模型对物理化学和DMPK(药物代谢和药代动力学)特性进行计算机分析,挑选得到化合物10,其代表了一类新型的PPARγ调节剂。化合物10对人PPARγ结合亲和力为24nM,但在<10μM的浓度下对PPARγ无激活性(表1和图3)。

表1. PPARγ化合物的体外活性。表格来源:ACS Med. Chem. Lett.
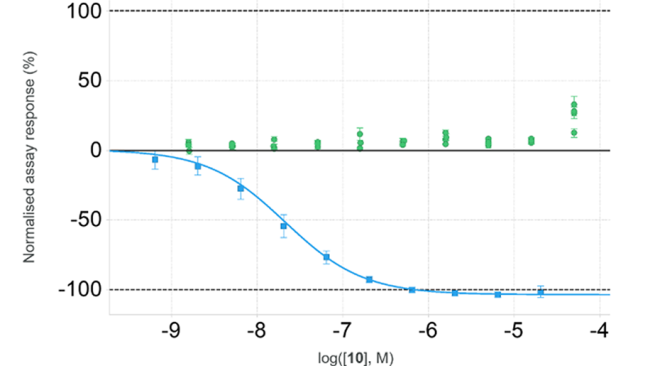
图3. 人PPARγ 中 10 的浓度-反应数据。图片来源:ACS Med. Chem. Lett.
随后团队评估了化合物10抑制CDK5介导的全长人PPARγ Ser273磷酸化的能力。化合物10是PPARγ Ser273磷酸化的抑制剂,且其效率大于化合物1和7(表1),化合物1则以浓度依赖性的方式抑制该活性。而在两个单独的体外实验中,10被证明不抑制CDK5激酶的活性。
为了进行进一步表征,作者重新合成了10,10的体外特性与虚筛结果一致。为了进一步确证化合物10是以与其他PPARγ部分激动剂类似的方式结合,而且没有与H12形成激动剂最常见的相互作用,作者解析了一个分辨率为2.2 Å的10与PPARγ结合的复合物x射线晶体结构。
令人满意的是,对于选择的虚筛策略,PPARγ LBD-10的复合物整体结构与对接构象一致,并且化合物10以良好的形状互补性满足了关键药效团要素(图4)。结构中,10结合在与H12相距较远的位置,符合其非常低的激动剂活性水平。它还与Ser370的主链NH形成了氢键,这种相互作用被许多PPARγ部分激动剂利用。
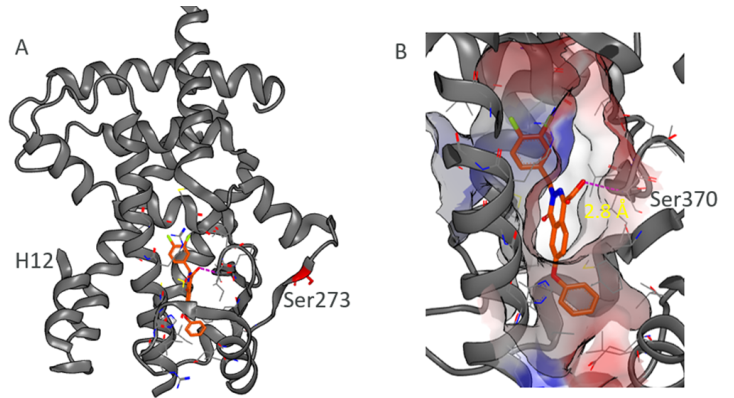
图4. 化合物10与PPARγ LBD的复合物晶体结构。 图片来源:ACS Med. Chem. Lett.
与x射线晶体结构和化合物10中可忽略的PPARγ激动现象一致,没有配体介导的H12稳定性在差异HDX-MS实验中被发现(图5)。与化合物10直接相连的结合域的稳定性(H3, H5的C端,β片)被观察到,同时观察到H2,H7和含有Ser273的H2−H2 ‘环在更长范围的稳定。与10相比,7诱导H2-H2’环的稳定性较差,这与其较低的pS273抑制效价相关。
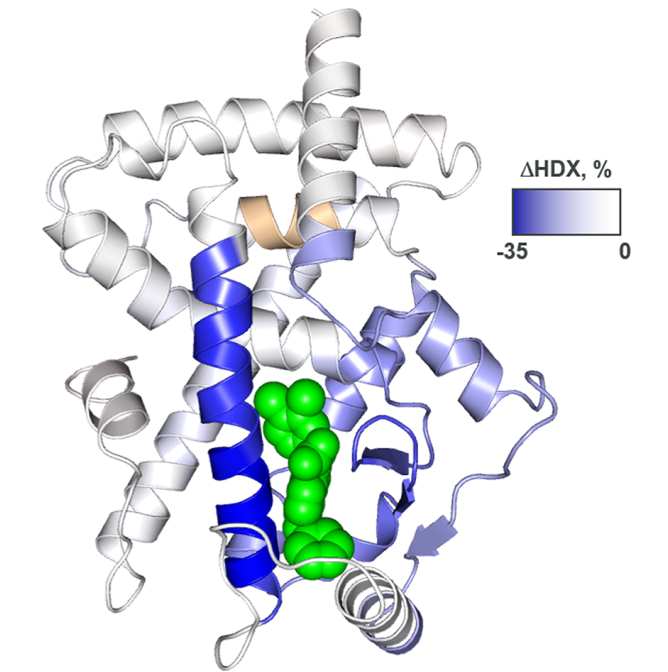
图5. 化合物10诱导的PPARγ LBD稳定性的差异HDX-MS数据。 图片来源:ACS Med. Chem. Lett.
明确了10具有所寻找的体外特征后(即,强效的PPARγ结合,最小的PPARγ激动和抑制PPARγ Ser273磷酸化),作者继续在ob/ob糖尿病小鼠模型中对该化合物进行分析(图6)。一份全面的二级药理学分析显示,在持续的临床前分析中,没有发现考虑停止临床实验的因素。体内药代动力学(PK)分析(100 μmol /公斤,口服灌胃给药)在野生型的C57 / BL6小鼠上进行,化合物表现出良好的口服生物利用度(109%)和总Cmax(167μM)和合理t1/2 (5 h)。ob / ob糖尿病老鼠研究使用两个剂量组的化合物10和阳性对照化合物1(10和100μmol/公斤/天,口服灌胃给药)和赋形剂对照和野生型对照。
给药7天后,两组均显示预期的空腹血糖和胰岛素水平正常化,与空白组相匹配(图6A,B)。相比之下,化合物10对葡萄糖和胰岛素的影响较为温和,只有100 μmol/kg剂量组血浆胰岛素水平显著下降,并有血糖降低的趋势,表明胰岛素敏感性整体提高。在这些条件下,1和10的耐受性都很好,不影响体重(图6C)。
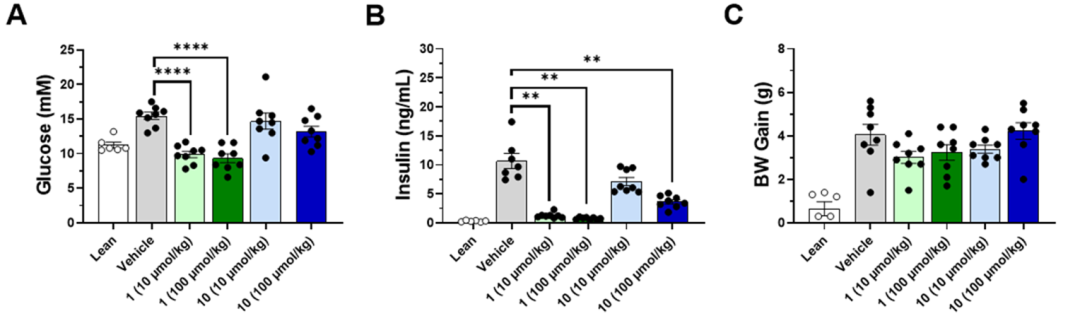
图6. 10对ob/ob小鼠糖尿病模型的体内药效学作用。 图片来源:ACS Med. Chem. Lett.
结论
本文通过虚筛发现了一种新型的、高亲和力的PPARγ结合剂,它具有最小的PPARγ激动作用,并显示出对CDK5介导的独立的全长PPARγ磷酸化的体外抑制作用。化合物10具有可接受的体内给药PK,在ob/ob小鼠实验中能温和改善胰岛素敏感性,这可作为进一步开发新型胰岛素增敏剂治疗代谢紊乱的起点。
参考文献
O’Mahony, Gavin & Petersen, Jens & Ek, Margareta & Rae, Rebecca & Johansson, Carina & Jianming, Liu & Prokoph, Nina & Bergström, Fredrik & Bamberg, Krister & Giordanetto, Fabrizio & Zarrouki, Bader & Karlsson, Daniel & Hogner, Anders. (2022). Discovery by Virtual Screening of an Inhibitor of CDK5-Mediated PPARγ Phosphorylation. ACS Medicinal Chemistry Letters. 10.1021/acsmedchemlett.1c00715.