引言
Varkud卫星核酶(VS)是已知的最大自裂核酶,也是最大的内切核酶。它存在于自然分离的Neurospora线粒体中,能将多聚体与核糖核酸特异性地切割成线性单体。自从近三十年前被发现以来,VS核酶一直是众多实验研究的主题。作者采用实验与计算相结合的方法,建立了VS催化动力学模型,扩展和统一了已有的实验数据,明确了催化构型,揭示了过渡态稳定的模式。这些发现拓宽了我们对RNA催化策略多样性的机制理解。

先睹为快
单位与作者
新泽西州立罗格斯大学Darrin M. York教授,
芝加哥大学Joseph A. Piccirilli教授
研究靶点
VS核酶突变体的高分辨率晶体结构(PDB IDs:4R4P,4R4V,5V3I)
计算方法
分子动力学模拟(Molecular Dynamics (MD) Simulations)
3D-RISM溶剂化模型计算(3D-RISM calculations)
量子力学/分子力学自由能模拟(QM/MM free-energy simulations)
计算软件
AMBER18,AmberTools 15
计算流程
首先将VS核酶突变体的晶体结构(PDB IDs:4R4P,4R4V,5V3I)修改为相应的野生型核酶。接下来,在AMBER18软件对三个VS核酸结构进行5000ps的经典MD模拟。通过3D-RISM溶剂化模型计算,预测金属Mg2+结合位点。最后用量子-经典力学组合方法计算了催化反应的自由能,阐述VS核酶的催化机制。
Varkud卫星核酶
Varkud卫星核酶(VS)是已知的最大的自裂核酶,裂解方式与其他自裂解核酶相似(图1),通过内部紧靠剪切点的核苷酸上的2’-OH亲核取代剪切位点上的磷酸二酯键的5’-O,得到两个反应产物,分别为带有2’-3’磷酸二酯键的RNA和一个游离的5’-OH。已有相关研究报道了对VS核酶的三级结构和活性至关重要的碱基G638和A756,同时金属Mg2+离子可以稳定VS核酶结构,但Mg2+在活性部位的催化作用尚未确定。在本文中,作者对VS核酶进行了一系列的计算和实验研究,以表征其功能活性状态,确定其关键的催化过程。
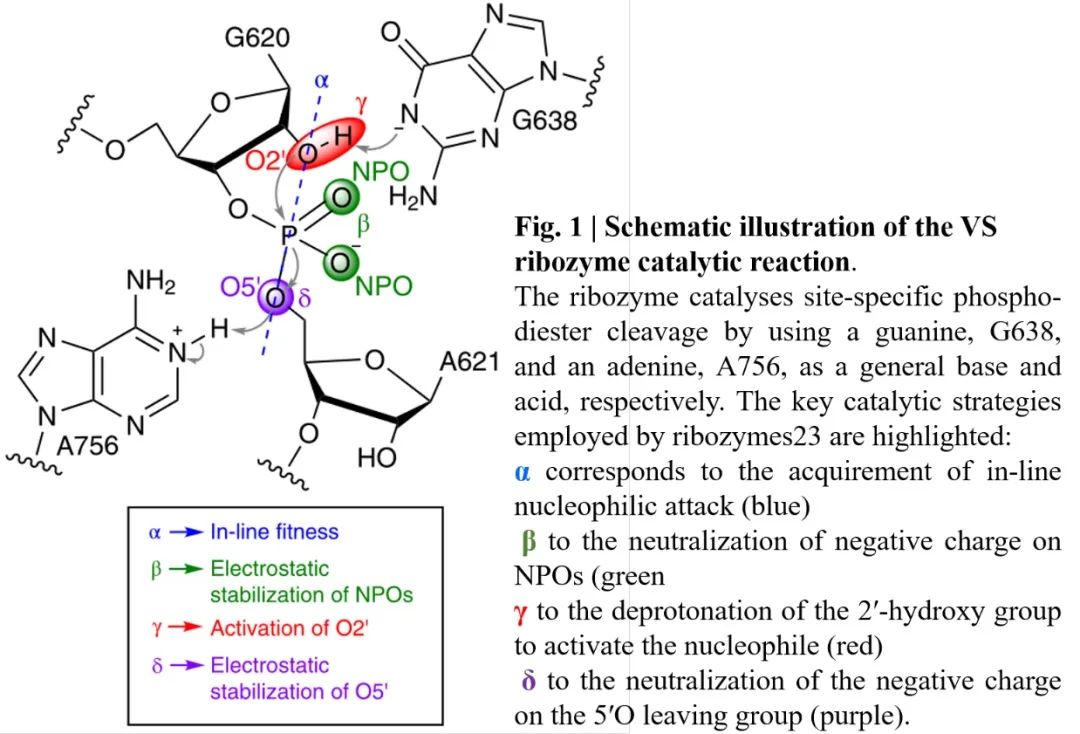
图1. VS核酶催化反应示意图
图片来源:Nature Chemistry
计算结果
作者利用目前三种可用的晶体结构作为出发点对WT核酶进行了MD模拟,以确保预测与起始状态无关,模拟结果如图2所示。图2a以相互作用图的形式描绘了沿着各种MD轨迹中的重要相互作用,根据图2a,基于不同晶体结构的模拟描绘了核酶特定活性位点相互作用的概率,其中每个催化关键元素(α,β,γ,δ)要么不存在,要么不支持有效催化,因此反映不了溶液中的活性状态。最令人关注的是模拟中缺乏催化活性状态的形成,即无法满足“in-line”的催化机制,α和γ催化仅占所有构型的7%(图2b)。总的来说,在没有金属Mg2+的情况下,基于现有核酶晶体结构出发的MD模拟无法反映核酶在溶液中的催化活性状态。
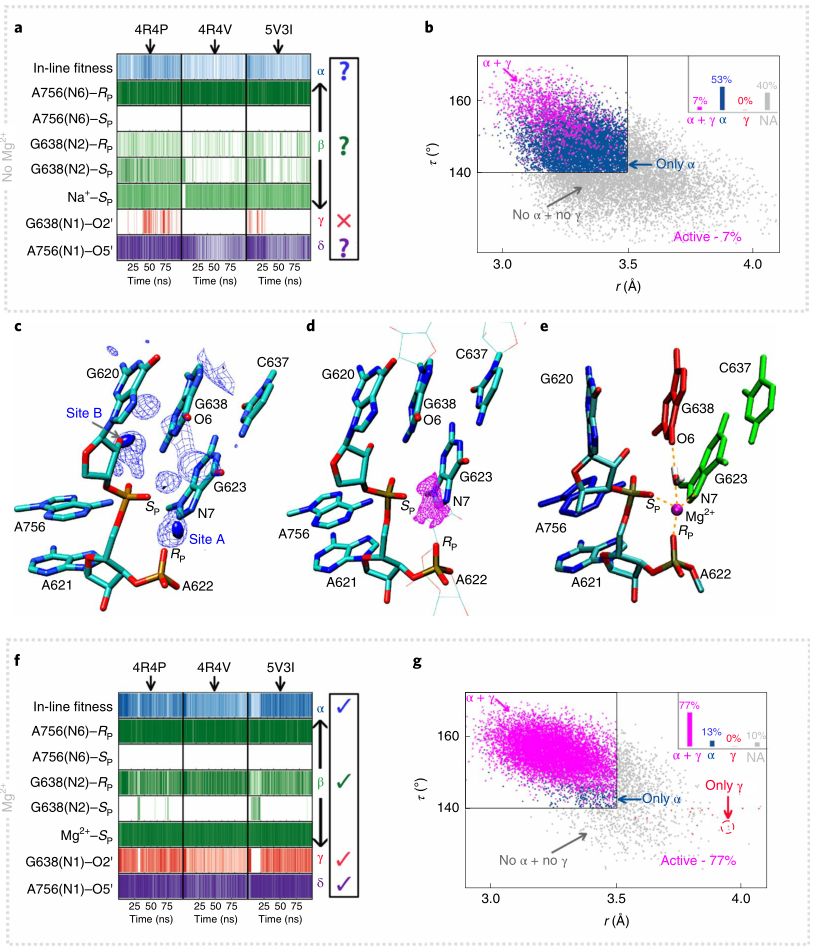
图2. VS核酶的MD模拟结果
图片来源:Nature Chemistry
目前众多实验研究表明Mg2+离子不仅对VS核酶的整体折叠很重要,更直接地参与了活性位点,影响催化过程。对MD轨迹的进一步分析发现,活性位点中有两个位点被Na+离子高占据(图2c)。为了确定Mg2+的可能结合位点,作者对不同晶体结构和模拟得到的结构,进行了3D-RISM计算,计算结果预测活性位点A的Mg2+结合概率高(图2d),并且与先前实验发现一致。作者通过进一步的金属离子解救实验证实Mg2+与核酶活性部位的pro-SP-NPO有特异性配位作用。
基于金属离子拯救实验的结果,作者试图研究Mg2+离子对核酶活性位点动力学的影响。作者重新复制了MD轨迹, 每个结构中Mg2+与A621的pro-SP-NPO结合,并且与上述A622的pro-RP-NPO和G623的N7接近(图2c-e)。这些模拟的结果总结在图2f,g中。有趣的是,如相互作用图(图2f)所示,这些独立的轨迹都收敛到与实验数据一致的活性位点,并展示了所有关键的催化过程。在活性位点A结合Mg2+的模拟中,大多数构型(77%)显示出催化活性状态(同时显示α和γ催化),而在没有Mg2+的模拟中,只有7%的构型显示出催化活性状态。在MD模拟中观察到的活性构型在A位Mg2+存在下增加了11倍,这表明活性位点金属离子的存在增强了催化作用。进一步的突变实验也验证了Mg2+结合模型(图2e)。
目前对VS核酶催化的一致观点认为G638和A756分别作为广义碱和酸发挥作用,尽管有证据支持这些假设,但仍有很多疑惑存在,此外,我们对于从广义酸到广义碱的质子转移程度,及过渡态的性质一无所知。为了阐明VS核酶催化过程,作者测量了一系列带有腺嘌呤(A)和鸟嘌呤(G)类似物的核酶的Brønsted系数,并得到了A类似物和G的线性关系(图3a,b)。LFERs结果表明,在过渡态中,广义碱的质子转移几乎完全完成,而广义酸的质子转移部分完成。
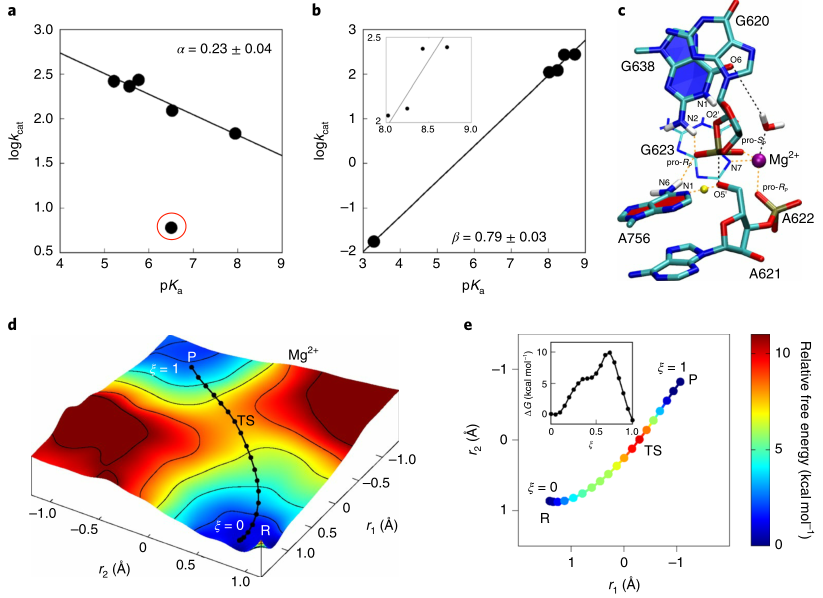
图3. VS核酶的催化机理研究
图片来源:Nature Chemistry
作者利用QM/MM的方法对催化反应的化学步骤进行了更详细的研究,获得了催化反应的自由能面(图3d)。QM/MM模拟表明G638作为从2’-OH接受一个质子,活化后的2’氧负离子作为亲核试剂进攻切割位点的磷酸,其中2’羟基的脱质子活化过程是单独发生的,P-O2’/P-O5’键的形成/裂解和广义酸的质子转移以协同方式发生,并且是催化过程的决速步鄹,反应的自由能垒为~10 kcal /mol。模拟得到的过渡态(图3c)是一个“后”过渡态,其中P–O2′键几乎完全形成,P–O5′键大部分断裂,A756的质子部分转移到5′O离开基团,这也与LFER数据一致,进一步表明G638的质子转移可能发生在达到速率控制过渡态之前的预平衡阶段。
总结
核酶的催化作用主要由两部分组成:金属离子和碱基。从近三十年的研究来看,普遍认为VS核酶催化机制完全依赖于核碱催化。本文中,作者综合计算和实验的结果,发现二价金属离子与磷化氢的pro-SP氧相互作用(图4),并通过与下游磷酸盐(A622),G623:N7的pro-RP氧和G638:O6的配位作用来维持VS核酶的活性结构。
作者分析了小型核酶的结构,发现这些核酶有一个活性位点核苷酸,称为L锚(图5),可能有助于其定位亲核活化。在锤头状核酶中,保守的腺嘌呤(A21)充当L-锚,而在发夹状核酶中,尿嘧啶(U+2)起着这个作用。在目前可用的结构数据中,VS核酶缺乏一个可能起到L锚作用的核碱基,然而,对本研究中定义的VS核酶模型的检验表明,新鉴定的Mg2+可能作为L-锚,揭示了VS核酶活性位点结构先前未知的一面。Mg2+在VS中的作用既是作为锚定结构的组织作用,又是静电作用,在调节总碱基的pKa和通过与切割位点的磷酸相互作用来稳定过渡态。与VS核酶一样,锤头状核酶使用鸟嘌呤作为总碱,需要保守的腺嘌呤和Mg2+进行催化。然而,腺嘌呤和Mg2+在这两种核酶中的作用是相反的:在VS核酶,A756作为广义酸起作用, Mg2+充当L-锚;而在锤头状核酶中,Mg2+协助酸催化,A9充当L-锚。综上所述,这些观察揭示了锤头、发夹和VS核酶共有的新功能特征。
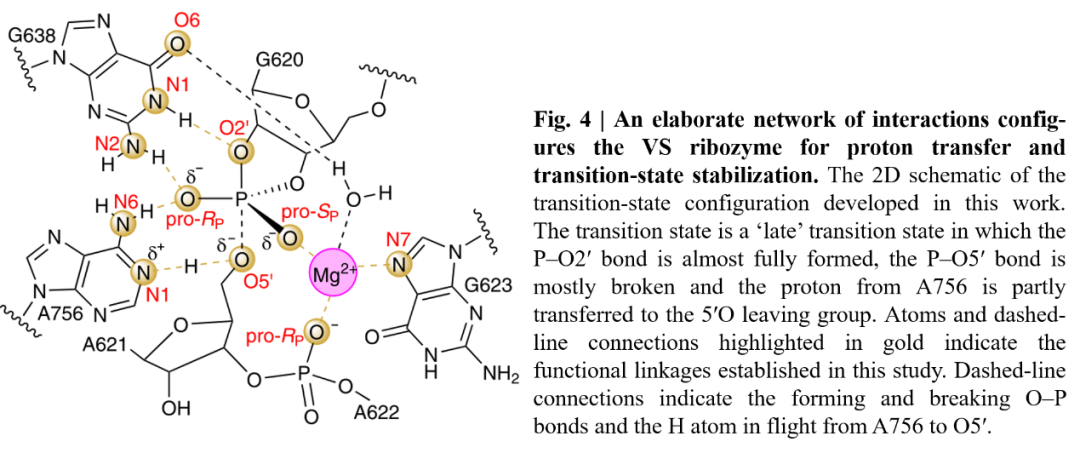
图4. VS核酶过渡态结构的二维示意图
图片来源:Nature Chemistry
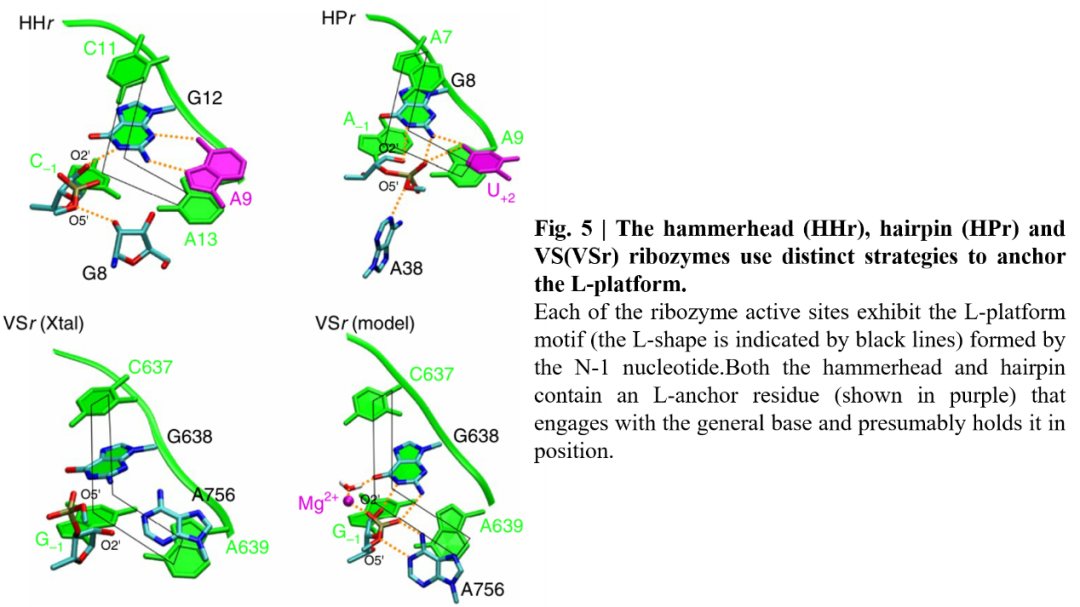
图5. 三种小核苷水解核酶的L-锚结构示意图
图片来源:Nature Chemistry
参考文献
Ganguly, A., Weissman, B.P., Giese, T.J. et al. Confluence of theory and experiment reveals the catalytic mechanism of the Varkud satellite ribozyme. Nat. Chem. 12, 193–201 (2020). DOI: 10.1038/s41557-019-0391-x