合理的酶抑制剂设计(Rational enzyme inhibitor design)是指将酶的催化机制和结构信息共同用于指导药物的设计与发现。计算化学和结构生物学的发展,极大地提高了酶催化反应机制以及酶结构信息的研究速度,而如何巧妙地将二者结合起来以设计出活性较好的抑制剂,尤其是选择性也很好的抑制剂是目前比较难的事情。
通常,比较常用的解决方法主要有以下四种:
(1)基于基态类似物的设计策略;
(2)基于结构的设计策略;
(3)基于反应机制的设计策略;
(4)基于过渡态类似物的设计策略。
01
基于基态类似物的设计策略
就是基于基态类似物的抑制剂设计方法,基态主要是指沿着酶催化路径依次得到的各个稳态,如底物态、中间体和产物态等。基态类似物设计主要是通过设计一些与底物、中间体或者产物的化学结构相类似的化合物,以期它们能够作用于并抑制相关的酶。
下面以HDAC抑制剂设计为例进行简单介绍。2004年,HDAC8晶体结构就已经被结晶出来了,2008年,通过量子力学与分子力学组合方法(QM/MM)的计算,HDAC8的催化反应机制被确定下来,同时,与底物相关的反应物态(底物态)、反应中间体态以及产物态的结构也被确定,这就为基于基态类似物的HDAC选择性抑制剂设计提供了依据。如图1所示,在过去的近二十年里,有许多的基于乙酰赖氨酸底物类似物、中间体类似物以及产物类似物的抑制剂被设计出来,有的甚至都已经被FDA批准上市,如基于乙酰赖氨酸底物类似物的FK228分子(罗米地辛)和基于中间体类似物的SAHA分子(伏立诺他),分别已经于2009年和2006被FDA批准用于治疗皮肤T细胞淋巴瘤(CTCL),2011年时FK228又进一步被FDA批准用于治疗外周T细胞淋巴瘤(PTCL)和侵袭性非霍奇金淋巴瘤(NHL)。此外,还有很多基于基态类似物设计而得到的抑制剂正在进行临床试验。
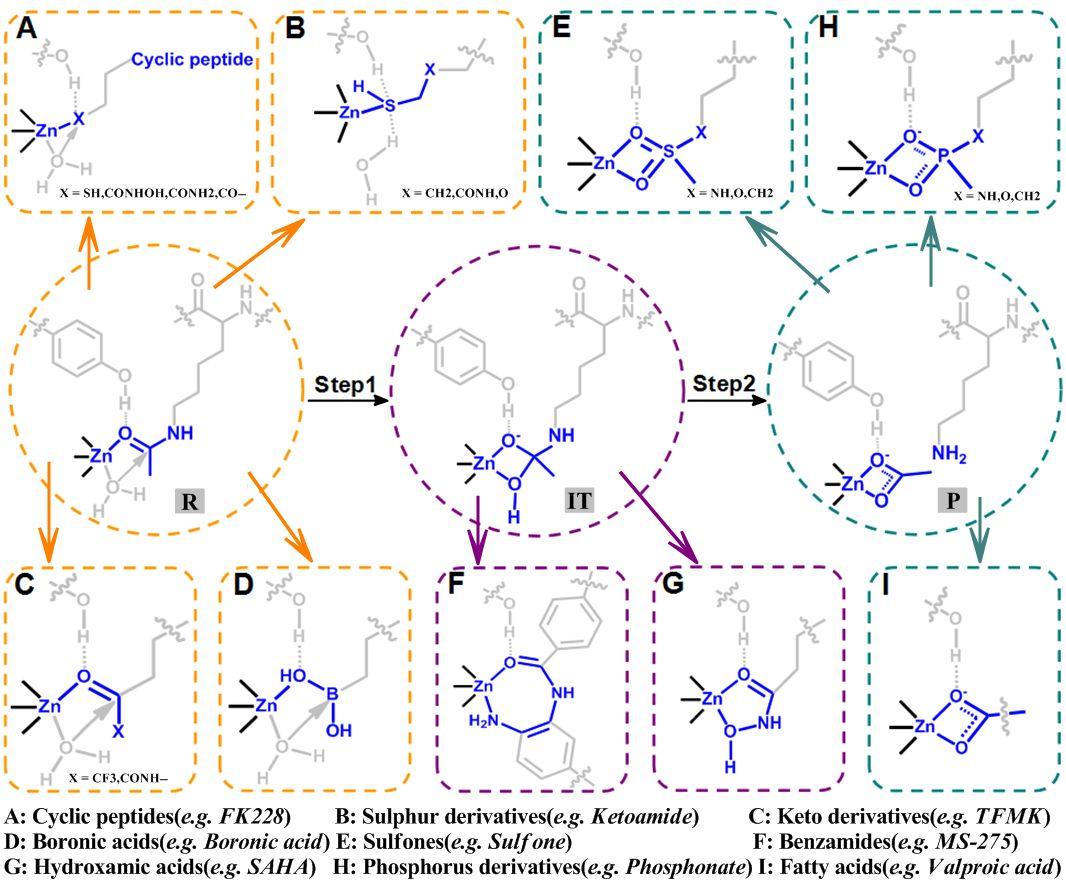
图1. 基于赖氨酸去乙酰化反应中的反应态、中间体和产物态的抑制剂的化学分类。赖氨酸去乙酰化反应的各个状态以不同颜色的圆圈标示,其相对应的抑制剂以相同的颜色标注在长方形中,锌离子以及抑制剂中与锌相互螯合的部分以蓝色标识。
02
基于结构的设计策略
虽然基于基态类似物的设计策略看似效果不错,但是却有一个致命的缺点,就是根据这个策略设计出来的抑制剂大多都是泛抑制剂(pan inhibitor,也称非选择性抑制剂或者广谱抑制剂),即对大多数HDAC亚型均有抑制活性,比如SAHA抑制剂,它不仅可以通过抑制第I家族的HDAC来影响肿瘤细胞的生长和转移,加速肿瘤细胞的凋亡,还可以通过抑制其他家族的HDAC来干扰正常细胞中的各种表观遗传功能,从而产生毒副作用。也正是出于对SAHA非选择性毒副作用的担心,在2009年Merk公司撤回了SAHA在欧盟上市的申请。此后,有许多临床I/II期的HDAC抑制剂也不断地报道出各种各样的非选择性毒副作用。
为了克服上述非选择性问题,基于结构的设计策略被提出来,对一些现有的抑制剂进行药效团分析,并最后根据HDAC活性口袋的四个区域(表面识别区域—疏水性通道—金属螯合位点—内腔口袋),将HDAC抑制剂也划分为四个关键部分:帽子区(Cap)— 连接区(Linker)— 螯合区(Chelator)— 尾端区 (Foot),具体的划分见图2。抑制剂的Cap区与表面识别区域相结合、Linker区与疏水性通道相结合、Chelator与金属螯合位点相结合、Foot区与内腔口袋相结合。通过对抑制剂的四个划分区域进行各种改造,一些具有亚型选择性的抑制剂被设计出来,并进入了临床试验,也有几个被FDA批准上市,比如针对SAHA分子对其Cap区进行改造获得了两个新的抑制剂PXD-101(贝利司他)和LBH-589(帕比司他),二者分别在2014年和2015年被FDA批准上市,PXD-101被用于PTCL和NHL的治疗,LBH-589被用于治疗多发性骨髓瘤(MM),尽管二者仍然属于泛抑制剂,但相比于SAHA而言,其亚型选择性已经有所提高。此外,通过在Foot区域引入一些疏水性大基团获得了一种新型的HDAC抑制剂——苯甲酰胺类抑制剂(Benzamide),根据Foot区域的基团类型,可以将苯甲酰胺类抑制剂分为简单型苯甲酰胺(Simple Benzamide)和联芳环苯甲酰胺(Biaryl Benzamide),具体结构见图2所示,临床上已经证明Simple Benzamide具有明显的HDAC1/2/3亚型选择性,而Biaryl Benzamide更是只对HDAC1/2呈现选择性,目前针对Simple Benzamide已经有一个药物被CFDA批准上市(C-555,西达本胺),还有一些正在进行临床I/II实验,如MS-275抑制剂。
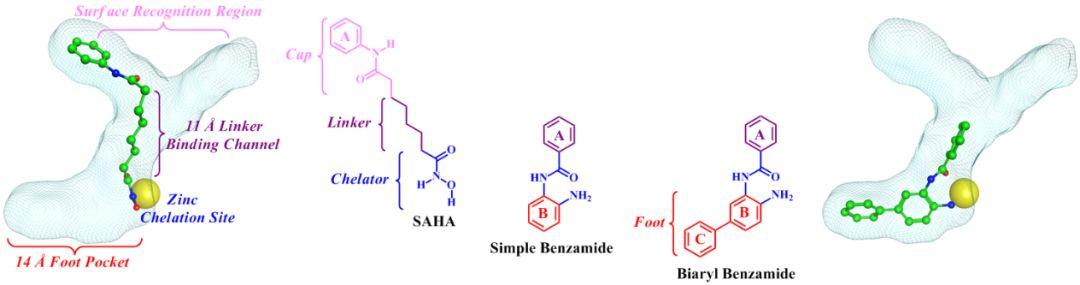
图2. HDAC活性口袋的结构特征:表面识别区域(粉色)—11 Å疏水性通道(紫色)—锌螯合位点(蓝色)—14 Å内腔口袋(红色),以及抑制剂的结构特征:帽子区(粉色)—连接区(紫色)—螯合区(蓝色)—尾端区(红色)。
03
基于过渡态类似物的设计策略
由于在酶催化底物的过程中,会经历一个或者多个过渡态结构,其中形成高能量过渡态的能量壁垒控制着反应速率。实验上证明,酶与过渡态等不稳定态之间的亲和力要远高于酶与底物、中间体或者产物等稳定态的亲和力,以降低反应时的能量壁垒。此外,由于酶的特异性,催化得到的过渡态结构往往也具有一定的结构特异性。因此,设计一个在空间结构、疏水性匹配和电子等因素上能够模拟一个酶催化反应过渡态的稳定化合物,就有可能获得既具有高亲和力又具有选择性的酶抑制剂。虽然过渡态类似物的概念在很久之前就提出来了,但目前的发展仍然缓慢,目前主要在四个方面取得了突破:正碳离子样的过渡态类似物、负碳离子样的过渡态类似物、磷酰基转移的过渡态类似物以及四面体过渡态类似物。基于上述四个方面,已经有一些高活性和高选择性的过渡态类似物抑制剂的出现,比如抑制法呢基焦磷酸合成酶(FPPS)的芳香族含氮双磷酸酯类抑制剂、抑制唾液酸转移酶(ST)的共轭羧酸酯类抑制剂等、抑制嘌呤核苷磷酸化酶(PNP)的DADMe-ImmH类抑制剂和抑制人类免疫缺陷病毒蛋白酶(HIV Protease)的α-羟基β-氨基酸类抑制剂。
04
基于反应机制的设计策略
无论是基于基态还是过渡态类似物的设计策略,它们都只是纯粹地从静态的角度,依据小分子本身而进行的设计,并没有充分地考虑酶大分子。基于反应机制的设计策略是目前正在迅猛发展的药物设计理论,其主要是在动态整体地考虑酶催化过程的基础上,设计一个不仅能够与酶结合,还能在结合后诱使酶启动正常催化循环的化合物。这种化合物一般具有以下几个特点:(1)与正常底物的关键反应区域结构相似,这种相似包括立体相似和电性相似;(2)具有低反应性能的基团或者结构片段,可通过酶的激活转化为反应性特别强的活性基团;(3)可能最终会改变酶活性部位的结构,如共价结合酶活性位点的残基或者酶活性位点残基的修饰(如质子化、酰基化、氨基化、烷基化等)等。根据催化反应后,酶与抑制剂之间是否可逆结合,可将基于反应机制的设计策略分为不可逆抑制剂设计(共价抑制剂设计)、亲核标记抑制剂设计、蛋白修饰抑制剂和伪不可逆抑制剂设计。
抑制剂与酶有结合和解离两个过程,在实验上通常将解离动力学常数(Koff)的倒数称为抑制剂在酶中的停留时间(t = 1/Koff,也称为保留时间)。实验上测试抑制活性IC50的时候,一般会有一个酶与抑制剂孵化的过程,其目的就是让抑制剂与酶充分结合,以保证测试的准确性。由于大部分抑制剂在酶中的停留时间较短(即解离较快),所以一般只在一个孵化时间下就可以准确测出IC50,而对于基于反应机制设计的抑制剂由于它们参与了酶的催化过程,并对酶的活性位点结构有所改变,因此相对于其他抑制剂而言,它们的解离通常比较慢,酶中停留时间较长,这就造成在实验上可以观察到它们对酶的抑制活性随孵化时间的延长而呈现出越来越高的现象,即为IC50平移现象,也称时间依赖性抑制。
相比于基于基态类似物和基于结构的传统设计策略,基于过渡态类似物和基于反应机制的设计策略属于比较前言的设计策略,还在发展之中,它们的核心就是获得靠谱的反应机制和准确的过渡态结构,一旦获得靠谱的反应机制和准确的过渡态结构,我们就可以回到基于基态类似物和基于结构的传统设计策略上来。
量子力学与分子力学组合方法(QM/MM)的发展为获得靠谱的反应机制和准确的过渡态结构提供了可靠的计算支撑,让前言的基于反应机制和基于过渡态类似物的设计策略得以在计算水平上展开和发展。
后续我们将推送更多与QM/MM在基于反应机制和基于过渡态类似物的设计策略中的应用相关的推文,敬请期待。最后,本公司目前提供QM/MM方面的计算,欢迎咨询!