上一篇文章中我们已经初步介绍了量子力学-分子力学组合(QM/MM)的多尺度模拟方法在共价结合靶点机制方面的应用,即维格列汀(VIL)和沙格列汀(SAX)药物与靶标DPP-4共价结合的生物化学机制,以及导致两种药物活性差异的原因。这是个多种药物对应一个靶点方面的案例,今天,我们再给大家介绍一个单个药物对应多个靶点方面的案例,即传统药物阿司匹林分别与靶点COX-1和COX-2共价结合的生物化学机制,以及导致活性差异的原因。
阿司匹林,也俗称乙酰水杨酸或者ASA,是一种古老而且经典的抗炎药,自诞生一个多世纪以来,被广泛的用于治疗炎症、发烧和疼痛等疾病。和其他的非甾体类抗炎药(NSAIDs)一样,阿司匹林主要是通过抑制COX-2靶点(图1)发挥抗炎的效果。但不同的是,阿司匹林在抑制COX-2靶点的同时,也能够抑制COX酶家族的另外一个靶点COX-1(图1),而且其对COX-1的抑制活性还要高于对COX-2的抑制活性(二者相差10-100倍左右),因此导致其在发挥抗炎的同时也产生一些其他的副作用(如胃溃疡副作用)。缺乏选择性通常被认为是阿司匹林最大的缺陷之一。尽管科研工作者在致力于开发阿司匹林样分子上做出了巨大的努力,以提高其对COX-2的选择性或降低对COX-1的选择性,但收获甚微,导致这种结果的一个关键因素就是我们对于这种选择性差异的产生缺乏结构功能上的认知。而QM/MM方法可以对这种选择性差异进行结构功能上阐述,正好可以填补这个认知。
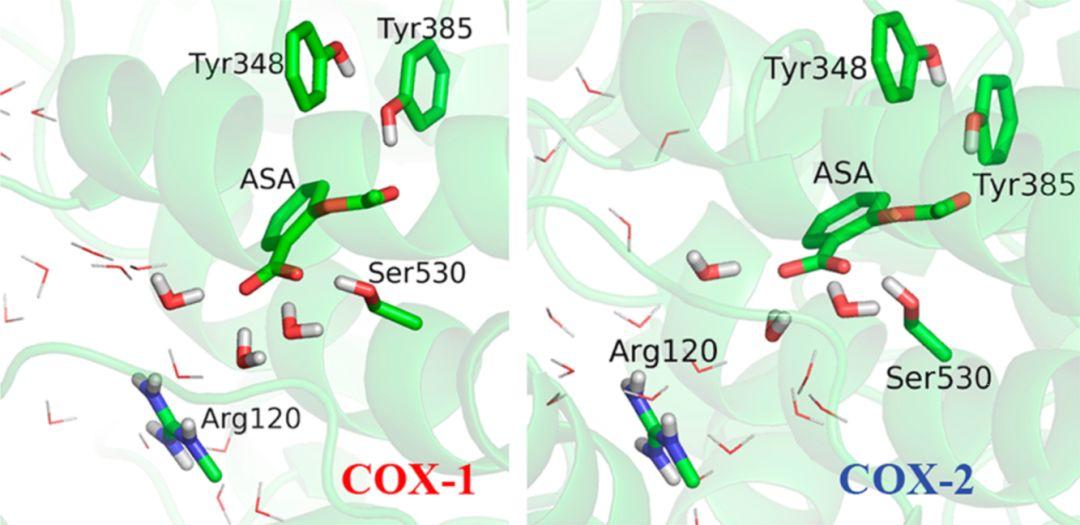
图1.COX-1和COX-2靶点的结构图,图片来源:J. Am. Chem. Soc.
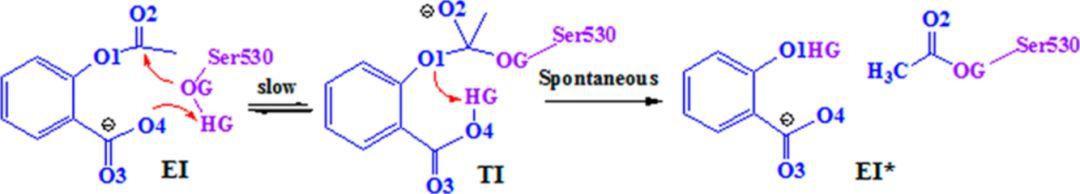
图2. 阿司匹林与COX-1和COX-2靶点作用模式,图片来源:J. Am. Chem. Soc.
通过QM/MM MD伞形采样获得了阿司匹林与靶点COX-1和COX-2共价结合的过程(图2和图3)。模拟结果显示阿司匹林与COX-1和COX-2的共价结合共经历两步:第一步中,阿司匹林的羧基作为一般性碱夺取COX-1和COX-2靶标中的Ser530残基的羟基H原子,失去了H原子的Ser530残基上的O负离子会同时亲核进攻阿司匹林的羰基C原子,以形成阿司匹林与Ser530残基共价结合的中间体;第二步中,阿司匹林的C-O键上的O会夺取在第一步中转移到羧基上的H,从而使得阿司匹林的酯基断裂,阿司匹林和Ser530形成的共价结构得到解离,最终结果是Ser530酯化,而阿司匹林去酯化形成SA产物(图3)。
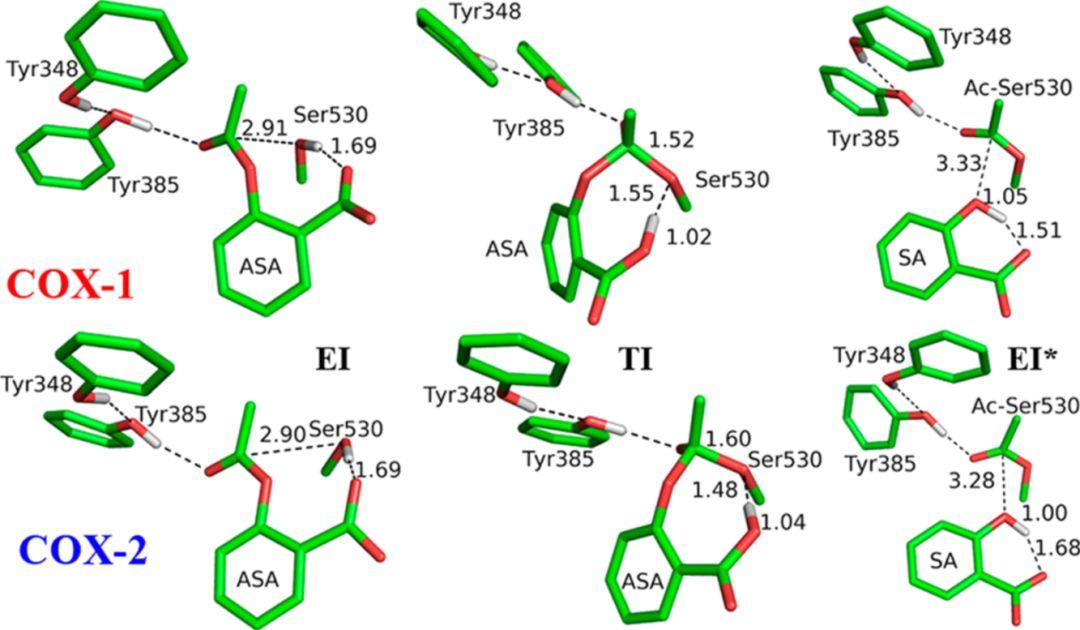
图3. 阿司匹林与COX-1和COX-2共价结合过程中的关键结构图,图片来源:J. Am. Chem. Soc.
尽管阿司匹林和COX-1和COX-2共价结合的过程类似,但二者在能量曲线上却存在着不同,如图4所示(图4也是通过QM/MM MD伞形采样得到的),阿司匹林在与COX-1共价结合时的限速步骤的能垒大约是16.1kcal/mol,而与COX-2共价结合时的限速步骤的能垒大约是18.6kcal/mol,二者相差大约2.5kcal/mol,换算成反应速率后,二者的速率倍数(选择性)大约是49倍,和实验上的10-100倍结果相一致。
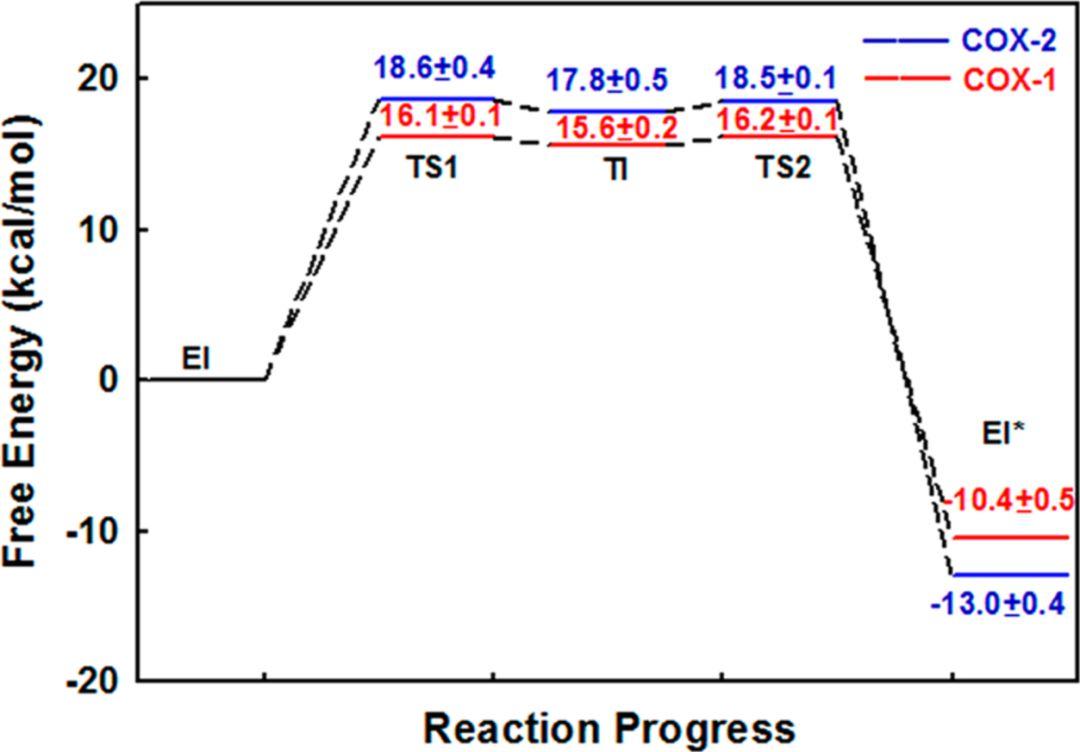
图4. 阿司匹林与COX-1和COX-2共价结合的反应曲线,图片来源:J. Am. Chem. Soc.
既然已经得到了阿司匹林与COX-1和COX-2共价结合过程的反应曲线和关键结构图,那么接下来就可以计算阿司匹林周围的残基对阿司匹林与COX-1和COX-2共价结合过程中的过渡态结构的作用能,作用能越负说明该残基对于过渡态的稳定作用越强。计算结果如图5所示,可以看出在阿司匹林周围的残基中只有513残基的贡献存在着不同,在COX-1中513号残基是His残基,其对阿司匹林与COX-1结合后的过渡态结构的作用能为0.03 kcal/mol,可忽略不计,而在COX-2中513号残基是Arg残基,其对阿司匹林与COX-2结合后的过渡态结构的作用能为2.24 kcal/mol,很显然Arg513残基不利于稳定过渡态,因此在反应曲线上,阿司匹林与COX-2共价结合的能垒比COX-1高出2.5kcal/mol。考虑到513残基对阿司匹林的选择性的影响,在阿司匹林选择性改进问题上513残基可以作为一个重点考虑的残基。
总之,从酶反应动力学层面揭示了药物作用机理及活性差异的来源,对共价药物设计具有启发意义。
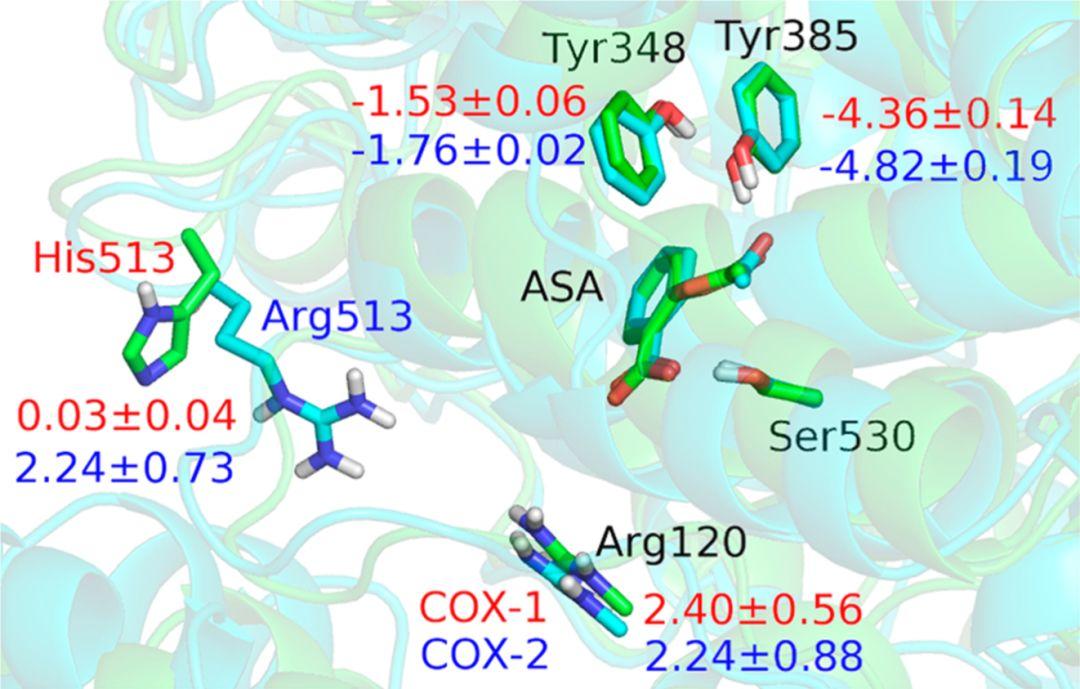
图5. 关键残基对于过渡态结构的稳定作用,图片来源:J. Am. Chem. Soc.
参考文献
Lei, J.; Zhou, Y.; Xie, D.; Zhang, Y.* Mechanistic Insights into a Classic Wonder Drug-Aspirin. J. Am. Chem. Soc. 2015, 137, 70-73.