
通过Rosetta和计算分析设计并验证了埃博拉病毒糖蛋白BDBV-HR2-MPER C端附近的表位是候选抗原,与纳米粒融合后在兔上测试了免疫原性。
背景介绍
扎伊尔病毒(EBOV)、本迪布焦病毒(BDBV)和苏丹病毒(SUDV)是三种造成严重疾病的人类埃博拉病毒。尽管BDBV223的空蛋白结构和包含BDBV-HR2-MPER表位的肽-抗体复合物结构已被解析,但HR2-MPER抗原表位的抗体识别仍然是一个谜。
埃博拉病毒糖蛋白(GP)的抗原表位被三种埃博拉病毒的抗体识别,其结合宽度对合理的疫苗设计有重要意义。七肽重复2膜近端外区(HR2-MPER)表位在EBOV、BDBV和SUDV GP之间相对保守且被人广泛用于中和抗体靶向。
为了研究该表位是否可以作为广谱抗体反应的免疫原,本文开展了免疫原设计、抗原-抗体结合、NMR测试结构灵活性等一系列实验,是第一项基于埃博拉病毒的表位聚焦免疫原设计的研究。
采用Rosetta表位移植方案
设计携带HR2-MPER表位的小蛋白免疫原
Rosetta包含不同的表位聚焦的免疫原设计方法,包括侧链和骨架移植以及FunFolDes。这些移植方案被用于将BDBV-HR2-MPER表位移植到更小的支架蛋白上。在共晶结构中,BDBV223与含有线性BDBV-HR2-MPER表位的合成肽共结晶,分辨率3.68Å,结合模式如图1A-C。使用PDB筛选分辨率<2.5 Å并且能够从E.coli中表达的小蛋白,用于移植共晶结构中BDBV-HR2-MPER表位。筛选步骤如图1D。最终获得11种设计用于实验验证。设计源自不同的方法,由不同的序列组成,总共包含三种不同的支架蛋白。
设计的蛋白由E.coli表达,纯化后用于测试与BDBV233的结合。11种设计的蛋白中,有六种设计被纯化,只有一种能在ELISA实验中与BDBV233结合(图1E)。该结合对于BDBV-HR2-MPER抗体BDBV223、BDBV317和BDBV340是特异性的,但该蛋白不与登革热病毒特异性抗体2D22结合(图1F)。

图1基于 BDBV-MPER 的免疫原的计算设计和初步实验验证。图片来源:PLOS Pathogens
基于BDBV-MPER的免疫原与三个HR2-MPER表位特异性抗体强结合
设计的免疫原掺入了BDBV-HR2-MPER表位的I623至D632残基。在晶体结构中,K633和P634与BDBV233相互作用。因此,作者确保了设计的免疫原通过相同的突变,重现已报道的序列-活性关系。通过定点突变、ELISA以及结合晶体结构,作者发现BDBV-MPER免疫原中的最后三个氨基酸对相互作用的贡献最小。
当用三种BDBV-HR2-MPER已知抗体BDBV223、BDBV317和BDBV340测试BDBV-MPER设计的结合时,每个抗体的EC50值都在低ng/mL范围内。当使用HR2-MPER多肽对BDBV-MPER免疫原序列进行突变检测时,抗体结合相对于多肽来说仍然较强。这一观察结果可能是由于免疫原与多肽相比具有保持主干结构的能力。
BDBV-MPER免疫原纳米粒子
比埃博拉GP免疫兔子表现出更高的抗体滴度
为了获得高的抗体滴度,作者使用自组装纳米粒子平台,用linker将小的单体BDBV-MPER抗原与由不同纳米粒子框架组合成的三聚体融合在一起,多价显示抗原(图2)。
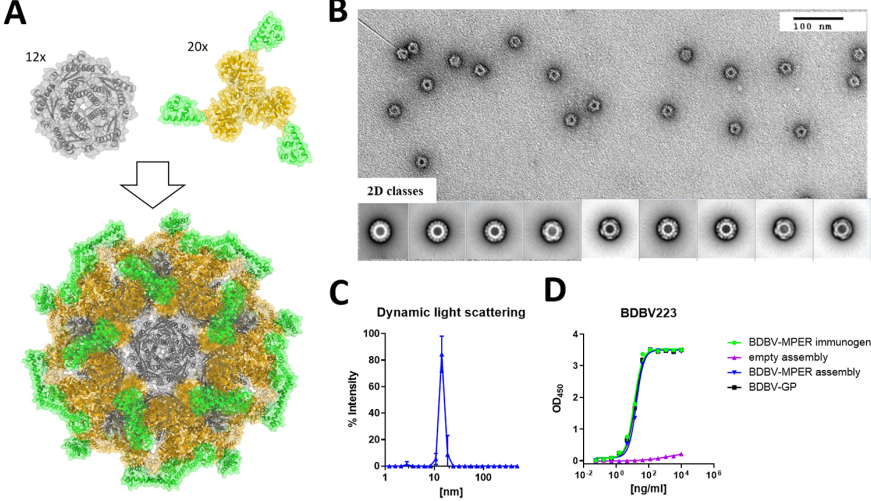
图2 展示BDBV-MPER免疫原的自组装纳米粒子的设计和表征。图片来源:PLOS Pathogens
自组装纳米粒子平台展示了四种不同的免疫原:1)BDBV-MPER、2)BDBV-MPER-KPL、3)无任何免疫原HR2-MPER 表位,但SAM结构域的天然序列,以及 4) HR2-BDBV-MPER 肽(称为 BDBV-MPER 肽)。免疫简图见图3A。作者发现,纳米粒子展示的免疫原有更高的滴度,相对于BDBV GP或EBOV GP来说,SUDV GP的抗体滴度似乎较低且反应延迟(图3B)。
图3 BDBV-MPER 免疫原免疫的兔血清结合。图片来源:PLOS Pathogens
MPER-KPL组中的一种兔血清
与MARV GP结合暗示交叉反应免疫
作者随后筛选以1:30的滴度结合MARV GP的兔血清,以测试交叉反应(图4A)。序列比对结果显示出假设的 MARV-HR2-MPER 表位,且有意思的是该序列前也有一个NxS序列,NxS序列在所有的埃博拉病毒中为NxT且携带一个多糖作为表位的上边界。作者因此认为MARV-HR2-MPER可能是一个具有与BDBV-HR2-MPER相似特性的抗原表位(图4B)。
血清结合实验中,针对假设的MARV-HR2-MPER区域的交叉反应抗体随着时间的推移通过体细胞高突变逐渐进化。并且,埃博拉病毒HR2-MPER表位可以引起广泛反应性多克隆抗体应答,包括MARV GP。需要进行广泛的研究,包括人类对MARV GP的免疫反应特征,以进一步验证MARV- MPER作为表位的可能性。
图4 MPER-KPL免疫的兔血清显示出与MARV GP的交叉反应。图片来源:PLOS Pathogens
血清抗体未对BDBV或VSV/BDBV GP病毒
显示出中和活性
作者使用免疫的兔血清对真性VSV病毒和嵌合VSV病毒的中和活性进行了测试。本研究中免疫原组的血清抗体与对照组的血清相比不具有中和作用,从血清中纯化IgG并检测VSV/BDBV GP病毒时也不具有中和作用(图5)。缺乏中和作用可能是因为所设计的蛋白质依赖于肽-抗体复合物的结构,感染过程中,在GP三聚体和病毒膜中可能无法完全重现HR2-MPER表位的确认。
图5 免疫兔血清的中和活性研究。图片来源:PLOS Pathogens
NMR生成的BDBV-MPER免疫原结构模型
支持Rosetta设计结构
作者随后使用溶液 NMR谱在结构上验证了 BDBV-MPER 免疫原设计(图6A)。结果表明结构构型没有受到显著的干扰,且如预期所料,与氨基酸序列不同区域相关的化学位移发生了变化,表明与BDBV-MPER免疫原相比,局部化学环境发生了改变(图6A)。
BDBV-MPER-KPL免疫原、SUDV-MPER免疫原与BDBV-MPER免疫原谱相比,化学位移变化很小,新的氨基酸对该局部化学环境产生了干扰,但对设计的结构没有明显的干扰图6B、C)。
利用BDBV-MPER免疫原残基序列的NMR化学位移,作者使用TALOS+软件来预测phi和psi主链扭转角。结果支持Rosetta设计的BDBV-MPER免疫原的二级结构。有趣的是,该序列中的C端残基虽然在作者的模型中形成了螺旋,但通过TALOS+预测为环。所有指定的主链和侧链NMR化学位移都用CS-Rosetta进行结构预测。将得到的最高评分模型与计算出RMSD为2.4Å的BDBV-MPER免疫原的设计进行比较(图6D)。圆二色谱(CD)分析了其二级结构,发现α -螺旋主导了蛋白的二级结构组成(图6E)。溶液NMR和CD测量均表明,BDBV-MPER的免疫原二级结构与设计的模型一致。
图6 使用溶液NMR对BDBV-MPER免疫原设计进行结构验证。图片来源:PLOS Pathogens
作者的研究指出,HR2-MPER表位的最后3个残基,比预期的更灵活。Rosetta中聚焦于表位的免疫原设计已经产生了针对不同案例的一系列方案,但从定义的二级结构中分离出来的结构特征仍然很难捕获,支架蛋白的可用性也很低,因此蛋白质设计的进一步改进将是必要的。
最近的一项研究报道了与MPER抗体10E8结合的HIV包膜糖蛋白纳米盘的电镜结构,揭示了HIV MPER抗体结合界面的特征。然而,对埃博拉病毒HR2-MPER表位结构知识的缺乏严重影响了合理的疫苗设计工作。对埃博拉病毒GP中HR2-MPER表位的进一步结构研究可能有助于阐明哪种结构构象对诱导中和抗体起重要作用。
由于这些结构无法确定BDBV-MPER作为表位聚焦免疫原的确切构象,因此基于HR2 – MPER的免疫原的合理设计仍然具有挑战性。随着更多的结构研究揭示了HR2-MPER抗体中和作用的构象基础,可能能将合理设计用于功能性候选疫苗的开发中。
结论
本研究通过Rosetta软件进行蛋白设计,将BDBV的HR2-MPER表位转移到一个小支架蛋白上,建立表位特异性免疫原。采用自组装双组分纳米颗粒系统制备免疫原用于家兔免疫研究,并诱导与BDBV和EBOV结合的抗体滴度较高,而与SUDV结合的抗体滴度较低,这与之前关于HR2-MPER抗体的数据一致。一个兔血清显示与MARV上的一个潜在的HR2-MPER表位结合,表明基于HR2-MPER表位甚至泛丝状病毒结合是可能的。这是首次尝试对埃博拉病毒表位进行聚焦免疫原设计,展示了提高丝状病毒交叉反应抗体的潜力。
参考文献
Schoeder CT, Gilchuk P, Sangha AK, Ledwitch KV, Malherbe DC, Zhang X, et al. (2022) Epitope-focused immunogen design based on the ebolavirus glycoprotein HR2-MPER region. PLoS Pathog 18(5): e1010518. https://doi.org/10.1371/journal.ppat.1010518