引言
褪黑激素受体(G蛋白偶联受体MT1和MT2)与人体昼夜节律的生理功能相关,可作为睡眠障碍和抑郁患者的药物靶点,作者基于MT1晶体结构,从1.5亿分子库中虚拟筛选,发现了调节昼夜节律的褪黑素受体激动剂。

先睹为快
蛋白靶点
褪黑激素受体(人源G蛋白偶联受体MT1)
筛选化合物库
ZINC数据库中1.5亿‘lead-like’化合物(http://zinc15.docking.org)
计算方法
分子对接(Molecular docking)
计算软件
DOCK3.7 (http://dock.compbio.ucsf.edu/DOCK3.7/).
计算流程
基于MT1晶体结构,通过DOCK3.7软件对接1.5亿个虚拟分子,优先考虑结构匹配和化学结构新颖性,合成并测试了38个排序靠前的分子,发现15个活性分子(470pM~6μM),但是这些化合物对MT1选择性不强,进一步通过结构类似物的合成改造,发现选择性激动剂, 小鼠体内实验证实了化合物调节昼夜节律的作用。
褪黑激素受体(G蛋白偶联受体MT1和MT2)与人体昼夜节律的生理功能相关,这两种受体可作为睡眠障碍和抑郁患者的药物靶点,但目前MT1选择性配体的报道寥寥无几,这大大阻碍了对昼夜节律生物学的理解和靶向治疗的发展。
作者收集了ZINC库中超过1.5亿个“lead-like”分子(http://zinc15.docking),其特征是具有良好的物理性质,例如,脂水分配系数-水分配系数cLopP≤3.5,分子质量≤350Da,然后使用DOCK3.7对接到MT1的活性位点。DOCK3.7(图1)在MT1正构位点中以平均160多万个结合模式(取向×构象)对每个库分子进行取样,整个库产生超过72万亿个复合物,并对每个结合模式与受体位点的物理互补性进行评分。
为了寻求结构多样性,通过拓扑相似性对排名前30万的分子进行聚类,得到65323个簇,并消除与ChEMBL23中已知的MT1和MT2配体相似的簇。对前10000个团簇中得分最高的分子进行了检测,以确定其是否与识别MT1晶体结构中配体的关键残基结合,是否有新的极性相互作用,包括Q181、N162、T1782和N255,以及与A158、G104和F179的主链原子的氢键(图2)。
在最佳评分组内,对所有成员进行检查,并对最符合这些标准的成员进行优先排序。最终选择40个分子进行从头合成和测试,这些分子的排名处于16到246721(0.00001%~0.1%)。在成功合成的38个分子中(95%的完成率),有15个化合物(图3)对人类MT1和MT2受体中或两者都有活性,命中率为39%(以活性化合物的数量/物理测试化合物的数量计算)。
但是这些活性化合物主要体现在MT2,因此需要进一步对化合物进行优化,合成了131个类似物,其中94个化合物有活性。其中两个具有新颖拓扑结构选择性的MT1可逆激动剂UCSF7447和UCSF3384。在黄昏给予这些MT1选择性反向激动剂时,小鼠昼夜节律时钟提前了1.3-1.5小时,这种激动剂样作用在MT1敲除老鼠中被消除,但在MT2基因敲除的小鼠中没有。这项研究阐明了MT1选择性配体可以调节褪黑激素受体生物学功能。
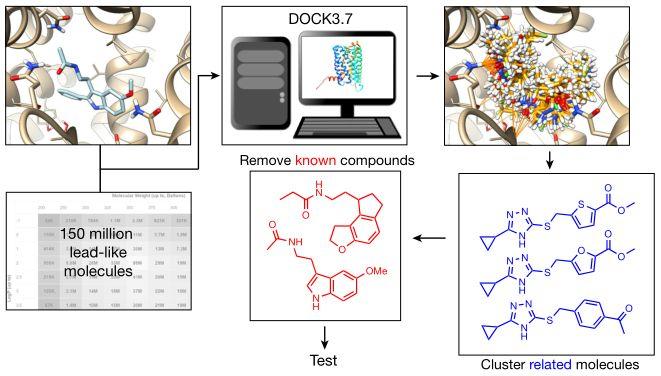
图1.从大型分子库对接发现新型褪黑激素受体配体
图片来源Nature
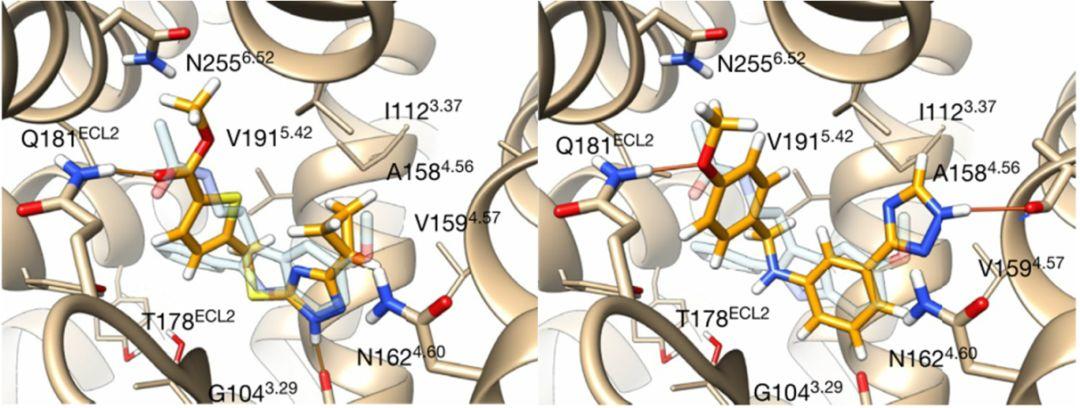
图2.MT1对接复合物的结合模式示意图
图片来源Nature
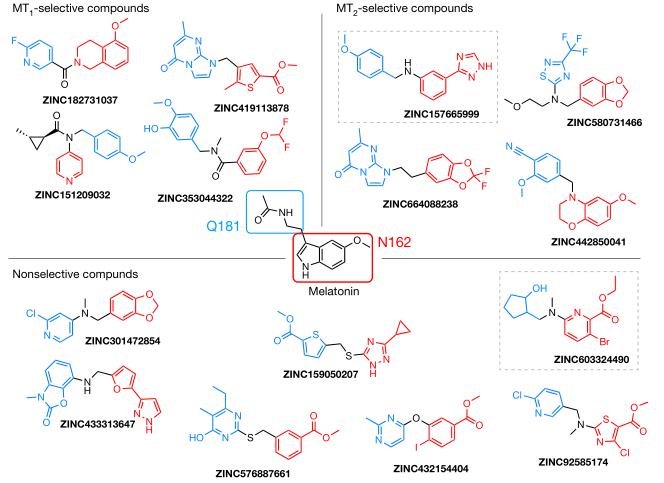
图3. 15个活性小分子的化学结构
图片来源Nature
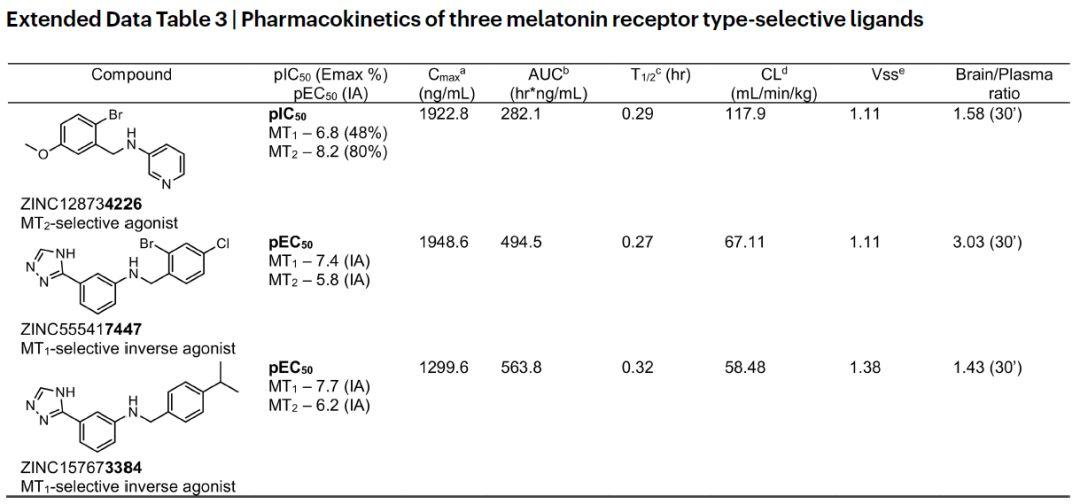
图4. MT1选择性可逆激动剂和MT2选择性激动剂药代动力学
图片来源Nature
参考文献
Stein, R.M., Kang, H.J., McCorvy, J.D. et al. Virtual discovery of melatonin receptor ligands to modulate circadian rhythms. Nature (2020). DOI: 10.1038/s41586-020-2027-0