
引言
酪氨酸激酶2(TYK2)是一种介导免疫信号的非受体酪氨酸激酶,主要调控IL-23、IL-12 和I 型干扰素驱动的信号通路。作者从已知的激酶-铰链结合区开始,通过计算和结构设计,发现了ATP竞争性的吡唑嗪基系列TYK2抑制剂。在了解PK/PD关系的基础上,建立了一个平衡TYK2效价和选择性的靶向曲线。通过优化先导化合物(包括调节效价、选择性和ADME特性),从而确定临床候选药物PF-06826647。
研究内容
JAK蛋白家族包括JAK1、JAK2、JAK3以及TYK2,它们在结构上都有JAK同源结构域(JAK homology domain,JH),其中JH1结构域也称为激酶区。由于四种JAK亚型的高度同源性,开发TYK2选择性抑制剂具有很大的挑战性。所以目前批准上市的口服JAK激酶抑制剂,如托法替尼(图1)对TYK2都没有高度的特异性。
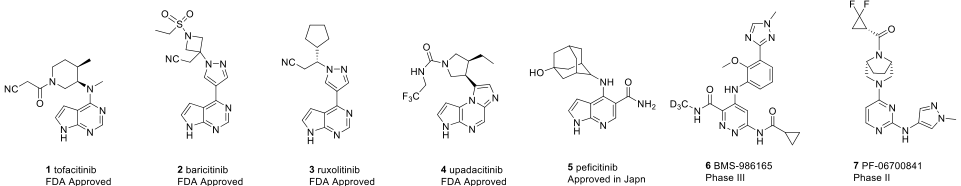
图1. 已上市或处于临床研究的JAK激酶抑制剂结构
图片来源于JMC
在检查四个JAK激酶的JH1-ATP位点时,发现TYR2的门控残基为Ile960,不同于其他三个JAK家族的缬氨酸,这种独特的氨基酸差异为合理设计TYK2抑制剂奠定了基础。图1中的JAK激酶抑制剂的嘧啶并吡咯基团与Glu979和Val981形成氢键作用时,会与Ile960的侧链发生空间碰撞(如图2a所示)。这在一定程度上解释了为什么化合物1、2和3与JAK1相比,TYK2的效价分别降低了30倍、20倍和5倍。设计一个不与Glu969的羰基相互作用的铰链结合基团可以解决与TYK2 Ile960的冲突。但为了弥补TYK2的效价,作者提出了一种[5,6]-稠环铰链结构,可以与Val981形成新的氢键作用(图2b)。这种设计策略在先前TYK2/JAK1双重抑制剂PF-06700841的开发中也得到了应用。
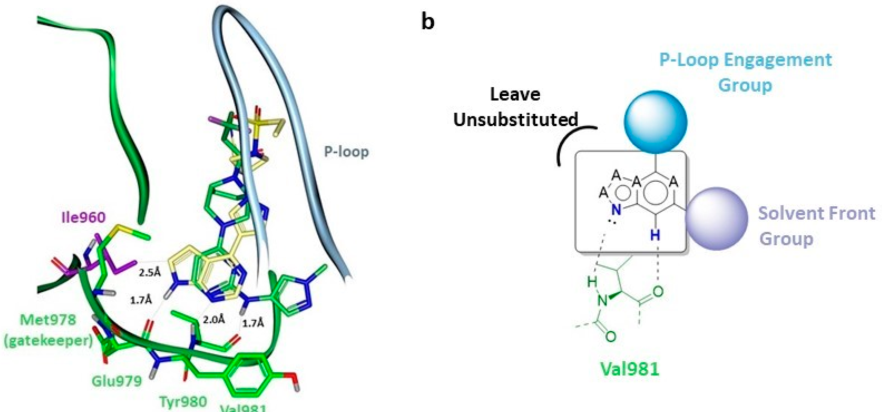
图2. (a)两种不同的TYK2铰链结合模式。(b)选择性TYK2 抑制剂铰链基序的设计策略
图片来源于JMC
芳环C−H极化以增加氢键电位被认为是实现TYK2活性和位点结合的必要条件。为此,基于先前已知的铰链基序设计合成了几种[5,6]-绸合芳香族体系。最初药物的构效关系模型,使用甲基吡唑部分作为溶剂前基,类似于PF-06700841;后来为了接合到P-LooP区域,采用了取代的三氟乙基氮杂环吡唑基团。作者以化合物8(IC50=290nm)芳环 C−H的静电电位,作为氢键供体能力的相对度量(图3)。向五元环的任一位置添加氮原子以适度增加C−H静电势,设计合成了化合物9和10。然而,化合物9仅为中等活性的TYK2抑制剂(IC50=476nm),化合物10则对TYK2无活性,IC50>10um。作者通过分析发现,在这两种情况下,增加的N原子不仅使得C7−H的静电势增加了,而且在五元环的2或3个位都增加了正电位(∼50 kJ/mol)。由于这些位置朝向亲脂性的门控残基,增加这个区域的极性可能导致了TYK2的效力降低。另外,化合物10的2位氮也可能与Glu979的羰基氧发生碰撞,导致TYK2活性完全丧失。
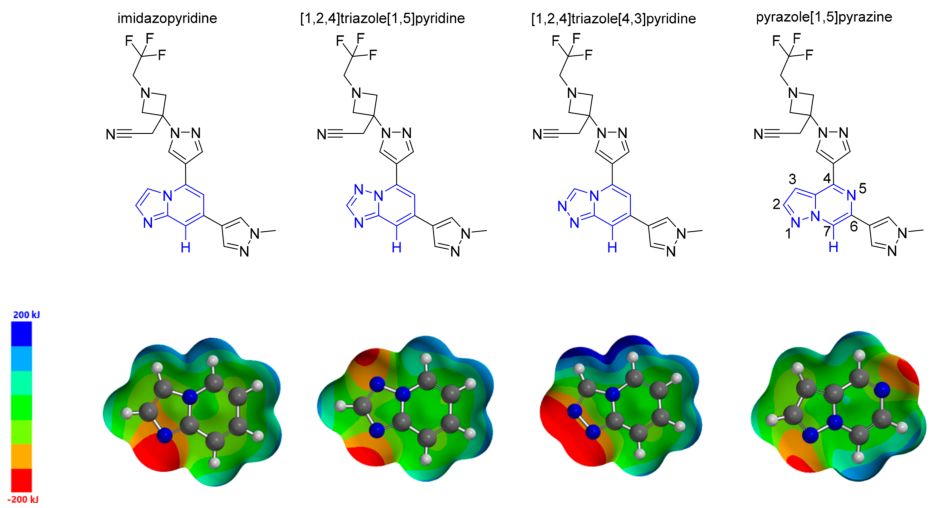
图3. 用Hartree−Fock 6-31G计算的[5,6]-稠环芳香族TYK2先导化合物(8−11)的结构和静电势图
图片来源于JMC
基于上述结果,作者开始转向六元环系统的修饰来提高效力。其中吡嗪并吡唑结构由于C-H极化增加了近122 kJ/mol ,引起了作者强烈的兴趣。其最负的N原子也朝向了溶剂区,避免了与蛋白之间的冲突。正如作者预料,化合物11的IC50为10nm,是一种有效的TYK2酶抑制剂,其亲脂性效率(LipE)为5.5。在确定了一种有效且高效的铰链结合基序后,作者对先到化合物11进行下一步优化,以提高其理化性质和JAK选择性。图4a为TYK2与化合物11的X射线晶体结构,和作者最初预期的结合模式一致,N1和极化的C7-H均与Val981形成氢键。三氟甲基氮杂环丁基通过与P环作用,增强TYK2激酶的效价。
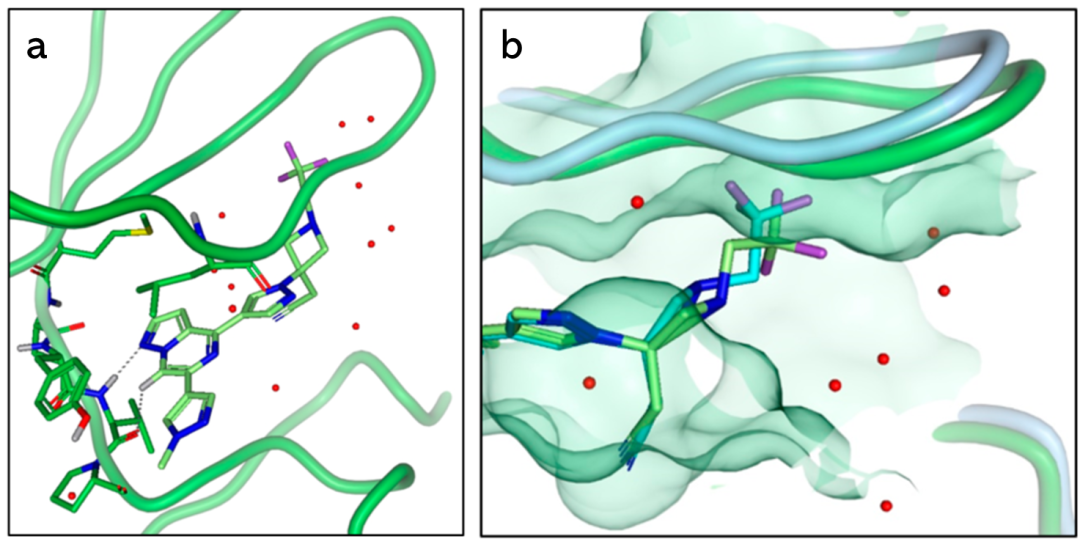
图4. (a)复合物11-TYK2的晶体结构(PDB ID:6X8F)。(b)复合物11-TYK2与11-JAK2(PDB ID:6X8E)的结构对比图
图片来源于JMC
化合物11中等的LipE反映了分子的高亲脂性,作者通过LipE引导氮杂环丁烷取代基的优化,提高效价和降低脂水分配系数,改善代谢稳定性。由于三氟乙氨基化合物与潜在代谢物的睾丸毒性相关,作者优选对其进行替换,设计合成了图5所示的一系列分子。结果显示,试图用环丙烷类似物来替换三氟基团无法提高效价。作者进一步尝试引入极性以降低清除率,同时保留三氟基团提供的TYK2效价,结果也是喜忧参半。化合物14中引入氮杂环丁胺可降低脂水分配系数,使人肝微粒体清除率(HLM)达到所需范围,但也导致药效显著下降。这可能是由于酰胺导致氮杂环丁烷变平,可能不允许乙酰基直接与P-loop结合。在该系列中,化合物16重现了化合物11的效价,也降低了HLM清除率,并将LipE提高到6.7。化合物16对JAK3和JAK1具有良好的选择性,但对JAK2的选择性只有5倍。
为了进一步了解JAK2选择性,作者获得了复合物JAK2与化合物11的X射线晶体结构,并与TYK2结构进行比较(图4b)。叠合JAK2和TYK2的蛋白结构,JAK2的P环相对TYK2略有升高。两种结构的叠加和电子密度显示化合物11相似的结合模式。据报道,与P-环的细微相互作用差异会影响其他JAK抑制剂的选择性。而在这个叠合的结构图中发现的唯一微小差异是氮杂环的结构。在JAK2结构中,氮杂环丁烷采用了一种“反式”结构,将末端-CF3基团朝向P-环。相比之下,TYK2氮杂环丁烷构型采用了“顺式”构型。根据所观察到的结果作者提出一个假设,即固定四元环构型可以用来提高选择性,环丁烷可以达到这个目标。作者制备了甲氧基环丁烷非对映体cis-17和trans-18,均保留了TYK2的效价(16和22nm),并且trans-18对JAK1(68倍)和JAK2(10倍)具有较高的选择性,与预期的一样,甲氧基环丁烷类似物的LogD增加。出乎意料的是,cis-17和trans-18的HLM清除率相差很大。两个非对映体顺/反异构体除了效价和选择性上的差异外,在清除率方面也表现出了有益的差异。其他设计合成的非对映异构体也表现出类似的概况。
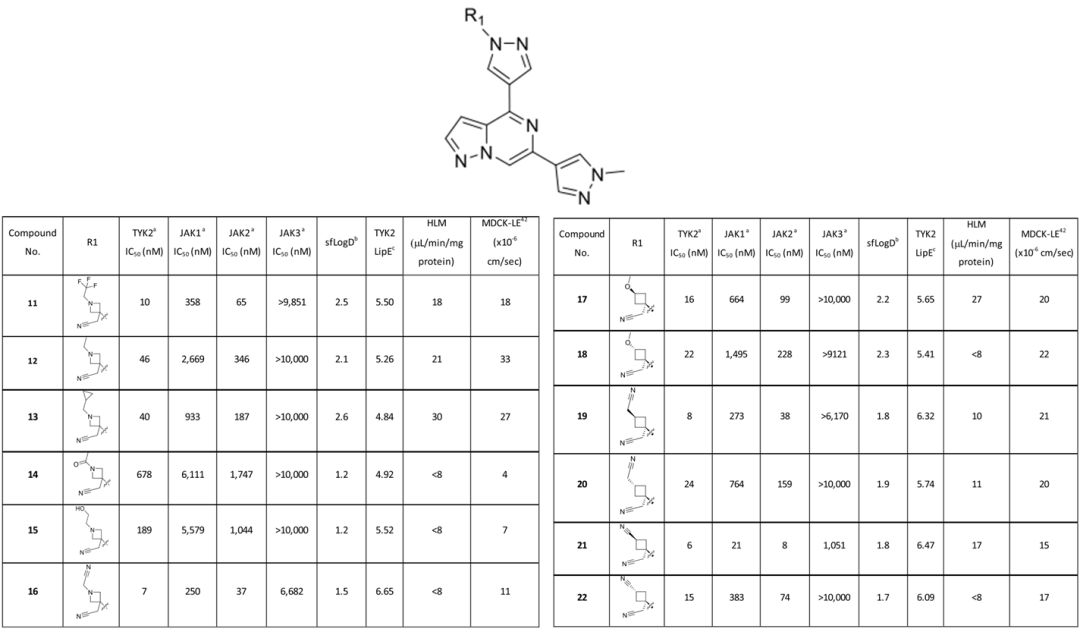
图5. 氮杂环丁烷取代基的构效关系研究
图片来源于JMC
为了更好地理解环丁烷类似物与TYK2的相互作用,作者解析了复合物TYK2与22的X射线晶体结构。顺式环丁腈部分位于P-环的下方并朝向其顶端(图6a)。P环末端主要含有疏水残基和一个氢键网络,在模拟apo态蛋白时,此区域的水分子很不稳定(高能水分子),通过结构叠合可以看到预测的高能水被22的环丁腈取代,同时口袋的静电图也显示了正的静电势,可以提供与氰基的良好相互作用。根据TYK2的效价、JAK选择性和低清除率,作者选择化合物22进一步研究吡唑基(R2)的药物的构效关系。同时,还对活性更强但JAK1选择性较低的trans-21进行了探索,以期望提高TYK2的选择性。假定吡唑上暴露的甲基具有低效的亲油性(图6b),去除甲基之后,效果并没有得到改善。为了提高NH-吡唑的渗透性,1H-3-吡唑允许互变异构体将N-H朝向核心氮,并通过分子间氢键屏蔽H-键供体,最后合成了1-甲基-3-吡唑类似物。作者选择了一组TYK2高效价和低体外代谢清除率(HLM<(8μL/min/mg蛋白质)的化合物,进行人类全血(HWB)细胞因子的分析,建立这些分析是为了确定关于疗效和非靶点效应的理想候选特征。最终一系列细胞和动物实验表明,化合物22(PF-06826647)表现出最理想的效果,被选为选择性的TYK2抑制剂进行临床研究。
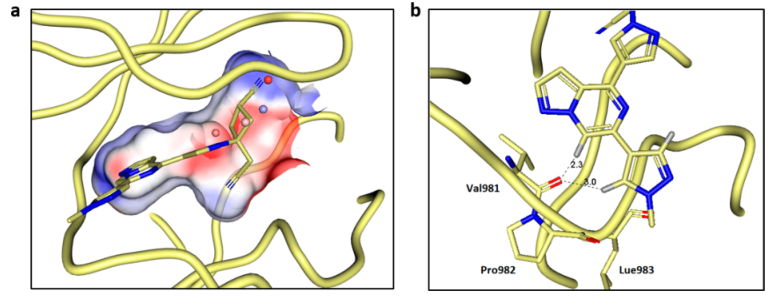
图6. (a)复合物22-TYK2的晶体结构的口袋静电势图(PDB ID:6X8G)。(b)化合物22与TYK2的结合模式,并标注了小分子与Val98的两点关键相互作用
图片来源于JMC
结论
本文讲述了辉瑞公司通过鉴定和优化一系列与JH1结构域ATP位点结合的TYK2抑制剂,发现了具有细胞和体内活性的小分子抑制剂。首先,基于结构特征和静电势模型确定了激酶铰链核心结构,提供了TYK2的效力,并且从一开始就对其他JAK家族成员表现出令人鼓舞的体外选择性。通过设计环丁烷类似物进一步优化,使之与P环结合,进一步提高TYK2的选择性以及平衡物理化学性质保证了该系列的高渗透性和低代谢清除率。通过在人全血检测中筛选、直接测定细胞因子信号,确定了JAK2选择性的平衡水平,揭示了JAK2和TYK2的复杂异二聚体伙伴关系。平衡地抑制TYK2和JAK2可促进IL-12和IL-23的抑制,同时维持重组人促红素抑制在合理范围内。经过这一系列的努力研发出了化合物22(PF-06826647),该化合物已经完成了健康受试者的一期临床实验,正在进行斑块状银屑病患者(NCT03210961)以及多个炎症性疾病适应症的二期临床研究中。
参考文献
Brian S Gerstenberger et al. Discovery ofTyrosine Kinase 2 (TYK2) Inhibitor (PF- 068266 47) for the Treatment ofAutoimmune Diseases. J. Med. Chem.(2020).