

两种新计算方法组成的工作流用于执行特定小分子结合任务。基于数据驱动的DEPACT可以设计和评估小分子结合的口袋能否作为独立的团簇,而PACMatch则是完成簇模型中的口袋残基与给定蛋白质支架上位置的匹配。
背景介绍
在设计具有生物传感器或酶等功能的蛋白质的项目中,一个主要任务通常是在现有蛋白质骨架中设计一个新的口袋,以创建一个能结合特定小分子和/或提供一个新的催化活性位点。执行此任务常用一种由内而外的方法,它包括两个主要步骤:第一个是团簇设计步骤,第二个是团簇-支架匹配步骤。团簇设计步骤目标是构建一个孤立的团簇口袋模型,该模型由围绕在目标小分子周围的未连接的蛋白质部分组成,以提供特定的蛋白质配体相互作用;每个蛋白质部分可以是一个氨基酸残基或几个残基组成的短肽片段(基序)。团簇-支架匹配步骤的目标是在候选蛋白支架上找到合适的主链位置来放置在团簇模型中的氨基酸残基(即口袋残基),因此,口袋残基(放置在支架上后)与配体之间的相对几何形状可以较好地再现孤立簇模型中相应的相对几何形状;这样,就可以将第一步设计的孤立团簇模型中的蛋白质-配体的特异性相互作用转移到第二步设计的嵌入蛋白质受体的口袋中。
目前口袋设计方法中考虑的分子相互作用主要是基于物理模型来描述的,对于溶剂化这样的重要效应只能简化处理,存在精确度的问题。另一方面,当使用现有的蛋白质设计方法来选择theozyme模型中没有考虑的侧链时,很难设计由水分子或金属离子介导的蛋白质配体相互作用。
主要内容
中国科学技术大学的陈泉和刘海燕团队,提出并实现了一种数据驱动的方法来独立的从头设计结合口袋的团簇模型。该方法利用了现有的蛋白质-小分子复合物结构,如口袋嫁接方法,并且克服了口袋嫁接的缺点。DEPACT寻找合适的子袋是通过(自动)搜索已知结构的蛋白质配体复合物(即模板复合物)的数据库来找到的,而且提供了一个统计评分功能来对配体-袋相互作用的强度进行排序。PACMatch工具则可以执行团簇-支架-匹配步骤,能够有效地处理约10个口袋残基的团簇模型。相关的研究成果以“DEPACT and PACMatch:A Workflow of Designing De Novo Protein Pockets to Bind Small Molecules” 为题发布在国际著名期刊Journal of Chemical Information and Modeling上。
数据下载
https://github.com/chenyaoxi/DEPACT_PACMatch.git
DEPACT工作流程
图1展示了DEPACT的工作流程。DEPACT的目标是为配体的结合口袋生成团簇模型。每个团簇模型都是一组不连接的蛋白质部分(最有可能是分离的氨基酸残基),它们以特定的三维结构排列在配体周围。DEPACT设计的口袋由从PDB中已知的蛋白质配体复合物(模板复合物)结构中提取的子口袋组成。
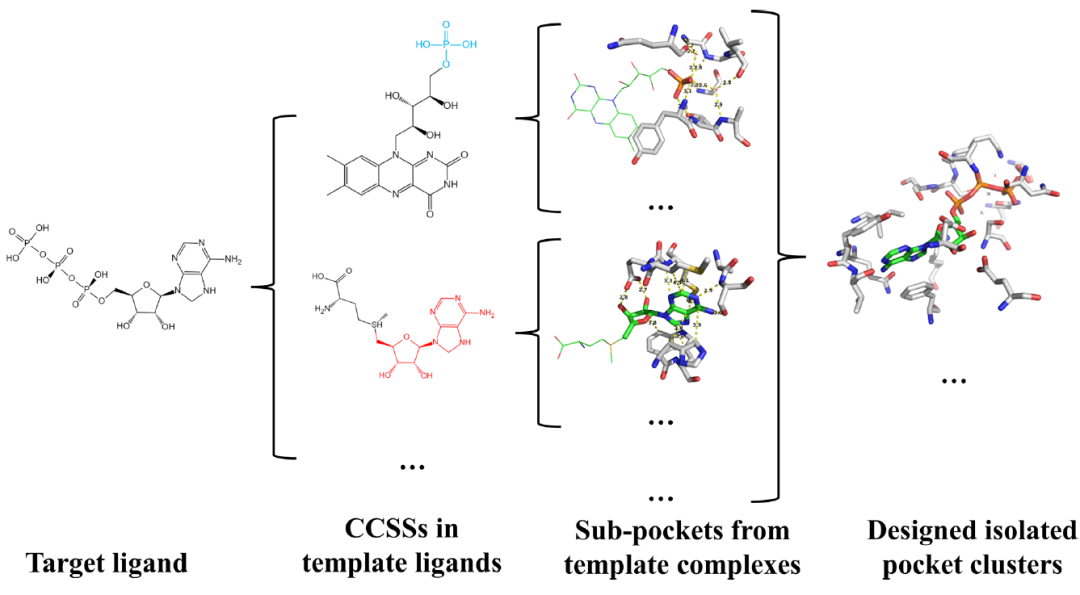
图1. DEPACT工作流程。图片来源:JCIM
DEPACT主要有三个部分:
1. 使用一组用户定义的化学上不同的“基本片段”作为识别CCSS(共同化学子结构)的基本单元。
2. 使用图论最大团算法来寻找目标配体和模板配体之间的CCSS。
3. 使用一个从PDB中所有蛋白质-小分子配体复合物的结构推导出来的统计评分函数来评估蛋白质-配体相互作用的强度。
PACMatch的图表概述
PACMatch的目标是在蛋白质支架上找到放置袋状残基的位置,这样袋状残基团簇就可以转移到支架上,口袋残基适当连接到支架主干,同时保持其相对于簇模型中的目标配体的关键几何特征。图2详细地说明了这个过程。
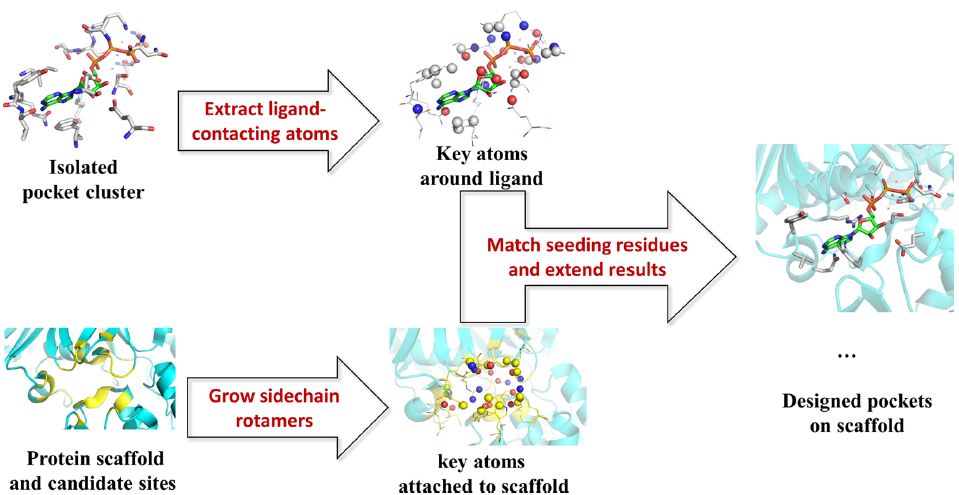
图2. 整个PACMatch过程的图表概述。图片来源:JCIM
DEPACT评分功能区分有利和不利的物理相互作用
研究者检测了蛋白质结构1YDB的配体结合口袋(图3)。绝对值较大的负值(低于−1)的蛋白质残基都似乎与配体有很强的相互作用。有利的相互作用包括氢键(GLN92、GLU106、THR200)、疏水(VAL121、PHE198)和金属介导的相互作用(HIS94、HIS96、HIS119和ZN)。高于−1的分数始终与缺少有利相互作用的口袋残基相关,包括PHE131、SER197和PRO201。
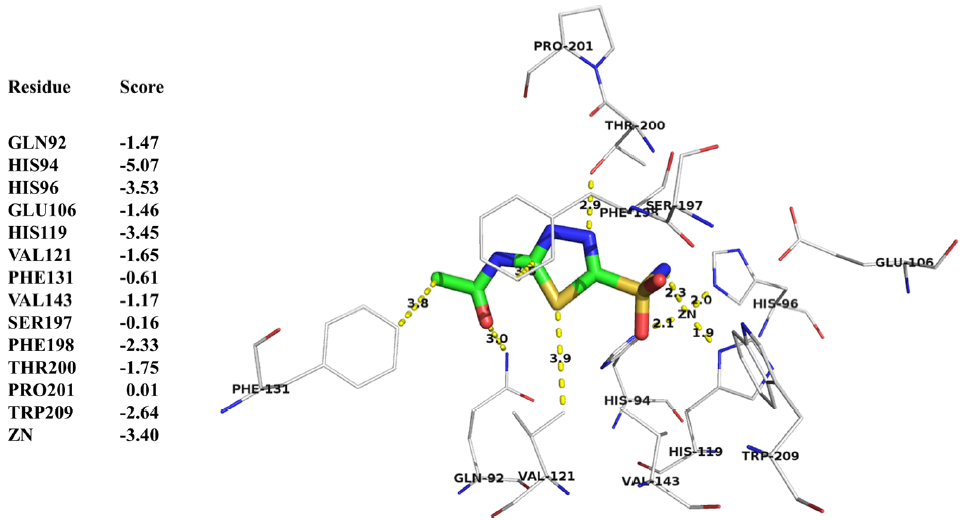
图3. 蛋白1YDB口袋残基的DEPACT评分。图片来源:JCIM
DEPACT设计出与天然口袋化学环境相似的口袋团簇
从图4A可以看出,在10个被检测的靶标配体中,DEPACT设计的口袋所覆盖的自然口袋化学环境元素的百分比均可达到70%以上。几种配体的覆盖率均在90%以上。这些结果表明,一些全新的DEPACT设计的口袋,在很大程度上恢复了各自的自然口袋的化学环境,可以承载相同的配体。与此同时,对于相同的配体,其他DEPACT设计的口袋与自然口袋相比形成了相对新颖的整体化学环境,它们仅覆盖了40-70%的天然口袋元素。
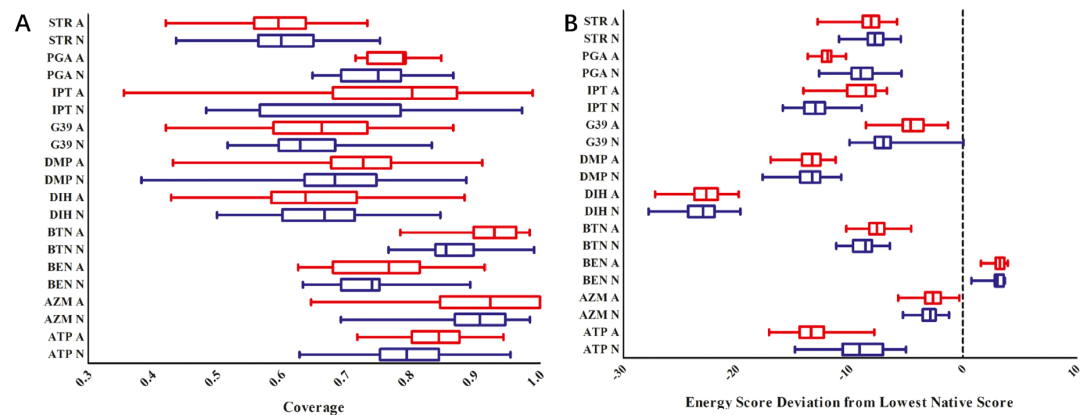
图4.(A)由DEPACT设计的口袋簇覆盖自然口袋结合环境中的物理化学元素,(B)设计口袋簇的DEPACT得分与相应自然口袋簇得分的偏差。图片来源:JCIM
图4B表明对同一靶标,设计袋簇相对于自然袋簇的DEPACT得分。对于10个检测的目标配体中的9个,设计的口袋簇的DEPACT分数显著低于各自的自然口袋。这些口袋簇包括自然口袋中物理化学元素覆盖率低的那些,表明由DEPACT组成的新型口袋仍然具有强烈的有利的蛋白质-配体相互作用。
设计金属-离子或水介导的蛋白质配体相互作用
在图5中,研究者比较了配体乙酰唑胺(PDB ID: 3ML5)天然配合物中锌介导的蛋白-配体相互作用的配位几何构型,以及DEPACT设计的口袋簇中锌介导的配位几何构型。可以看出,天然构型和设计构型具有相同类型的蛋白残基,其结构与锌的配位方式高度相似。
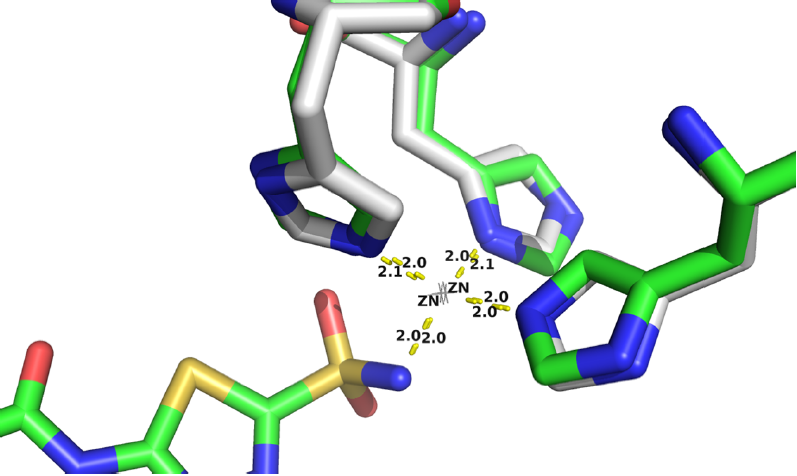
图5. 自然(绿色)和设计(灰色)锌配位构型的对比。图片来源:JCIM
DEPACT为10个测试配体设计的大量口袋包含了间接相互作用。通过比较这些设计的口袋与大量PDB配合物中含锌的天然口袋的键长、键角和锌中心配位数的分布。作者发现,DEPACT设计的金属离子中心具有物理合理的配位几何形状。对DEPACT设计的袋中,水分子的氢键几何分布与自然袋中水分子的氢键几何分布进行比较。设计的水介质与自然的水介质相互作用的几何特征分布相似,说明DEPACT设计的水介质接触也是合理的。
PACMatch能够正确地恢复天然酶的催化残基和底物接触残基的位置
图6显示了与通过PACMatch恢复的袋状结构相比,结合基板的几个自然袋状结构,这些袋状结构是根据播种残基的匹配KAs平移和旋转从原始复合物中提取的孤立团簇模型产生的。 图6A、B分别显示了成功的TS模型匹配和完全口袋匹配的典型结果,大多数口袋残基的底物位置和侧链构象已被恢复。对于酶L-Fuculose-1-phosphate aldolase (PDB ID:4FUA),得分最高的PACMatch结果正确地恢复了大部分口袋残基的原始位置,但对口袋残基GLU提出了不同的位置(从原来的位置73到新的位置131,如图6E所示)。在另一个匹配结果中(排名第三),所有4FUA口袋残基的原始位置都被正确恢复(图6F)。然而,图6E所示的结构并没有出现明显的缺陷,将GLU放置在不同的支架位置也可能是一个好的设计。
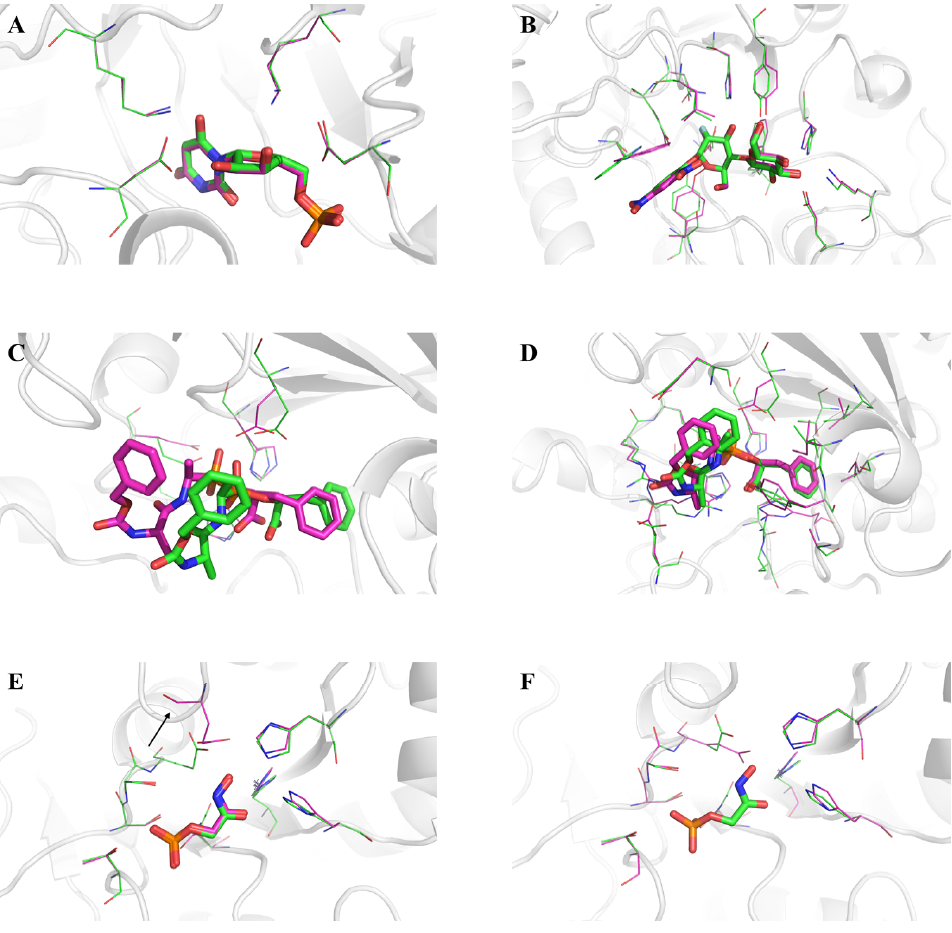
图6. PACMatch结果的案例。图片来源:JCIM
DEPACT和PACMatch的完整工作流程示例
从图7A可以看出,将PACMatch应用于得分最低的DMP的天然口袋簇及其对应的天然支架,可以恢复所有天然口袋残基的原生位置和构象。将得分最高的DEPACT设计的袋状残基与同一支架相匹配时,15个(设计的)袋状残基中有10个成功放置在支架上(图7B)。此外,这些成功放置的口袋残基的DEPACT总分为−25.46分,低于得分最低的自然口袋群(−21.63分)。在这些成功放置的袋残基中,有4个是不同类型的,而对应的原残基占据了匹配的位置。因此,在PACMatch的指导下,似乎有可能在真正的蛋白质支架中实现由DEPACT设计的新颖的、非自然的蛋白质配体相互作用。DEPACT和PACMatch工作流的这个结果,可以看作是对蛋白质袋的合理重新设计。
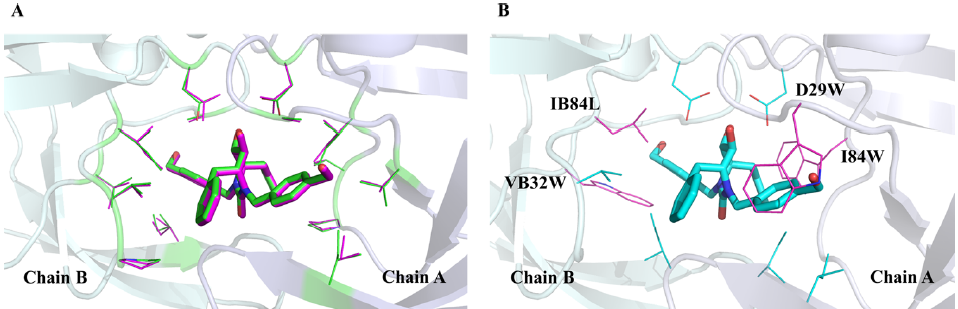
图7. 将天然和设计的DMP口袋簇与蛋白支架匹配的比较(PDB代码:1QBS)。图片来源:JCIM
结论总结
本文提出了在蛋白支架中设计配体结合口袋的DEPACT-PACMatch工作流程。DEPACT能够设计自然袋状化学成分和蛋白质配体相互作用强度的口袋簇,以及设计由水分子或金属离子介导的蛋白质-配体相互作用。PACMatch通过将簇模型中的KAs与支架上的KAs进行匹配,将残基放置在蛋白支架上的口袋簇中。PACMatch的两步计算过程能够有效地处理约10个口袋残基的簇。
与其他用于骨架取样和氨基酸选择的计算工具适当集成,DEPACT-PACMatch工作流可以为配体结合蛋白(如酶和生物传感器)的总体设计方案提供有用的方法。
参考文献
Yaoxi Chen, Quan Chen, and Haiyan Liu, DEPACT and PACMatch: A Workflow of Designing De Novo Protein Pockets to Bind Small Molecules, Journal of Chemical Information and Modeling 2022 62 (4), 971-985 DOI: 10.1021/acs.jcim.1c01398.