

RNA结合蛋白Lin28是一种重要的多能因子,可重编程翻译并促进癌症进展。本文作者结合NMR结构数据、MD和细胞实验,揭示了Lin28通过其冷休克结构域进入YB-1包装的mRNA的机制。
背景介绍
并不是所有成熟的信使RNA进入细胞质后都会被翻译。有些mRNA储存在细胞质中到适当的时间和位置才激活。为了保持mRNA处于休眠状态,mRNA被包装成核糖核蛋白复合物(称为“mRNPs”),使它们无法与核糖体接触。mRNPs的主要蛋白质成分为YB-1(Y-box-binding蛋白质,YBX1基因),一个在细胞质中富集的mRNA-结合蛋白。YB-1可沿着mRNA进行非特异性聚合,形成不可翻译的串珠结构,但当激活发生时,也能将mRNA展开成可翻译的核蛋白丝。
本文探讨了Lin28相关的mRNPs的结构-功能关系。Lin28(Lin28a)是胚胎发育过程中表达的重要重编程因子,与多能性有关。虽然Lin28一般不存在于成熟组织中,但会在几种癌症中重新表达,能促进癌细胞生长,对癌症治疗有一定耐药性。为了研究Lin28在干细胞和癌细胞中的独立功能,作者结合NMR结构数据、微管实验以及动力学模拟,对Lin28和YB-1的作用机制以及其在细胞中的功能进行了探讨。
正文
为了研究Lin28与YB-1的关系,作者首先使用微管网络作为细胞内的工作台,证明了Lin28与YB-1间在细胞质中的共定位。实验发现,在HeLa细胞中,Lin28能混合于富含YB-1的区室,但不能与FUS, HuR, G3BP-1, LARP-6等其他RNA结合蛋白混合(图1 a-c)。并且,这种共定位现象又再一次通过邻位连接技术(PLA)实验得到了再验证(图1 d)。
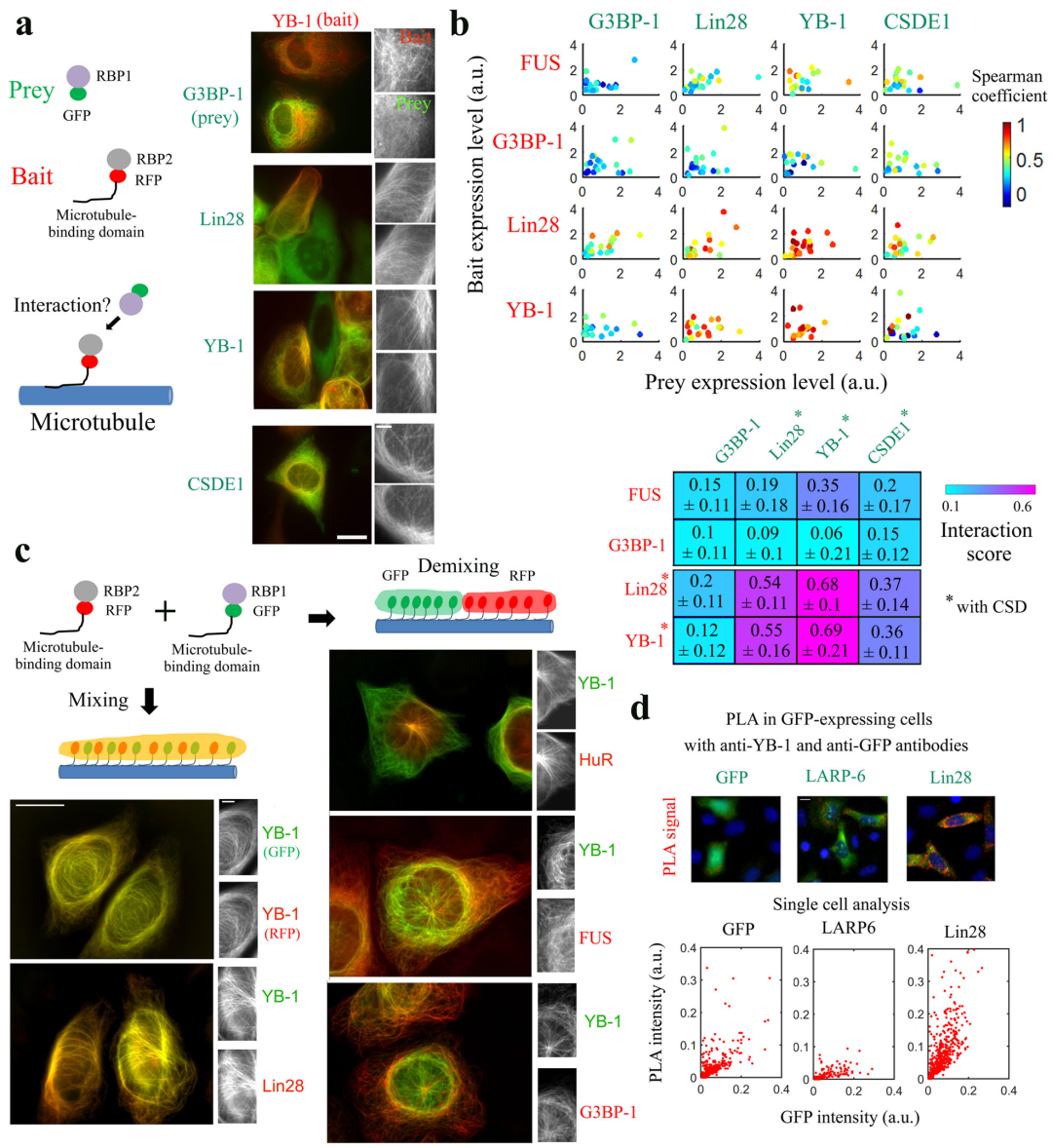
图1. 微管实验和PLA实验结果。 图片来源:NCB
由于YB-1和Lin28的冷休克结构域(CSD)具有同源性,作者猜测CSD介导的与mRNA的协同结合可能为它们在细胞内的相互作用提供良好的结构基础。为了验证这个假设,作者表达了Lin28的两种不同的截短体:Lin28-N-ter 和 Lin28-C-ter,并通过微管实验证明了CSD在YB-1和Lin28共定位之间的关键作用。接着,又使用凝胶迁移实验再次证明了这一想法(图2c),提出CSD在二者结合之间的重要性。随后,作者用核磁共振(NMR)分析了在单链核酸(RNA, ssDNA)存在的情况下Lin28与YB-1的相互作用(图2a)。对Lin28-CSD和YB-1-CSD与ssDNA结合的对比分析表明,它们与单链核酸有着类似的结合模式(图2b)。
为了进一步解释YB-1和Lin28在长单链核酸上这种协同结合作用的结构基础,作者使用了一个至少可接受两个CSD的、20nt长的 Poly(C) ssDNA进行实验。当15N-Lin28-CSD与20nt长的ssDNA 在YB-1-CSD浓度增加时相互作用,峰值强度下降(图2d)。此外,峰高的降低主要发生在β-桶结构域的残基上,表明CSD沿着ssDNA紧密堆积。
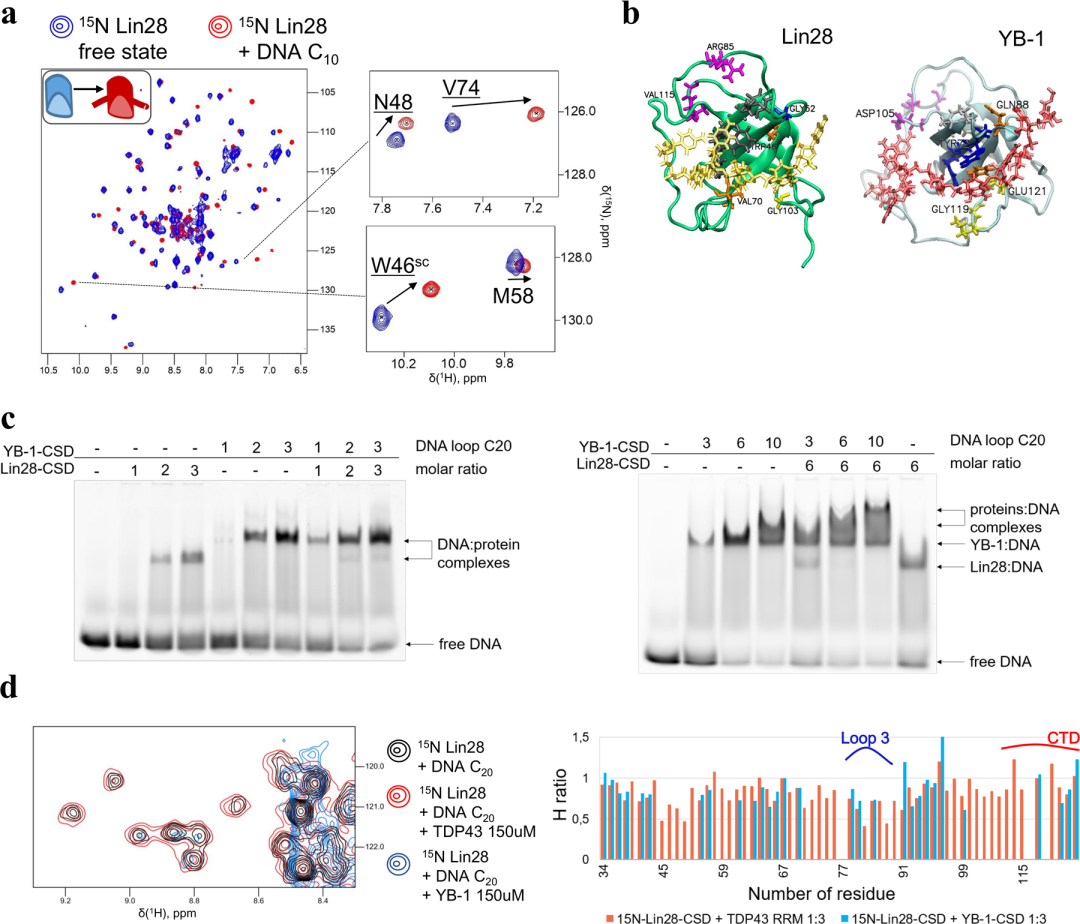
图2. Lin28和YB-1在单链核酸上混合的NMR分析。图片来源:NCB
已知在CSD中与核酸相互作用的保守残基显示出在核酸存在时对Lin28和YB-1的类似化学扰动(CSP)。如图3a和b,CSP分析显示了许多可能参与Lin28和YB-1与ssDNA协同结合的残基。接着在20nt Poly(C) RNA和ssDNA的存在下,作者添加未标记的Lin28-CSD或YB-1-CSD,对15N-YB-1-CSD进行了类似的NMR分析(图3b)。CSP再次在相似的区域被检测到,这些区域例如Lin28-CSD(例如Loop3),C端末尾的β-折叠3以及C端结构域(CTD),强调了这些区域在Lin28和YB-1单链核酸合作结合中的可能贡献。
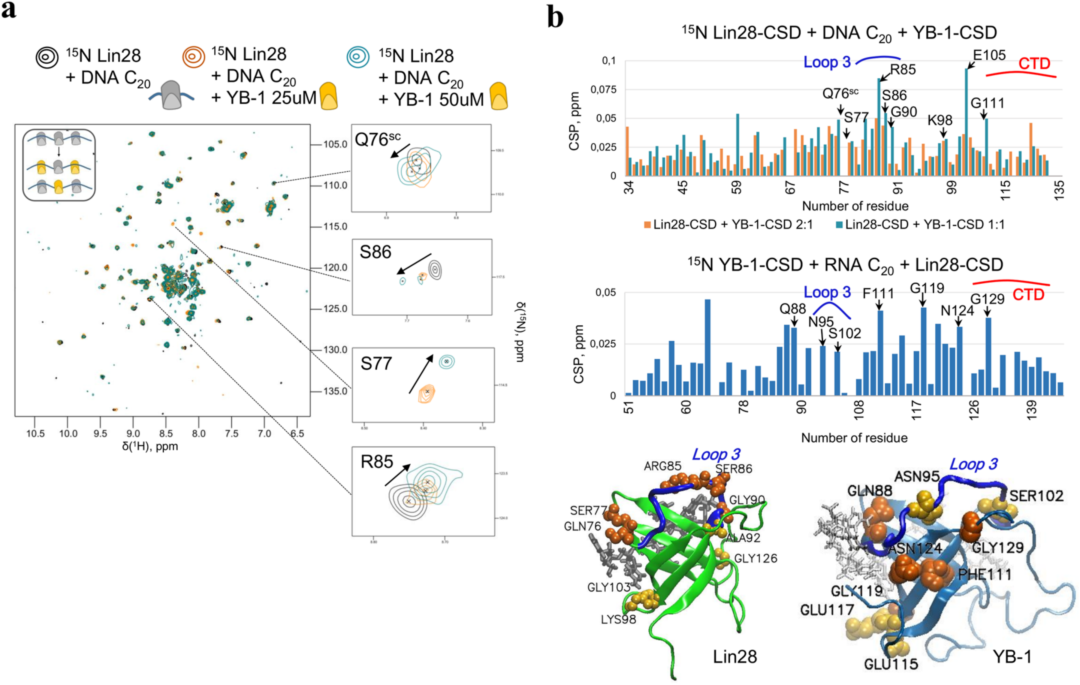
图3. 对Lin28残基在Lin28和YB-1与单链核酸的可能的协同结合作用的鉴定。图片来源:NCB
研究者发现,当多聚化时,在β-sheet 3的c端,Lin28的Q76/S77和YB-1的Q88/T89表现出CSPs(图3b),暗示着它们可能对CSD与核酸的协同结合存在贡献。作者还考虑了CTD开端的G114/V115残基和两个正电荷残基R122/R123,它们可能对Lin28 CTD到连续CSD的静电桥接做出贡献。
随后,作者在HeLa细胞中测量了YB-1和18个Lin28突变体的混合/分离。实验结果显示,YB-1与能与Lin28混合的很好,但是与阴性对照G3BP间显示出明显的分离感(图4a)。对Lin28上的混合突变显示,有6组氨基酸突变:F47A、Q76A/S77A、R85A、R85A/S86A 、K98A/K99A、R122A/R123A能显著影响YB-1/Lin28的混合(图4b-d),表明这些氨基酸残基在二者结合之间的重要性。
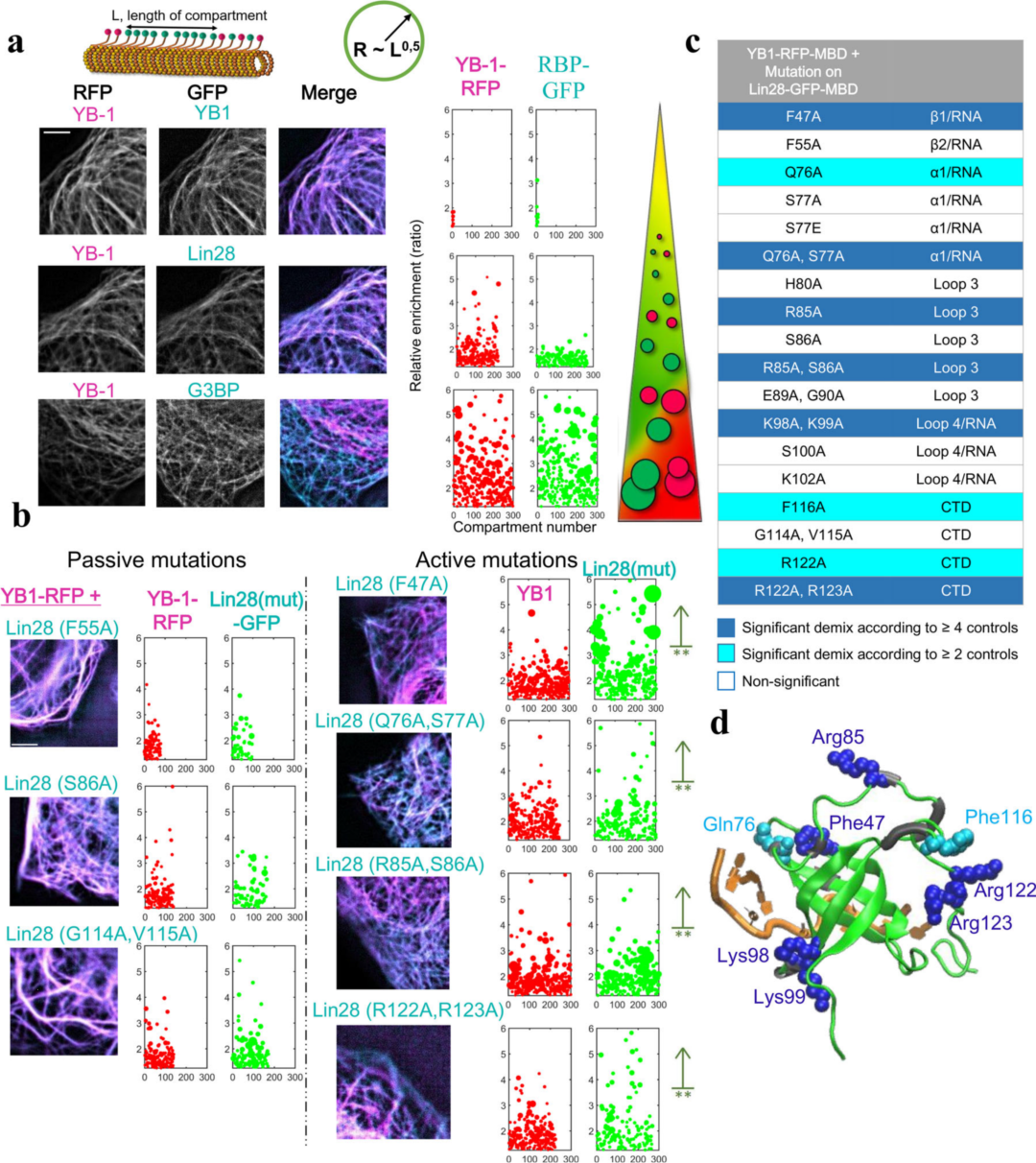
图4. 微管平台实验结果。图片来源:NCB
研究者使用YB-1的三聚体与Poly(C)RNA的NMR结构,结合MD实验,进一步研究了这些氨基酸残基在YB-1和Lin28结合中的作用。研究者发现,Lin28-CSD能够取代三聚体中的YB-1,同时保持相邻YB-1-CSD与RNA的结合(图5a,b)。此外,MD结果显示,Lin28在RNA上形成了稳定的同源三聚体。Q76和S77在Lin28/YB-1或Lin28/Lin28界面上与RNA产生强烈的相互作用(分别为−104.25和−72.46 kJ/mol),对比阴性对照结果得出Q76和S77的作用为促进CSD与RNA的协同结合(图5b)。
由于生成稳定三聚体的关键步骤也依赖于带正电荷的CTD,而CTD需要指向位于下一个CSD附近的核酸主干,因此构成了YB-1和Lin28共享的桥接系统(CSD +一个带正电荷的CTD)。这一观点与Lin28 CTD (R122A/R123A)中和两个带正电的精氨酸残基后观察到的显著分离作用一致,这些突变应该扰乱了CTD的静电桥接。另外,当R85/S86突变为丙氨酸后,降低了Loop3的动力学,并修改了其与CTD残基的相互作用。MD分析更倾向于认为Loop3中的K88-E91与位于CTD起始位置的I118-R122之间存在分子内相互作用(图5a)。
实验显示,YB-1中与Lin28中保守残基G119/S120对应的G135/S136的共振峰在Lin28存在时,分别重新出现或发生位移。根据MD结果,G135/S136也可能参与了Loop3与CTD之间的YB-1分子内相互作用。随后,作者使用微管作为纳米平台,从实验上探讨了G119/S120在Lin28与YB-1及其自身混合中的作用。G119A/S120A双突变诱导细胞内显著的分离,证明Lin28 Loop 3和CTD前端之间的分子内相互作用在YB-1和Lin28之间的混合中发挥了关键作用(图5c)。这些结果指向了一个分子内相互作用,负责指示CTD的方向,使YB-1和Lin28沿着mRNA的合作组装成为可能。
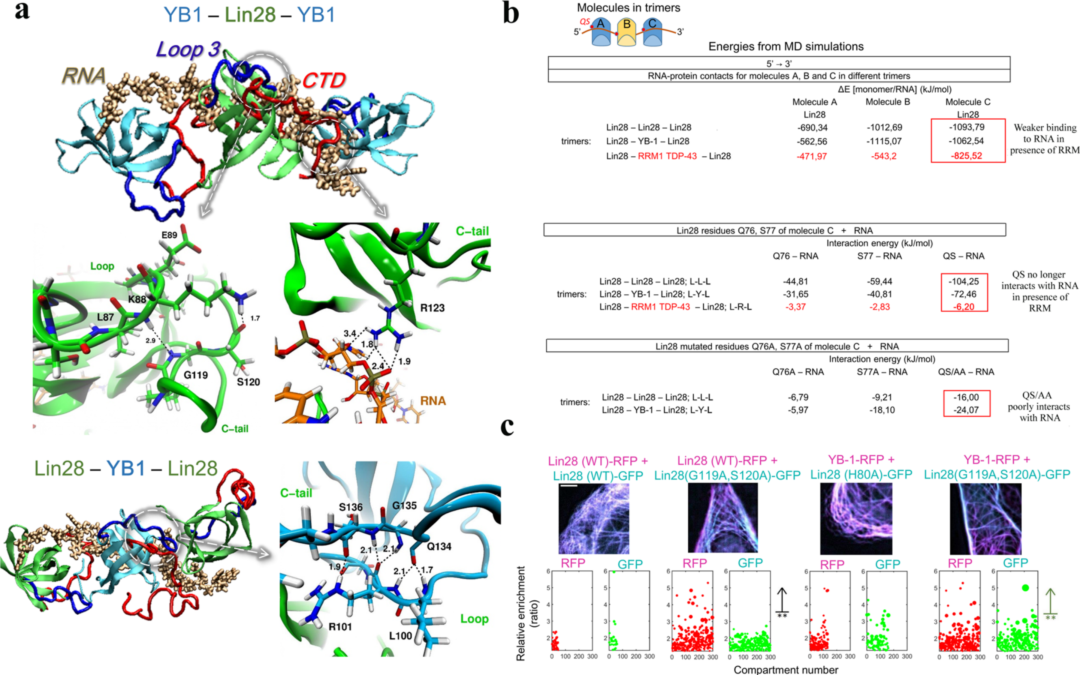
图5. Lin28和YB-1异质三聚体的MD数据表明了在RNA存在下YB-1和Lin28混合的机制。 图片来源:NCB
作者使用免疫共沉淀实验进一步分析了Lin28和YB-1相互作用的条件。结果显示,Lin28和YB-1的协同结合只有在RNA存在下存在,并且双突变体Lin28RS(R85A/S86A)及Lin28QS(Q76A/S77A)均显示出对Lin28和YB-1协同结合的破坏(图6a)。
应激颗粒是一种液体样室,mRNA聚集在其中以重组对应激的翻译反应。作者发现,与Lin28相比,在表达LARP6或G3BP-1的细胞中,YB-1在这些应激颗粒中的存在减少,YB-1与Lin28在应激颗粒中的结合相对更好(图6b)。使用内源YB-1和Lin28突变体Lin28-RS和-QS研究YB-1/Lin28在应激颗粒中混合发现,Lin28-RS和-QS的突变微弱地改变了Lin28和YB-1之间的混合/分解,但没有显著破坏二者对mRNA的亲和力,也没有完全破坏Lin28和YB-1之间的相互作用,并且野生型和Lin28突变体的空间分布非常相似。
此外,作者使用CellProfiler软件在单个细胞水平上自动测量了YB-1和Lin28在亚砷酸盐处理的细胞的应激颗粒中的富集(图6c),结果表明YB-1和Lin28在应激颗粒中的富集呈线性关系。
接着,作者通过siRNA降低YB-1的水平,进一步探究Lin28和YB-1在应激颗粒中的相互作用。如果富集在应激颗粒中的Lin28稳定了YB-1的存在,那么应激颗粒中YB-1的下降幅度应该小于细胞质中YB-1的下降幅度。结果显示,通过siRNA降低YB-1的表达后,应激颗粒中YB-1的相对富集量有适度但显著的增加。这种增加在Lin28-DE突变体(阴性对照突变体)表达时仍然显著,但在Lin28-RS和-QS突变体中则不显著(图6c)。这证明Lin28-RS和-QS突变体与YB-1的弱结合可能与富含mRNA的应激颗粒有关。
除上述数据外,免疫共沉淀及RT-qPCR实验共同显示,野生型Lin28比Lin28-RS突变体对细胞mRNA的亲和力更高(图6d,由于Q76/S77与RNA相互作用,本实验未考虑Lin28- QS突变体,图5b)。考虑到Lin28-RS和YB-1与mRNA的协同结合的改变,YB-1可能是Lin28-RS与mRNA结合的竞争对手。此外,通过siRNA降低YB-1的表达显著增加Lin28-RS对mRNA的亲和力,但对于野生型Lin28其对mRNA亲和力没有显著影响,这可能是因为Lin28除了与不含YB-1的mRNA结合外,还与富含YB-1的mRNA结合(图6d)。
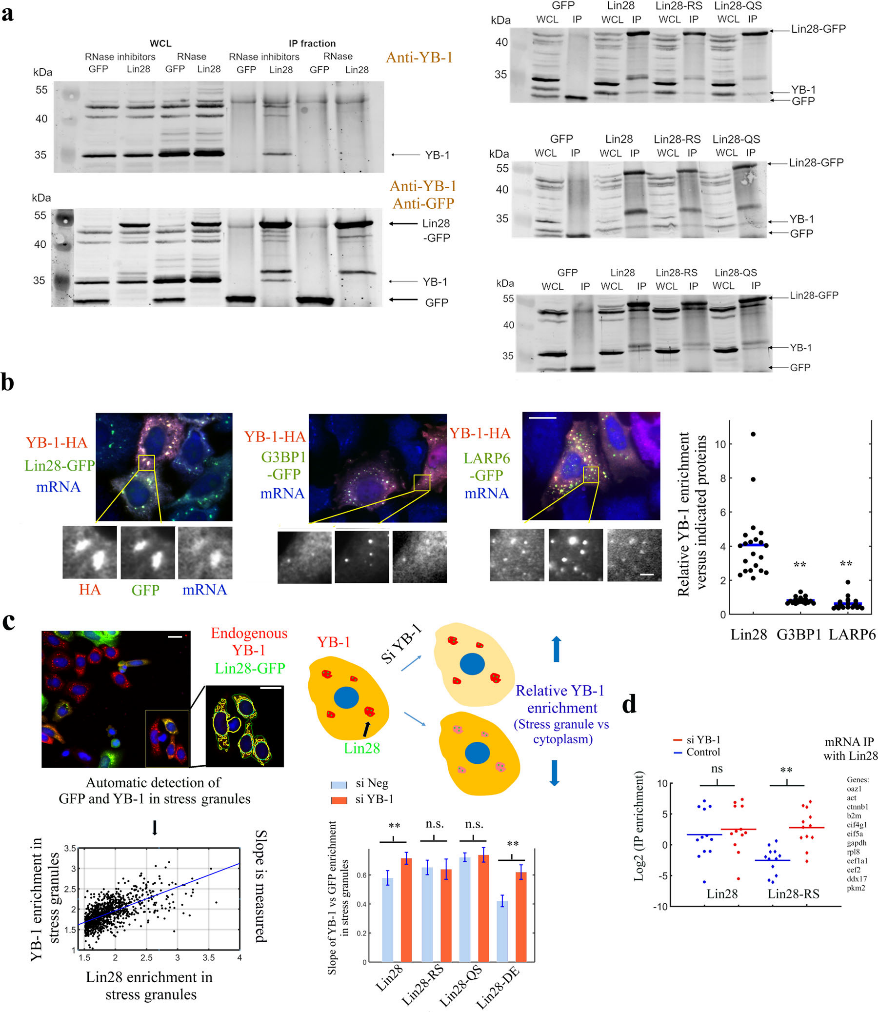
图6. Lin28和YB-1在细胞中的相互作用。图片来源:NCB
此外,作者还发现,细胞内Lin28的表达会抑制HeLa细胞的细胞增殖率,并且这一增殖率的降低可以随着YB-1的表达减少部分恢复。YB-1过表达抑制了神经元的延伸,而Lin28能通过YB-1依赖的方式促进突触的形成,而不是依赖或叠加效应。这也是对Lin28-YB-1与mRNP相关的可能功能的初步提示。
讨论
本文通过MD及细胞实验揭示了Lin28和YB-1与单链核酸协作结合的分子机制,发现了Lin28与YB-1在应激颗粒中的合作关系,以及Lin28在HeLa细胞中对细胞增殖的依赖控制。通过对组织和胚胎发育过程中的基因表达的分析,指出了Lin28和YB-1在体内的功能联系。最后,作者提出了Lin28和YB-1相互作用的机制模型,这将有助于进一步探索Lin28对癌症和神经系统疾病的贡献。
参考文献
Samsonova, A., El Hage, K., Desforges, B. et al. Lin28, a major translation reprogramming factor, gains access to YB-1-packaged mRNA through its cold-shock domain. Commun Biol 4, 359 (2021). https://doi.org/10.1038/s42003-021-01862-3