
引言
天然产物抗生素作为治疗药物的特性通常很差,并且受制于共同进化产生的耐药机制。改进供人类使用的天然抗生素的主要方法是半合成,即通过对生物生产获得的天然产品进行化学修饰。这种方法改善了许多天然产物的药理特性,但在克服耐药机制方面仅取得了有限的成功。最近,化学方面的进步使人们能够通过完全合成的途径获得抗生素,从而提供新的方法来克服耐药性。
链球菌素抗生素由两个结构不同的组分(A和B)组成,它们通过协同作用,抑制细菌核糖体,在许多生物体中实现杀菌活性。A组抗生素与肽基转移酶中心(PTC)结合,并增加与邻近新生肽出口通道的B组分的亲和力。与其他以PTC为靶点的抗生素类似,对A组链阳菌素的耐药可通过F (ABC-F)家族蛋白的AYP-结合盒来去除抗生素,或通过Cfr甲基化23S rRNA的A2503来阻止结合。A组链球菌的特异性耐药机制是弗吉尼亚霉素乙酰转移酶(Vats)失活。这些蛋白质乙酰化C14醇,导致空间干扰和关键氢键的破坏。
在这里,加州大学旧金山分校 Ian B. Seiple团队报道了具有广泛结构变异的A组链球菌素抗生素的设计、合成和抗菌评价。利用冷冻电子显微镜和量子化学计算,研究者描述了8个类似物与细菌核糖体在高分辨率下的结合,揭示了延伸到肽酶tRNA结合位点的结合相互作用,以及与占领初期肽出口通道的协同结合物的结合。其中一种类似物对几种耐链球菌的金黄色葡萄球菌具有极好的活性,在体外乙酰化率降低,并能有效降低小鼠感染模型中的细菌负荷。
基于结构的合理设计
在此,研究者假设A组链阳菌素可以被设计成避免Vat乙酰化,同时维持或改善核糖体结合。同时,选择天然产物维吉霉素M2 (VM2)作为起始骨架,因为它能够通过C16氟化作用转化为更活跃的类似物(例如flopristin, 4)。为了指导模拟物设计(在克服Vat结合的同时保持核糖体活性),研究者获得了2.5-Å分辨率的冷冻电子显微镜(cryo-EM)结构,完全合成的VM2与大肠杆菌50S核糖体结合。核糖体作为低温电子显微镜样品的优势特性使密度的特性得以保证,而通过力场引导的改进使模型得以保证,这两方面都促进了模拟物的设计。研究发现,结合决定因素与其他相关的A组链球菌结合细菌和原始核糖体的共结晶数据一致。
在核糖体中,VM2上的C3异丙基参与与U2585表面的疏水相互作用,但在其他方面缺乏结合相互作用,并向tRNA P-位点投射,这表明C3修饰是可耐受的。同样,C4甲基和C6质子也没有发生结合作用,且在出口通道中呈向B组链阳菌素结合位点倾斜。相比之下,抗性酶VatA的诱变和结晶学鉴定了这些基团(C3异丙基、C4甲基和C6质子)和乙酰化所必需的结合位点残基之间的关键相互作用。这些位点的结构修饰可能会破坏VatA结合并克服Vat抗性,但目前只报道了在其中一个位点修饰的半合成链阳菌素(C5-C6烯烃氢化)。这些部位的广泛半合成修饰限制了缺乏官能团的化学选择性激活。
结构类似物的模块化合成
为了直接验证C3和C4结构修饰可以克服基于vat的抗生素耐药性的假设,研究者首先开发了具有前所未有的结构多样性的A组链阳菌类抗生素合成管道。研究者的A组链菌素路线(例如图1a中的VM2)包括7个简单的、可单独分散的化学构建块的聚合组合。图1a所示的路线具有技术改进的特点,通过左右、半序列提高了产量,分别为(31%到40%)和(18%到28%)。
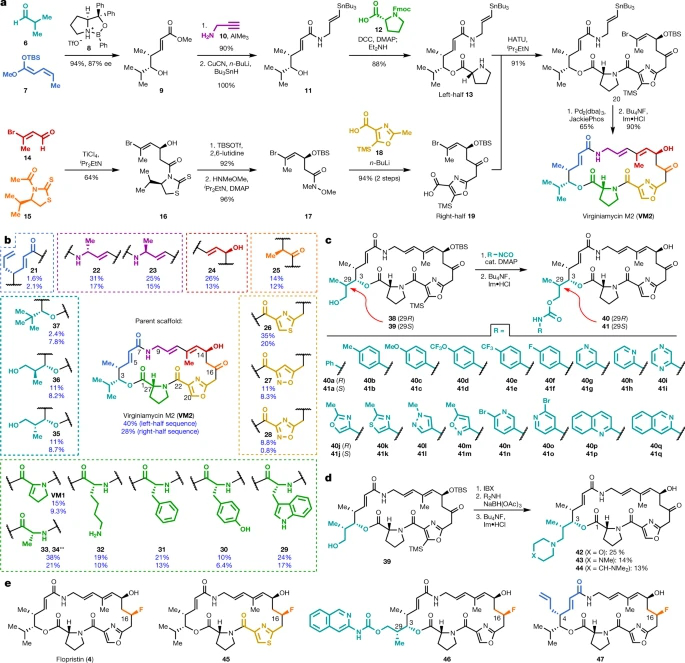
图1 模块化合成获得了60多种全合成的A组链阳菌素类抗生素
通过构建块变异,研究者制备出了18种链球菌蛋白,包括天然产物VM2、弗吉尼亚霉素M1 (VM1)、马杜霉素I(33)和马杜霉素II(34)(图1b)。
用对甲氧基苄基保护的(R)或(S)-3-羟基-2-甲基丙醛替换左半序列中的异丁醛,可获得C3 -异丙基修饰的类似物38和39(图1c)。这些链锁蛋白中的每一种都可以与17种市售芳基异氰酸酯发生反应,产生34种新的链锁蛋白类似物,它们在C3位置具有芳基氨基甲酸侧链(40a-q和41a-q)。此外,通过四步序列在C16位点安装氟,提供临床候选flopristin(4)和几种氟类似物(图1e)。
体内和体外的疗效
研究者评估了62个新的A组链球菌抗生素类似物、4个天然产物和第一个全合成的flopristin样品(4)对20个病原体的活性(图2a),其中包括3个已知链球菌耐药机制的菌株。与VM2相比,类似物26、40q和21对野生型和VatA金黄色葡萄球菌表现出相同或提高的活性,而它们的C16氟化同源物(45、46和47)表现出显著提高的活性。值得注意的是,类似物46和47对野生型和VatA金黄色葡萄球菌的抗性比flopristin(4)强16到32倍。此外,47对ABC-F表达的粪肠杆菌和革兰氏阴性大肠杆菌具有可测量的活性,这两种大肠杆菌对链球菌具有高度耐药性。
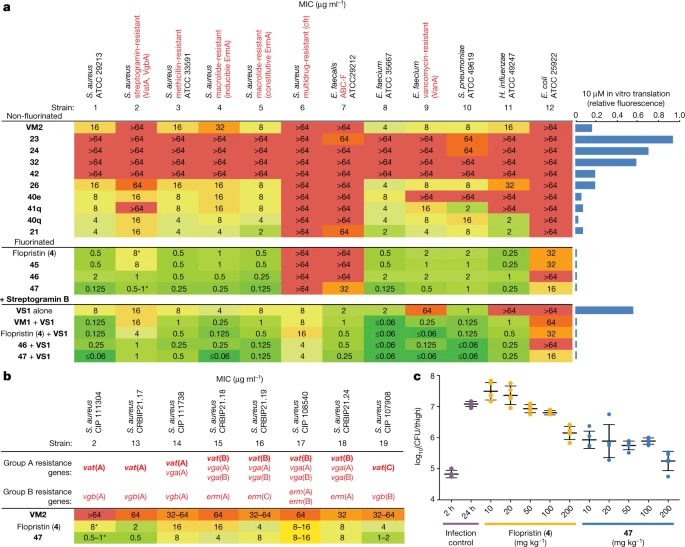
图2 所选A组链球菌素的抗菌活性和体内疗效
研究者对47含有vat基因的金黄色葡萄球菌临床分离株进行了测试。Vat基因通常伴有vga基因,vga基因编码ABC类蛋白,也对A组链阳菌素产生抗性(图2b)。与预期的一样,VM2并没有有效抑制这些链球菌耐药菌株的生长。Flopristin(4)表现出良好到中度的活性,而47表现出优异到中度的活性。这些数据表明,完全合成的C4修饰的链霉阳菌素47能有效抑制具有A组链球菌耐药基因的临床多药耐药分离株的生长,通常比临床候选的flopristin(4)更有效。
考虑到47对链球菌耐药菌株的体外活性,研究者接下来在小鼠大腿模型中测试了其有效性,使用金黄色葡萄球菌CIP 111304(菌株2),该菌株表现出高水平的A组链球菌耐药性(图2c)。
作用和耐药的机制
与低MIC值一致的是,4和47在体外对翻译的抑制作用比VM2更有效(图3a)。IC50值类似于4和47,这表明它们的MIC差异是由其他因素造成的,而不是由增强的核糖体抑制所致。为了确定47对低速率VatA乙酰化的结构贡献,研究者获得了一个X射线共晶结构(图3b),显示在VatA (PDB代码4HUS2)中,由于47的C4延伸空间碰撞,Leu110与VM1相比位移了1.5 Å。
基于flopristin(4)结合到核糖体的晶体结构,化合物46使用Maestro的LigPrep工具构建(v2019-4, Schrӧdinger Inc.)。通过与flopristin的共晶体结构的低能量位相比较,验证了大环构象采样方法(4)。采用全采样强度策略,得到了46的1000个构象,其中RMSD <2 Å的最低质能位(4个骨架原子作为参考原子)被认为是首选构象。最后,通过对骨架原子施加约束,以B3LYP/6-31G*为基础,使用Jaguar软件对这种优选构像的C3侧链进行进一步优化。
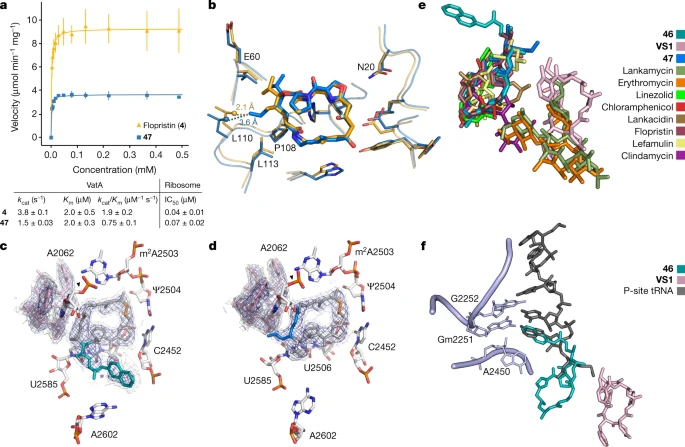
图3 体外乙酰化,VatA结合,和高活性类似物的核糖体结合
细菌的PTC是一个特殊的抗生素结合位点(图3e)。值得注意的是,46的芳基氨基甲酸酯侧链和47的烯丙基侧链与其他配体没有明显重叠,而且它们不排除与VS1结合。46中芳基氨基甲酸酯侧链的位置延伸到P位点(图3f)。通过将P-位点结合tRNA的五端碱基覆盖到46和与催化中心结合的VS1结构中,发现46中的异喹啉基团与所有tRNA中保守的末端腺苷基本重叠。A组链阳菌素的23元大环核可能为原核核糖体的选择性提供了基础,这是tRNA拟合物,如blasticidin无法实现的。
展望与结论
结合理性药物设计、模块化化学合成、抗菌评价、体外分析和高分辨率冷冻电镜技术,研究者开发了一条A组链球菌素类抗生素的合成和优化途径。该方法可以通过构造块变化和后期多样化的方式制备新的类似物,提供有价值的构效关系。在骨架上两个先前未探索的位置进行修饰,使第一组A链蛋白克服了Vat酶引起的抗性。尽管其他耐药机制的出现是不可避免的,但这种方法可能允许化学适应延长链锁菌素类的临床寿命。
参考文献
Li, Q., Pellegrino, J., Lee, D.J. et al. Synthetic group A streptogramin antibiotics that overcome Vat resistance. Nature 586, 145–150 (2020). https://doi.org/10.1038/s41586-020-2761-3