
引言
理解酶催化作用不仅对基础科学有重要意义,而且对实际应用也很重要。例如酶反应机理在药物的合理设计中发挥着重要的作用,在药物的合理设计中,可以通过模仿中间体或过渡态(TSs)的结构来开发抑制剂。 酶工程技术彻底改变了生物催化领域,因此,深入了解控制特异性和选择性的反应机制和因素对指导具有所需特性的酶工程设计很有帮助。
在过去的几十年中,研究人员陆续开发出了一系列能够解决酶催化中各种问题的计算方法。常见的方法是分子对接,分子动力学模拟(MD),自由能扰动(FEP),经验价键(EVB),量子力学结合分子力学(QM/MM)和簇方法。这些技术可以被认为是互补的,当然每种技术都有其自身的优点和缺点。 在不对称生物催化领域,分子对接和分子动力学模拟已被广泛使用,并且有助于定性合理化观察到的选择性,也可以合理或半合理地指导酶工程。在QM/MM方法中,对活性位点周围的一小部分酶用量子力学方法处理,其余的酶以及周围的水用分子力场进行处理。如今,这种方法在酶的立体选择性中有许多应用。最新研究的例子有Walter Thiel在对映选择性酶促Baeyer-Villiger反应方面的工作和南极假丝酵母脂肪酶B (CALB) 的O-乙酰化反应。在EVB方法中,首先在参考系统(例如在水溶液中)中研究反应,并调整参数以重现实验可观察值或更高级别的计算。然后将这些参数用于在酶环境中对反应进行建模,在该环境中可以计算出新的自由能图。最近出现了一些将EVB用于酶对映选择性的例子,例如脂肪酶的研究和环氧水解酶。在簇方法中,量化方法的选择通常是使用密度泛函理论(DFT)。簇方法已用于研究酶促反应机理已有20多年的历史了。 并被证明是富有成果的。然而,对映选择性的研究对该方法提出了另外的挑战。除了上述相对能量的精度要求外,模型还必须足够大才能正确表示活性部位的手性环境。最初的簇模型很小,甚至少于100个原子,因此显然无法建模酶对映选择性。但随着于计算机的发展,如今的模型通常约为300个原子或更多,因此可以对活动站点进行更可靠的建模。
簇模型的介绍
簇模型的方法,也称为全QM方法,是一种用于研究酶活性位点的反应机理的简单但强大的方法。通常基于酶的晶体结构来设计活性位点的模型。选择重要催化基团的残基,定义为活性位点,其余的部分被截断。随着计算能力的发展,活性位点模型逐步扩大,如今300多个原子组成的模型非常普遍。尽管这是一个很大的进步,但是这个大小仍然代表了整个酶的很小一部分。具体选择取决于研究的科学问题,并且在某种程度上取决于可用的计算资源。除了晶体本身的结构数据,突变实验的信息在这里通常也很有价值,因为它可能指出哪些残基会影响活性位点的反应性或选择性。通常,优良做法是至少在底物周围包括残基的侧链;但是,有时距离较远的基团有时会参与反应。
残基的截断通常在C-C单键处进行,截断的键被氢饱和。为了使模型的整体结构和晶体结构相符,必须固定模型边界上的许多原子。这些原子通常是进行截短的碳原子,有时是该碳原子上的一个或两个氢原子,具体取决于模型所需的灵活性。对于金属酶而言,金属离子通常将活性位点基团保持在一起,因此在这些情况下需要较少的固定。 酶的省略部分由均质的可极化介质表示,通常假设介电常数为ε=4。系统研究表明,随着模型尺寸的增长,介电层周围的影响会迅速减小,并且ε的特定选择变得不太重要。存在于活动地点的结晶水必须包含在模型中,因为它们是活性位点的架构的组成部分。关于5-羧基香草酸脱羧酶的反应机理的研究很好地说明了验证这点,该模型中包括多达10个水分子。没有这些水,量化计算的模型将崩溃并给出错误的结果。在某些情况下,即使在晶体结构中看不见水,也必须将水添加到模型中,以填充活动位点中的空隙。此外,特别需要注意的,在簇模型中同样需要考虑某些残基(最常见的是Glu,Asp和His)的质子化状态。这些残基可能处于质子化或去质子化状态,从而影响反应的能量。当质子化状态从结构中不清楚时,可以明确考虑这两种情况,并可以评估其对反应能谱的影响。双核锌酶双氢乳清酶就是很好的例子,考虑了Asp残基的两种质子化状态,分布计算建模,研究不同的反应机理。下面就举些应用簇模型研究的机理的例子
柠檬烯环氧化物水解酶(LEH)
柠檬烯环氧化物水解酶(LEH)催化柠檬烯1,2-环氧化物水解为相应的二醇,该反应遵循协同机制,即由Asp活化残基周围的水分子,继而对环氧化物进行亲核进攻,并且,质子从另一个Asp转移至环氧乙烷氧,导致开环并产生最终产物(方案1)。因为环氧乙烷环可在两个碳原子中的任何一个上打开,所以该反应可导致形成两个手性二醇产物。但是,大多数非天然底物的对映选择性非常差。例如,对于环戊烯氧化物,野生型对于生成(R,R)-二醇,仅仅有14%ee值。使用定向进化技术,LEH已被设计为在多种底物上对(S,S)或(R,R)产物产生相当高的对映选择性。
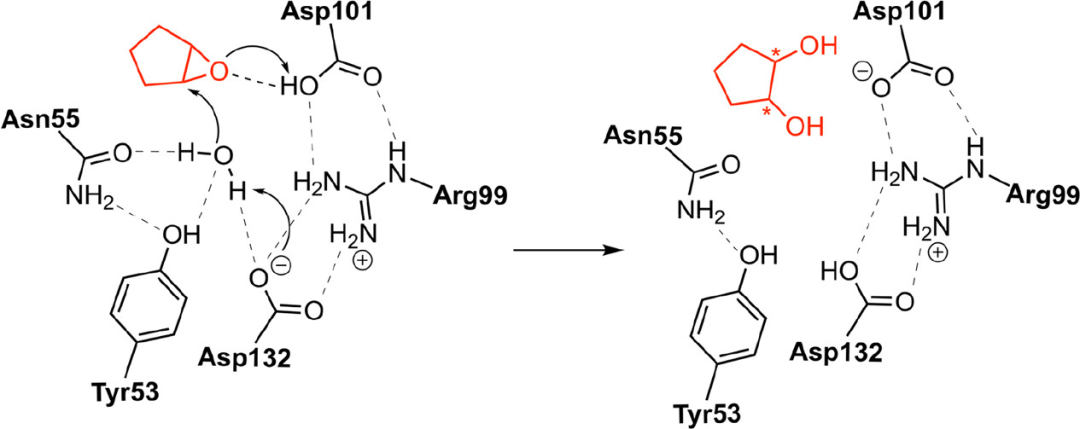
方案1. LEH催化非天然底物环戊烯氧化物的水解机理
图片来源 ACS Catalysis
为了研究环戊烯氧化物的开环选择性,研究人员设计了一个由约250个原子组成的活性位点模型,并确定了进攻底物的C1或C2位置的过渡态。(图1)。在WT野生型体系中,C1和C2处开环的计算势垒仅相差0.1 kcal/mol,这与实验观察到的非常低的ee值相符。可以通过以下事实来解释几乎相同的反应能垒:环戊烯氧化物比天然底物小得多,因此可以调节其在活性位点内的位置,以同样好地适应两种碳原子的进攻。
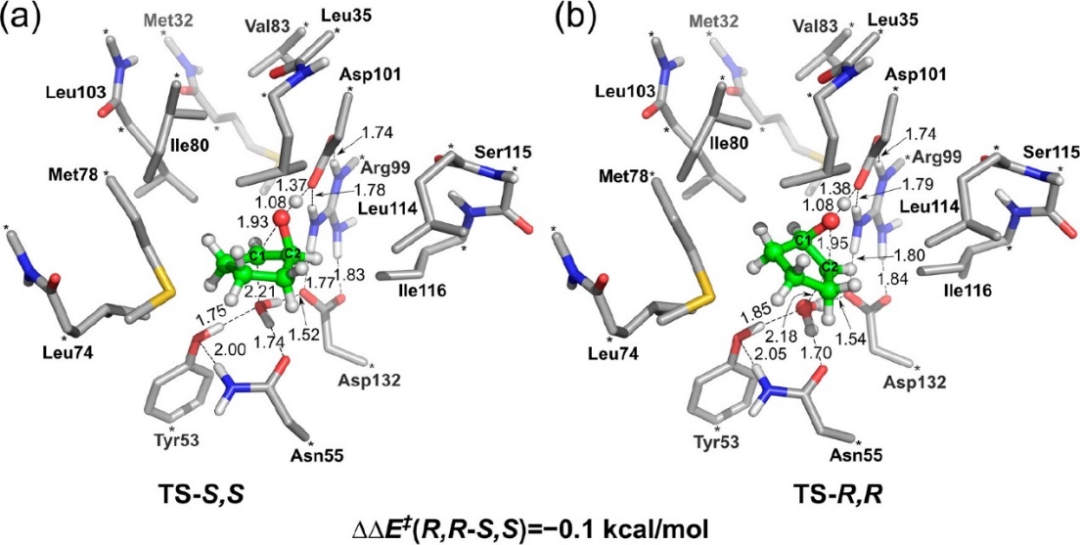
图1. 进攻(a)C1和(b)C2原子的过渡态结构,分别导致形成(S,S)-和(R,R)-二醇
图片来源 ACS Catalysis
非常重要的是,对于包含最多五个点突变的突变体,其计算结果也与实验一致。
实验中所有(R,R)选择性的变体,计算结果都表明在C2处形成开口,所需克服的活化能能垒较低,而对于具有(S,S)选择性的变体,在C1处形成开口的能垒较低。
可溶性环氧化物水解酶
马铃薯(Solaum tuberosum)的可溶性环氧化物水解酶(StEH1)是一种有趣的酶,因为它对底物的两个对映异构体显示出不同的偏好性。对于苯乙烯氧化物(SO)衍生物,底物的(S)-对映异构体主要在C1碳原子被进攻,而(R)-对映异构体优选选择进攻C2位的碳原子上。具体机制如方案 2a 所示
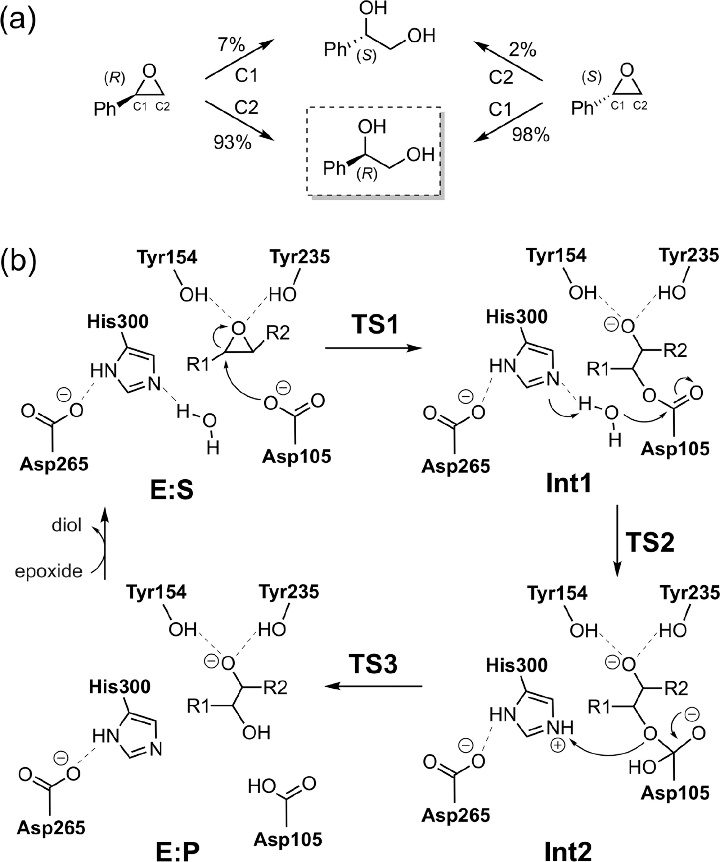
方案2. StEH1对苯乙烯氧化对映体水解和对应的反应机理
图片来源 ACS Catalysis
与之前的例子LEH相比,StEH1属于另一类环氧水解酶,反应机理完全不同,涉及烷基化和水解半反应(方案 2b)。在烷基化步骤中,一个环氧乙烷的碳发生亲核攻击,形成酶-底物的中间体IM。随后的水解反应包括水分子的亲核攻击和随后形成的四面体中间体IM的塌缩,从而导致最终的二醇产物的形成。 研究人员通过建立280个原子的模型来探究StEH1对映体形成原因。观察活性位点的结构发现,SO底物可以两种不同方向结合,即芳香环指向酶内部(称为“内”方向)或指向外部(称为“外”方向)。计算得出底物的两个对映体的两种结合模式之间的能量差异非常小,因此,对于机理研究,必须将它们全部视为起始酶-底物结构。此外,对于每种结合模式,对环氧乙烷环的亲核攻击都可能发生在环氧乙烷环的C1或C2碳原子上,导致必须计算总共8条反应途径。因此,对StEH1反应的研究构成了图3示出了对于(R)-SO底物获得的四个反应能曲线。
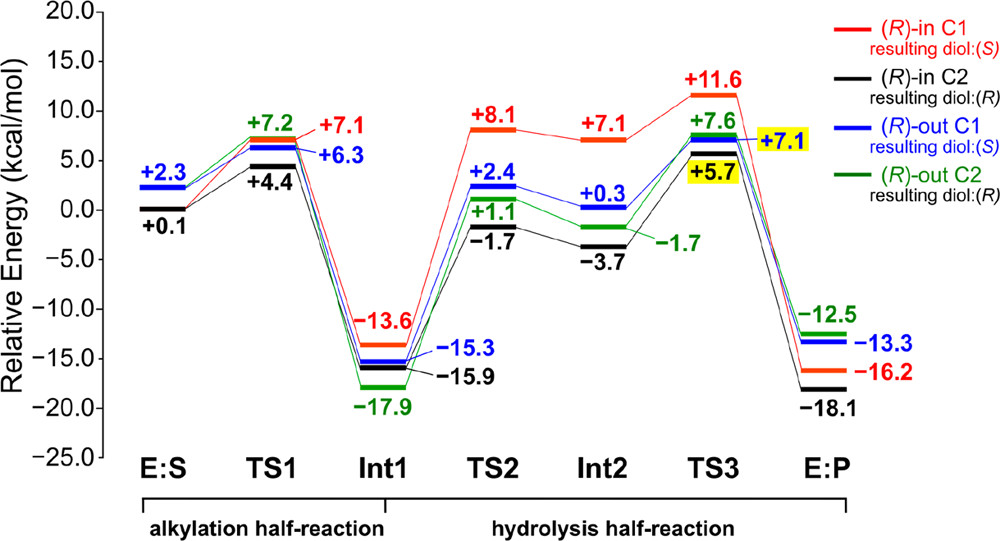
图4. StEH1催化的(R)-苯乙烯氧化物水解的计算能量曲线。决定选择性关键过渡态TS的能量以黄色突出显示
图片来源 ACS Catalysis
仔细研究获得的能量分布,可以发现TS1和TS3的能量非常接近,因此在选择性分析中必须将它们两者都考虑在内。对于底物的(R)-对映异构体,计算预测导致(R)-二醇的最低能量途径是通过在“内”结合模式的C2位置的初始亲核攻击。另一方面,导致(S)-二醇的途径对应于“出”结合模式中C1位置的初始攻击。选择性决定势垒中的能量差为1.4 kcal/mol,有利于生成R手性的产物,因此计算结果能够重现StEH1酶的对映收敛行为。就像上面讨论的LEH一样,仔细分析优化的TS结构可以深入了解控制对映选择性的因素。事实证明,存在底物本身和环氧乙烷环上取代基的性质固有的电子和空间效应。除了这些功能之外,计算还可以查明底物与周围的活性位点残基之间的许多特定相互作用,这些相互作用会导致能量歧视。一些π-π和CH-π相互作用被认为对选择性起着重要作用。 因此,StEH1的情况凸显了考虑反应机理所有步骤的能量以重现和理解选择性起源的重要性。
酚酸脱羧酶
酚酸脱羧酶(PADs)催化酚酸向乙烯基酚的非氧化脱羧(方案4 a)。除自然反应外,PAD还被证明可以催化许多具有生物催化作用的混杂反应,例如对羟基苯乙烯的羧化和立体选择性水合反应(方案 4b)。
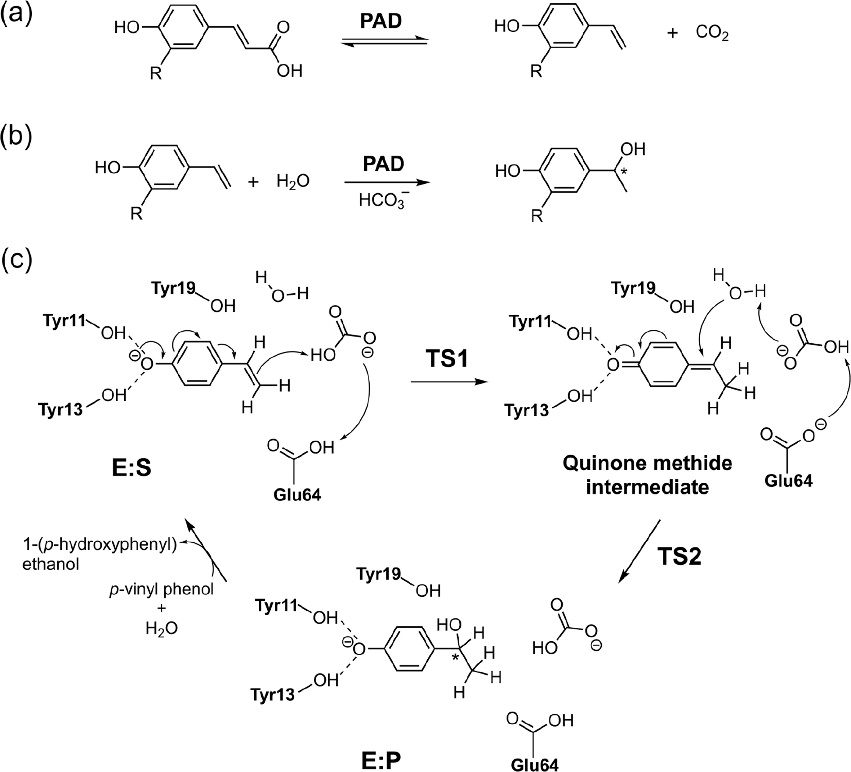
方案4.(a)PAD催化的脱羧反应,(b)混杂的水合活性,和(c)根据计算结果提出的水合机理
图片来源 ACS Catalysis
首先使用簇模型研究反应的机理。计算结果为先前提出的涉及醌甲基化物中间体的机理提供了支持。研究人员使用相同的活性位点模型,探究PAD催化水合反应的反应机理和对映选择性。 为了获得高转化率和对映选择性,该反应需要碳酸氢盐作为添加剂。与天然酚酸底物相比,水合反应的底物可以在活性位点周围采用不同的结合方式。因此,为了鉴定最低能量的结合模式,选取了80多个起始结构,其中底物在活性位点中相对于彼此占据不同的位置。然后进行构象优化评估相应的能量。计算表明,水合反应涉及两个步骤,如方案 4c 所示:(1)用谷氨酸使底物质子化,生成醌甲基化物中间体;(2)水分子在α-处发生亲核攻击,这两个步骤都涉及碳酸氢盐作为质子穿梭的介导。在该机理研究中,遵循了20种能量最低的E:S配合物的整个水合路径,以确保所定位的中间体和过渡态代表能量最低的结构。 这在对映选择性的分析中尤其重要,如上所述,在对映选择性中,准确性必须很高。该计算可以再现观察到的对映选择性,其中发现最有利的途径导致(S)手性产物的形成。计算得出导致R产物的途径的能量提高了2.3 kcal / mol(图5),与87%的实验ee值高度吻合,后者相当于1.6 kcal/mol的反应势垒。
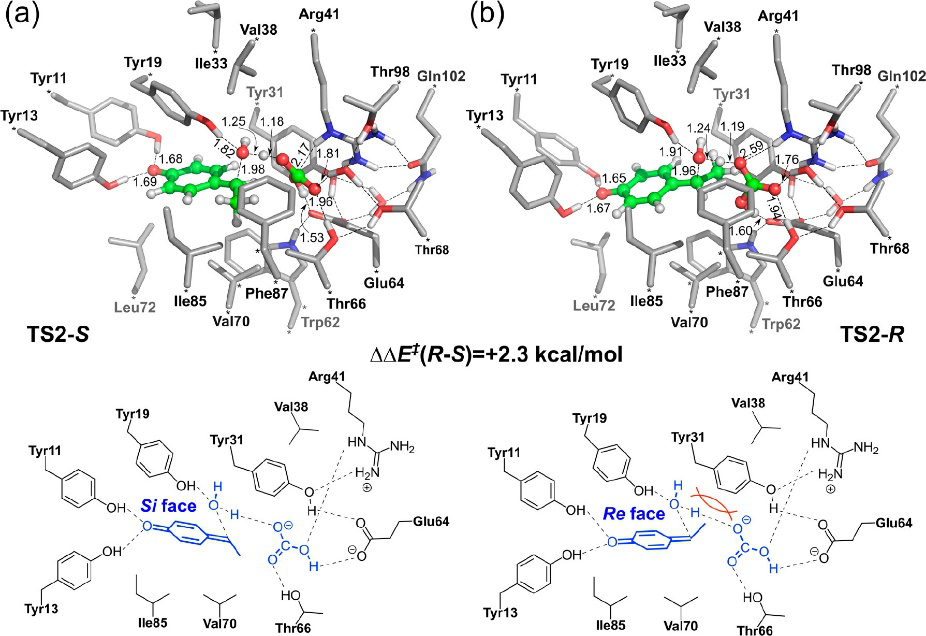
图5.确定对映选择性的过渡态的优化结构和示意图,该过渡态在PAD催化的水合反应中导致生成(a)(S)产物和(b)(R)产物
图片来源 ACS Catalysis
然后,可以通过比较决定选择性的过渡态的几何形状来确定立体感应的起源(图5)。首先,通过与周围残基形成氢键,限制了甲基苯醌中间体和碳酸氢盐的氧侧位置,而C═C双键可以指向不同的方向,而Si或Re面都指向亲核体水。在TS2-S中,它导致(S)-对映体,甲基指向Val70和Ile85区域,而在TS2-R中,它导致(R)-对映体,甲基指向Tyr31侧链,在空间上更拥挤。最近的一项突变实验也提供了支持。即证明用谷氨酸或甲硫氨酸代替Arg41导致产物的ee降低。 该突变可通过削弱Tyr39的氢键网络使Tyr39侧链更具柔性,从而减少空间位阻。在没有碳酸氢盐的情况下,实验表明水合反应产生醇产物的几乎外消旋的混合物。随后采用相同的方法研究氰化物向对羟基苯乙烯中不对称加成的机理和对映选择性。关于反应机理和对映选择性的起源,得出了非常相似的结论。
结论
如今,密度泛函理论是研究均相催化领域的反应机理和对映选择性的巨大成功工具。在本文中,研究人员讨论了许多使用基本相同的方法研究酶中不对称反应的最新例子。簇模型是一种计算研究酶反应的强大方法。随着计算机能力的提高,设计建模较大的簇模型成为可能,该模型可以完美地表示活性位点的手性环境,从而可以研究酶的对映选择性。上述的三个例子表明,簇模型可以很好地模拟酶中的对映选择性,并提供了对控制反应性和选择性的因素的宝贵见解。重要的是,基本的DFT方法的精度已被证明足够高,可以再现描述选择性所必需的过渡态能量的微小差异。精度和速度之间的良好平衡是DFT方法广泛使用的关键。在未来的几年中,DFT将继续成为这种方法的主力军。在一些讨论的酶中,与实验相比,发现选择性趋势被高估或低估了。这种影响可以至少部分地归因于所采用的簇模型的大小,在某些情况下,这种模型不能赋予活性位点组足够的灵活性以适应反应期间可能发生的几何形状变化。解决此缺点的一种方法是,将截断原子置于模型的外围处于软约束电位中,而不是完全固定它们。在未来几年中,簇模型将更频繁地与其他互补方法结合使用,成为一种常见的量化研究酶中的反应机理的计算方法
参考文献
Modeling Enzymatic Enantioselectivity using Quantum Chemical Methodology. ACS Catal. 2020, 10, 11, 6430–6449.https://doi.org/10.1021/acscatal.0c00983