引言
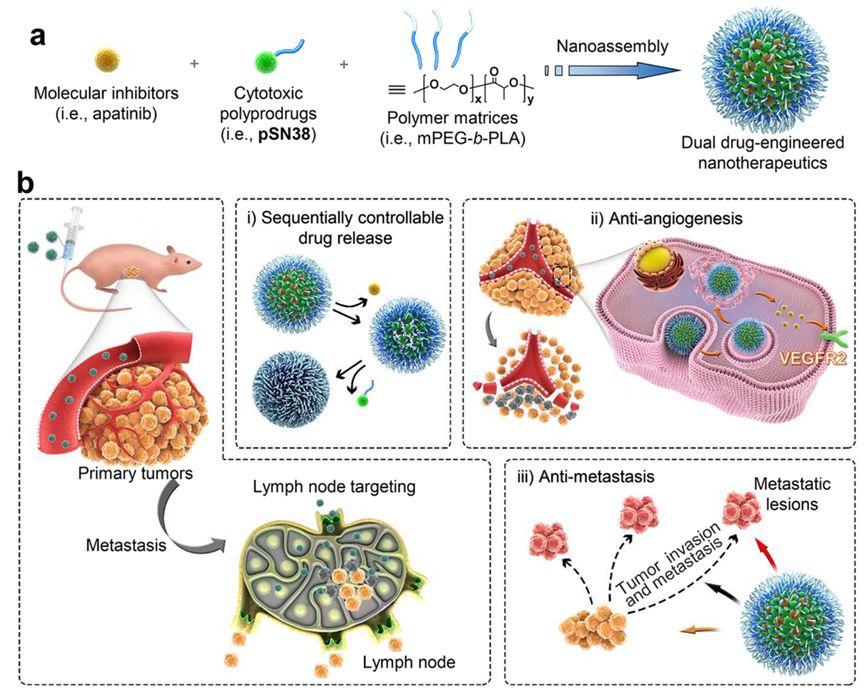
联合治疗已经发展成为一种有效的癌症治疗的创新方式。然而,不同药物的药代动力学不同限制了联合疗法的应用。虽然许多纳米药物 (NPs) 可以同步向肿瘤细胞递送联合治疗药物,但它们的临床转化仍然面临挑战,部分原因在于如何精准控制联合治疗药物在肿瘤部位的释放和作用方式。鉴于以上难题,浙江大学医学院附属邵逸夫医院韩卫东联合浙江大学医学院附属第一医院王杭祥制备了一种两亲性聚合物包裹的阿帕替尼(VEGFR2抑制剂)和SN38-聚乳酸纳米颗粒用于治疗肝癌,通过分子动力学模拟,在原子水平研究纳米药物自组装过程以及纳米材料的稳定性。

文章亮点
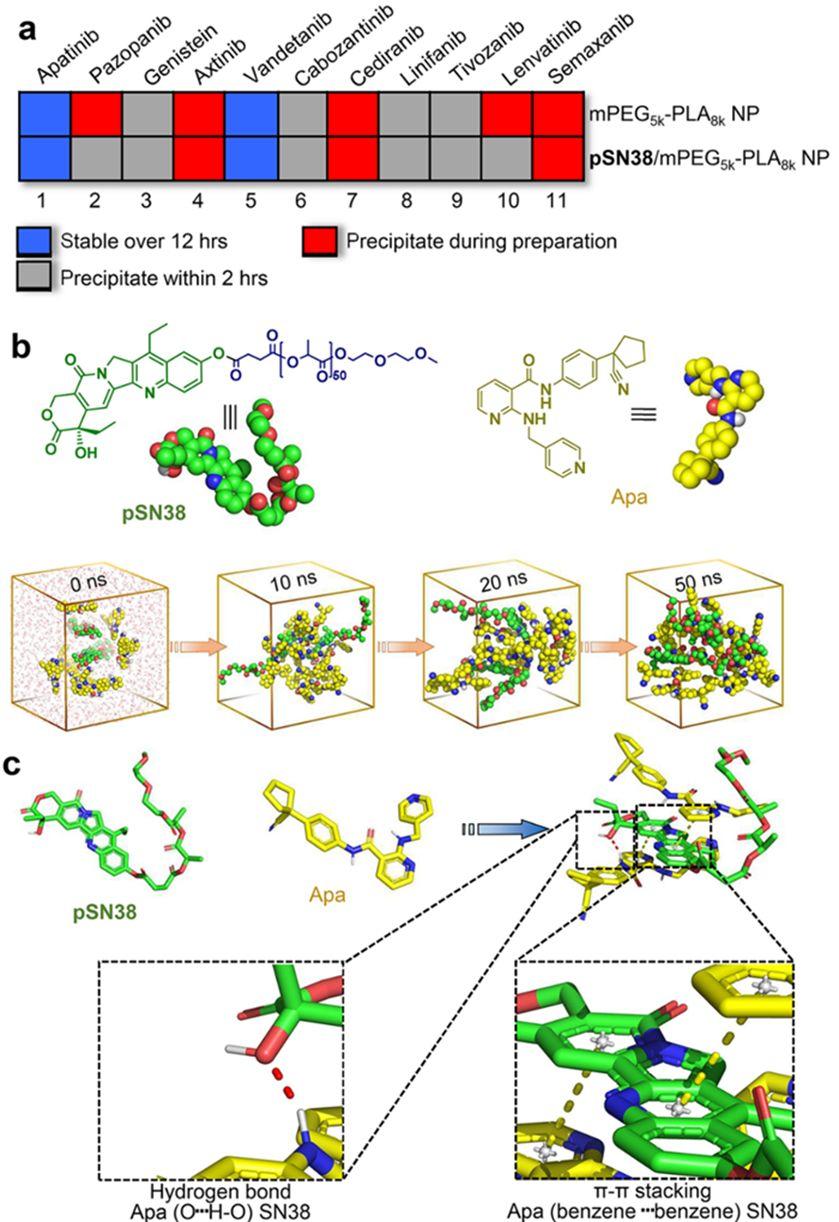
该研究在酪氨酸激酶小分子抑制剂库中成功筛选出抑制剂阿帕替尼能与SN38聚合物稳定包裹于双亲性药物PEG-PLA中。研究者们使用Amber16构建了SN38与阿帕替尼多分子体系,进行50ns的分子动力学模拟,获得了稳定的SN38与阿帕替尼多分子相互作用构象,通过分子动力学轨迹分析,发现SN38与阿帕替尼是通过π-π和氢键增加了两者之间的相互作用,该相互作用可明显提高阿帕替尼在体内递送时血液循环系统内的稳定性。
02
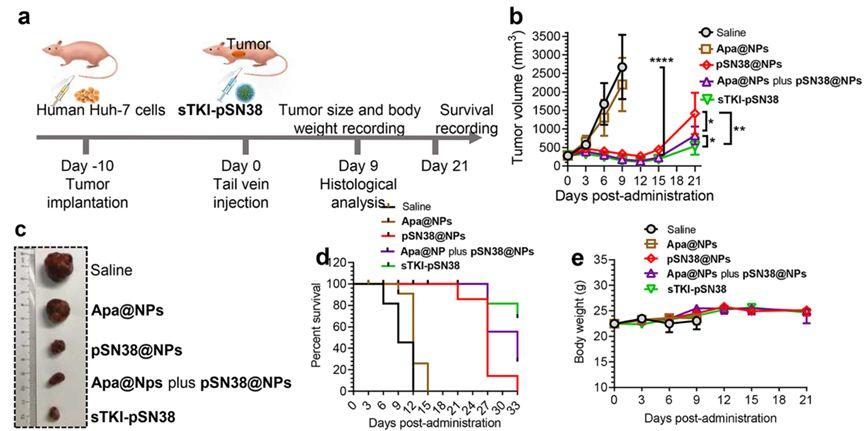
基于精准的设计和两种包载药物特性差异,该纳米药物可以实现抗血管药物阿帕替尼和抗肿瘤细胞毒性药物SN38的先后释放。因此,在利用纳米粒特有的EPR效应的同时,这种纳米粒可以实现在这两种药物的可控释放和不同时序地作用于肿瘤血管和肿瘤细胞。即在肿瘤部位先将抗血管药物阿帕替尼释放作用于肿瘤血管封闭局部血管,后将肿瘤细胞杀伤药物SN38释放出来局部高效针对性地作用于肿瘤细胞。
03
该研究在体内成像和药效研究中都发现该纳米共载体系对肝癌的转移有抑制效果,揭示了阿帕替尼对于肝癌细胞的转移也有一定的抑制作用,在一定程度上减少了肿瘤对于抗血管药阿帕替尼的耐药可能性。
04
该研究提供的纳米形式的药物提高了前体药物阿帕替尼和SN38-聚乳酸的水溶性,可直接静脉注射。该研究也是第一个将常规口服用药的阿帕替尼用于静脉注射的研究。该研究所提供的纳米共载颗粒所实现的药物可控性释放为肿瘤治疗研究提供了新的方案和思路。
本研究由中大唯信提供计算技术支持
图片来源:ACS Appl. Mater. Interfaces
图片来源:ACS Appl. Mater. Interfaces
图片来源:ACS Appl. Mater. Interfaces
参考文献:
Supramolecular Engineering of Molecular Inhibitors in an Adaptive Cytotoxic Nanoparticle for Synergistic Cancer Therapy. W. Han*, L. Shi, B. Xie, J. Wan, L. Ren, Y. Wang, X. Chen and H. Wang* ACS Applied Materials & Interfaces, 2020, 12, 1707-1720. DOI: 10.1021/acsami.9b20178