
简介
BRIDGE(Biomolecular Reaction and Interaction Dynamics Global Environment)是一个开源的网络平台,旨在为设计可靠的方法提供一个环境来进行可重复的生物分子模拟。它建立在著名的星系生物信息学平台上,通过这种方式,BRIDGE在公共Web服务器上托管计算化学工具以供Internet使用,并使用Docker容器平台为本地用户提供独立于机器和操作系统的可移植性。这种构造提高了分子模拟计算方法的可及性、可共享性和可重复性。
BRIDGE平台可准备、模拟、分析和可视化分子模拟,特别是分子动力学模拟和自由能计算。该平台通过常用的软件,如NAMD、GROMACS和CHARMM,实现蛋白质的基本分子动力学模拟。BRIDGE可以用来建立和模拟生物大分子,从轨迹数据中进行构象分析,并对大规模蛋白质运动进行严谨的统计分析(图1)。作者以典型的短蛋白纤维二糖水解酶I(CBH1)举例,来展示通过BRIDGE平台的工具来研究CBH1构象变化。使用拉氏图计算寡糖配体关键糖苷键的ψ和φ二面角图(图1B);接着计算蛋白质Cα原子的均方根偏差(RMSD)直方图,从RMSD直方图可以看出,其存在三种不同的构象(图1C);蛋白质构象变化可以使用统计分析模块中的工具进行更详细的研究。在本案例中,作者通PCA分析5 ns CBH1轨迹中具有统计意义的构象(图1D)。
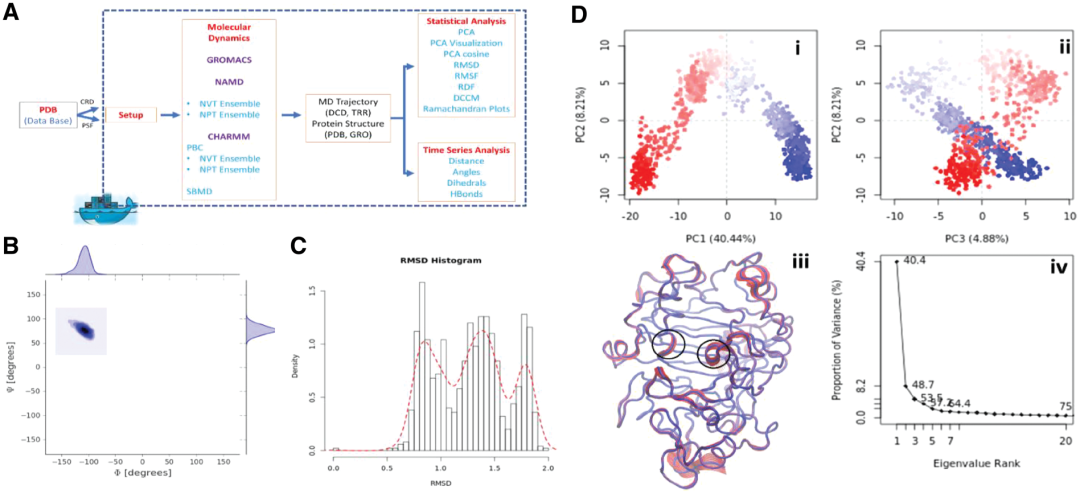
图 1. (A)BRIDGE的MD模拟界面概述;(B-D)CBH1蛋白构象变化的研究内容
图片来源于:Bioinformatics
随着,计算机辅助药物分子设计的应用越来越广,对于蛋白受体和配体的结合自由能的计算变得尤其重要。精确而快速的自由能计算手段将会大大提高药物设计的效率,达到事半功倍的效果。目前关于自由能计算的方法很多,基本上可以分为基于炼金术(alchemistry)自由能计算(FEP,TI等)和基于反应坐标的自由能计算方法(MTD、Umbrella Sampling等)。小分子与受体的结合自由能(FE)可以分为计算一个小分子与受体的绝对结合自由能(ABFE)或一系列相关配体对受体的相对结合自由能(RBFE),其中RBFB计算具有速度和精度上的优势,在基于配体结构的药物优化设计中最常用。但当没有参考结构时,或结构间的扰动在计算上难达到的,ABFE计算最有用。BRIDGE采用炼金术自由能计算方法计算自由能,同时通过MD或Monte Carlo模拟采集足够的构象,由于计算过程也将熵贡献考虑进来了,得到的结合自由能更准确。
Galaxy/BRIDGE可以在GitHub上开放访问https://galaxy-compchem.ilifu.ac.za/)。用户界面简单明了(图2),工具显示在左侧面板中,可以使用工具菜单顶部的上载图标上载数据,而顶部菜单栏包含共享资源、用户帐户和其他信息。进度历史记录显示在右侧面板中,有关当前所选工具或数据集的信息显示在中央面板中。
本文主要以案例的形式讲述BRIDGE综合自由能工具(应用程序)来计算绝(相)对自由能,预测配体亲和力指导先导化合物的优化。
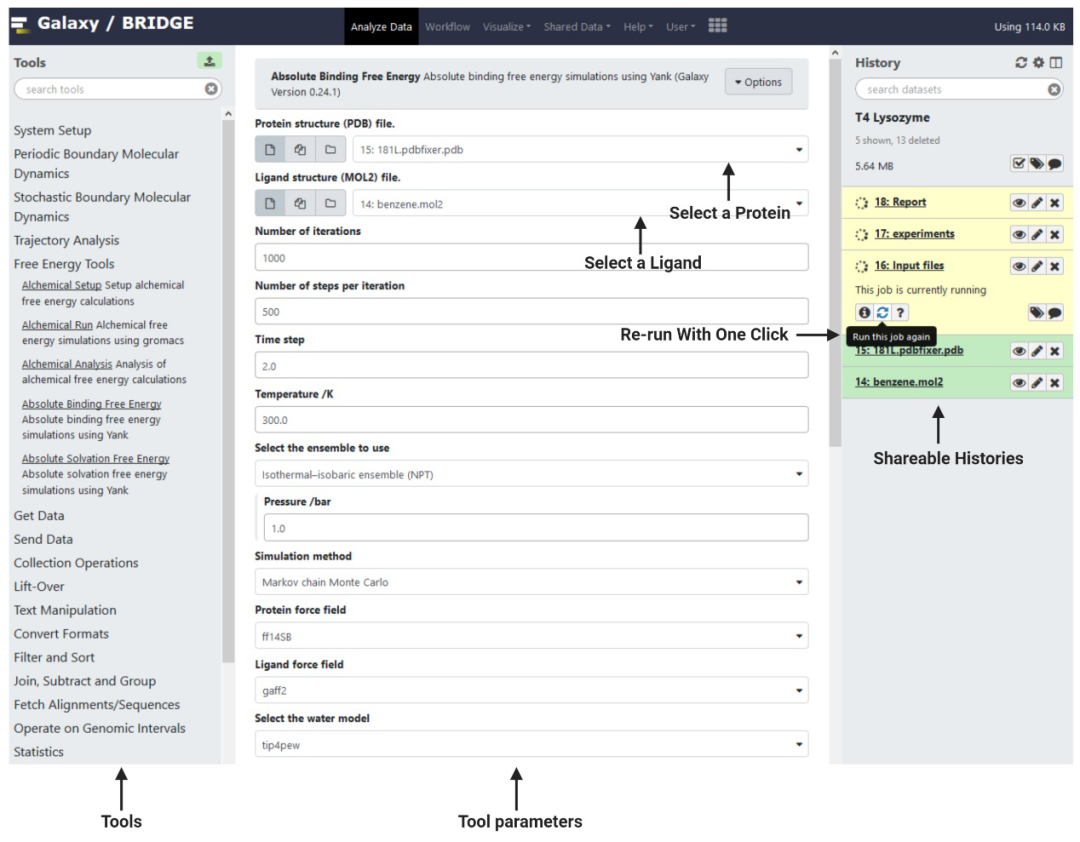
图 2. Galaxy/BRIDGE的界面概述
图片来源于:Bio-protocol
案例
首先以RBFE计算的工作流示例(图3)。包括使用GROMACS工具进行FEP模拟的设置和说明,从“炼金术设置”工具中选择结构和拓扑文件输出,并定义所需的模拟参数。可以分为四个步骤(图3B),(i) 能量最小化,(ii)NVT系综平衡,(iii)NPT系综平衡(iv)NPT系综下的FEP模拟,这一过程是全自动的,并针对每个热力学窗口执行。RBFE计算完成后,通过活性位点在水溶剂中的自由能变化得RBFE值,炼金术分析工具用来审阅输出,并验证模拟的收敛性,FEP模拟和窗口选择的质量。一旦建立了协议,就可以共享连接所有设置、运行和分析步骤的工作流。配体在水中或受体活性位点的模拟,都可以在同一个工作流程中运行。工作流确保计算的可重复性,可以实现多配体-蛋白质结合实验的高通量计算,并且工作流允许项目主管、合作者或文章评审者对模拟进行独立验证。
为了进一步说明BRIDGE如何协助于药物发现,作者以CDK2蛋白的自由能计算为例。并且采用地理位置遥远的资源,使用相同的工作流程计算,并将所得的RBFE数值结果进行合并(图3C),重现了基准测试结果,其中配体RBFEs在1 kcal/mol的耐受范围内,与实验数据也匹配很好,说明BRIDGE不受地理位置的影响。
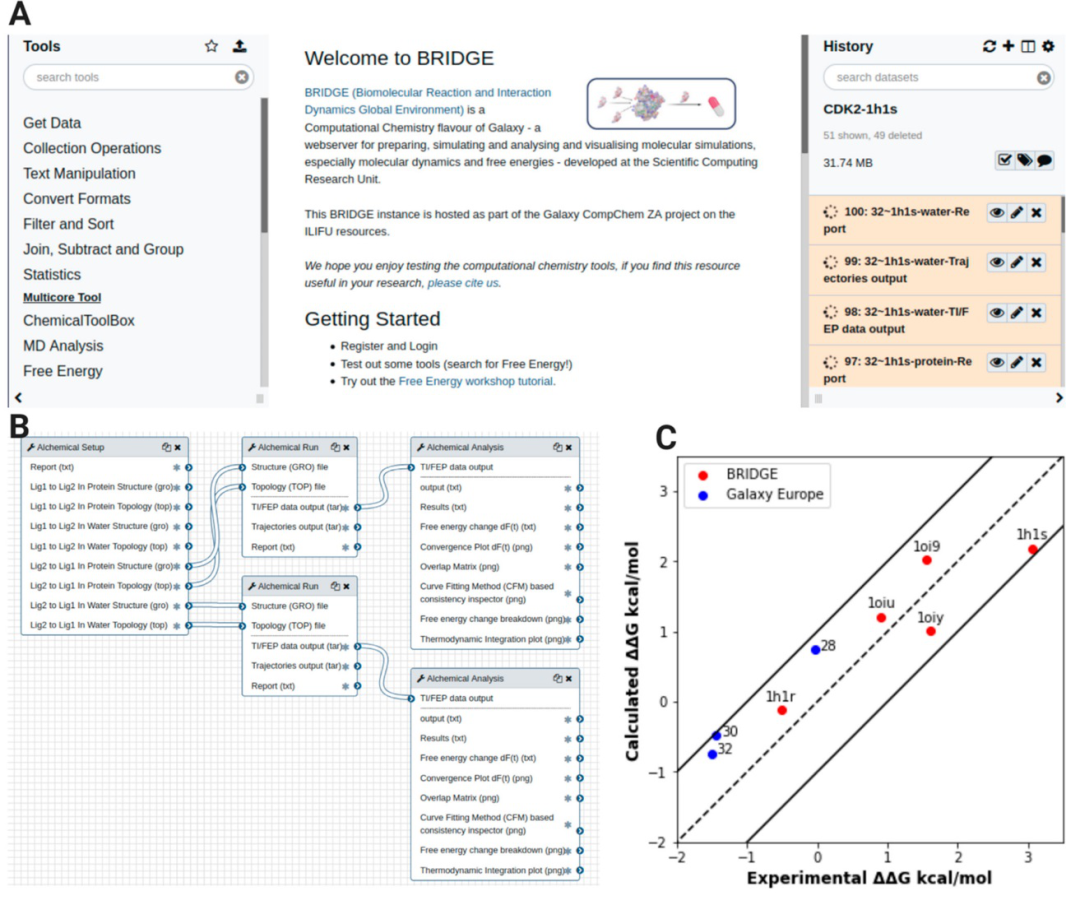
图 3. (A)BRIDGE的界面; (B) RBFE计算的工作流程; (C)基准测试结果
图片来源于:JCIM
众多周知,对于配体糖基转移酶结合的MD模拟和自由能计算比大多数蛋白质-配体情况更具挑战性。而在BRIDGE平台中,糖基转移酶建模方面的专业知识可以很容易地共享,使用者可以直接采用已经由专业人员创建的协议,不需要繁琐的安装等操作。
为了说明使用不同的自由能方法在开发药物的优势,作者计算了β-半乳糖苷α-2,3-唾液酸转移酶I(ST3Gal-I)与潜在的三个抑制剂小分子的自由能(ΔΔG),并将计算结果与根据IC50值换算的实验ΔΔG值进行了对比(图4)。作者选择的ST3Gal-I抑制剂具有高度柔韧性和带电荷的磷酸盐基团,尤其是IN3分子,由于分子柔性很大,ABFE计算需要大量的计算资源,并且计算收敛性差,尽管在NVIDIA Tesla V100上运行,都需要16天的时间。综合ABFE和RBFE的结果表明,结合自由能按照IN3 < IN2 < IN1的顺序增加,与先前报道的实验结果一致。由于这三个分子之间的唯一区别是R基团,作者推测羧酸基团对小分子和蛋白的结合是必要的。三个分子中,IN1与蛋白结合最强,为了解释这个原因,可以通过BRIDGE平台上的工具来分析小分子与蛋白之间的相互作用特征(在本例中是氢键作用)以及对蛋白质进行PCA等分析。这些基本的工具和预先设计的工作流程都可以服务于先导化合物的优化。
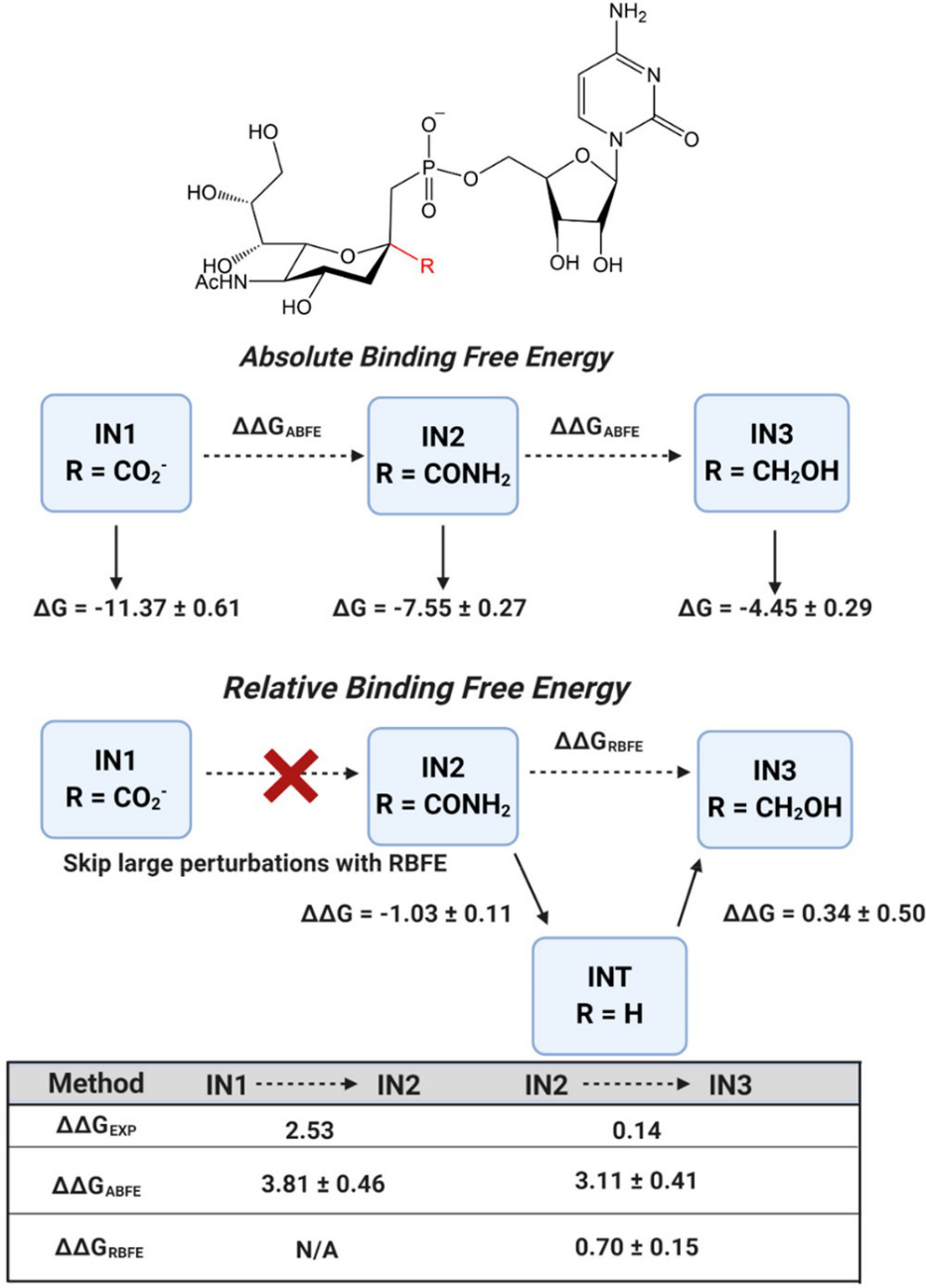
图 4. ST3Gal-I酶与三个抑制剂小分子的自由能计算过程与结果
图片来源于:JCIM
小结
BRIDGE平台的计算过程,结果,自由能计算分析等会自动保存在历史记录中,可用于共享方法,协议及数据,从而重现自由能模拟。作者以ST3Gal-I为例阐述了利用BRIDGE在先导化合物的发现和优化中的应用,可协助药物的开发。总的来说,BRIDGE使蛋白质-配体结合自由能计算变得可访问、可重复和可共享,可供新手和高级用户以及地理位置分散的协作用户使用。而且,BRIDGE利用工作流可以实现自由能高通量筛选方法的自动化。
参考文献
Senapathi, Tharindu, et al. BRIDGE: An Open Platform for Reproducible High-Throughput Free Energy Simulations. J. Chem. Inf. Model.2020
Senapathi, Tharindu, et al. Biomolecular Reaction and Interaction Dynamics Global Environment (BRIDGE). Bioinformatics. 2019 Sep 15;35(18):3508-3509