
引言
本文对JMC上发表的66个临床前候选药物进行了分析,以此阐明在确定候选药物时最经常采用的先导化合物生成策略。最常见的先导化合物生成策略(产生候选药物)是从先前已知化合物中找到合适的化合物作为起点(43%),其次是随机高通量筛选(29%)。其余的方法包括集中筛选、基于结构的药物设计(SBDD)、基于片段的先导化合物生成(FBLG)和DNA编码库筛选(DEL)。对从hit到临床前药物分子的理化性质的分析表明,分子量平均增加85(ΔMW = +85),但亲脂性没有太大变化(ΔclogP = -0.2),但也有例外。大多数(>50%)的临床前候选药物被发现在结构上与它们的起点有很大不同,而且更加复杂。
背景介绍
传统的先导化合物生成策略包括随机高通量筛选(HTS)、基于片段的先导化合物生成(FBLG)、基于结构的药物设计(SBDD)、利用已知文献例如快速追随或基于知识的程序以及最近的DNA编码库筛选(DEL)。选择采用哪种策略取决于多种因素,例如每种方法的技术要求、总成本以及每种技术可使用的适当筛选库或化学起点。化学起点的质量会影响前进的方向,因为高质量的hit必然会缩短研发进程。相反,如果初始hit结构的质量较低(如较差的理化性质和药代动力学、存在已知会引起问题的基团、脱靶效应以及较差的活性),则需要进行长时间且复杂的多性质的优化。考虑到制药行业的竞争性质,不同群体正在同时研究多个生物学靶标,甚至可能使用相同的先导化合物生成策略和在相同的化学起点上进行研究。鉴于分子生成的可能性无穷无尽,而且药物发现是主观的多性质优化过程,因此两个不同的研究小组最终得到相同的化合物的可能性几乎没有。正如Murcko所说的那样,伟大的药物化学家需要了解竞争环境,但“不要对IP感到恐慌”,因为在开展hit-to-lead研究时,这种无穷无尽的可能性并不是经常的威慑力量。然而,广泛的专利权利要求会影响操作的自由度,并且还是选择用于先导化合物生成的骨架的考虑因素。本文通过文献研究阐明了与临床前候选药物源头相关的hit分子的方法和类型。为了说明从hit到临床前候选药物所要进行的必要结构修饰,作者对分子特性进行了比较。本研究能够帮助更好地了解新兴的先导化合物生成策略以及对未来药物发现的可能影响。
方法
本文将先导化合物生成策略归为六类(图1):
(1)随机筛选或高通量筛选(HTS):通过随机化合物的收集来筛选小分子,这些化合物对于大型制药企业而言可能是大型化合物数据库(105–106),但也可能较小;
(2)定向筛选:筛选根据目标或化学类别的先验知识选择的较小化合物集,因此也称为集中筛选或偏置筛选;
(3)基于结构的药物设计(SBDD):对化合物集进行计算机虚拟筛选;
(4)基于片段的先导化合物生成(FBLG):通常包含几千种低分子量(<200 Da)化合物的文库,并以高聚集进行筛选;
(5)DNA编码库筛选(DEL):使用涉及将化学化合物缀合到DNA片段的技术,筛选非常大的(通常>108个)小分子化合物库;
(6)已知化合物:基于已知活性化合物、内源配体或先前披露而开始的项目。
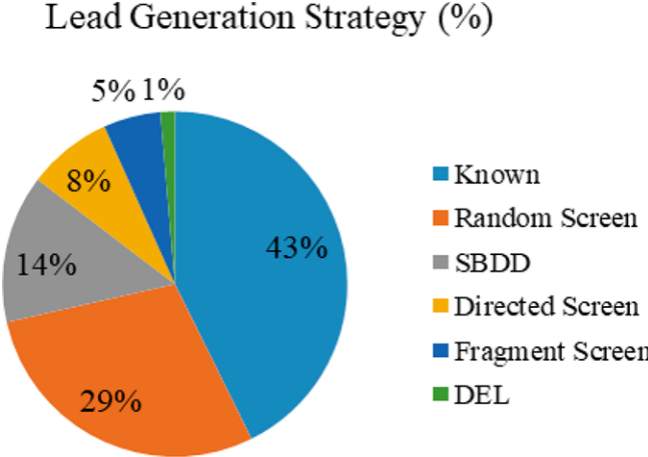
图1. 六类先导化合物生成策略的分布
图片来源于JMC
结果1. 临床前候选药物对应靶标的统计分布
图2展示了66对hit-候选药物对对应的靶标类别和疾病类别分布的情况。在这些案例研究中,约有30%以激酶作为靶标,其次是其他酶(例如磷酸二酯酶、转移酶、蛋白酶等)。GPCR作为靶标占比17%,其次是表观遗传学靶标(9%)。其他类别的靶标还包括离子通道(9%)、其他类(9%)、核受体(1.5%)和蛋白-蛋白相互作用(1.5%)。此外,疾病类型分布依次为肿瘤(30%)、CNS/疼痛(18%)、感染(13%)和代谢性疾病(12%)等。
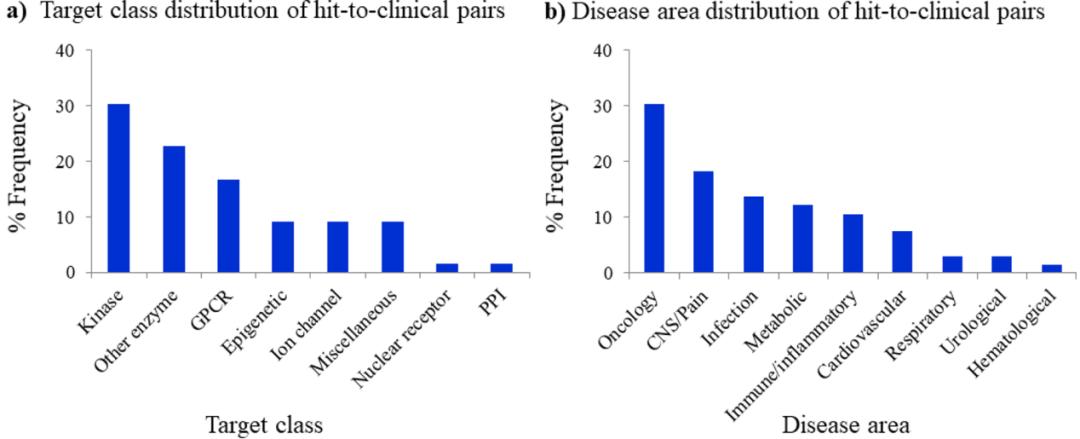
图2. JMC上2016-2017年期间发表的66个hit-候选药物对应的靶标类别分布和疾病类别分布
图片来源于JMC
结果2. 临床前候选药物的理化性质分析
作者还分析了66对hit-候选药物对的clogP、clogD、MW和可旋转键变化,如图3所示。从“已知”化合物和“随机筛选”两类化合物的hit-候选药物对中比较,ΔclogP均未观察到显著变化(ΔclogP= -0.2)。但是,这两个类别都证明了先前已知化合物类别的MW(ΔMW= +63 Da)和随机筛选类别的MW(ΔMW= +95)的增加,66对化合物的总平均值为ΔMW = +84。从hit到临床前候选药物,可旋转键的数量也增加了1(平均值= +1.2),这与MW的增加是相匹配的。
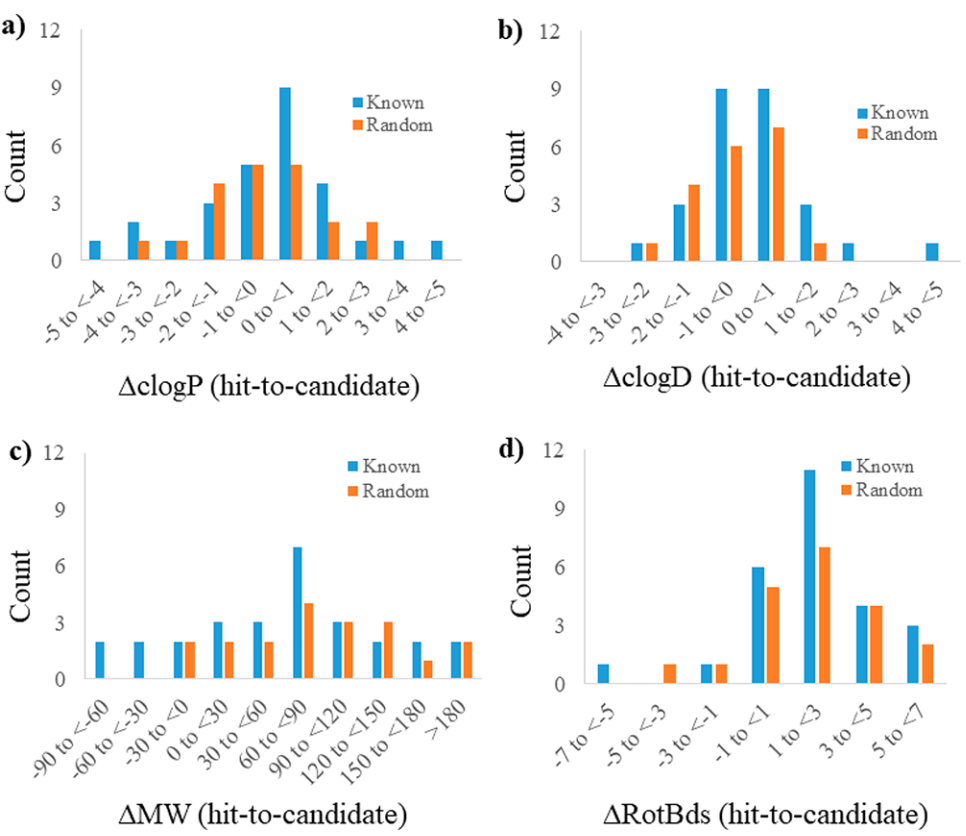
图3. 66对hit-临床前候选药物对的理化性质的分析
图片来源于JMC
结果3. 临床前候选药物的Tanimoto-MCS分析
Tanimoto-MCS可以作为比较手段分析hit和临床前候选药物之间的结构差异。此前已证明Tanimoto值 > 0.8可以认为是结构相似的配体对,我们可以以此来评估从hit发展到临床前候选药物所需的优化程度,结果如图4所示。在许多情况下,优化后的化合物在结构上与hit非常不同,但有趣的是两组计算出的差异均值为0.5,一种可能的假定是与使用以前已知的化合物作为起点相比,HTS中的hit应该需要更多的结构变化,但事实并非如此,因为两组都与初始起点的不同程度近似。最后,计算出的分子复杂性表明,临床候选药物分子实际上确实比其相应的起点更加复杂,表现在重原子的数量从27增加到33,平均增加了四个脂肪族原子和两个芳香族原子,还平均增加了两个氢键受体,并且极性表面增加;而氢键供体和sp3杂化的数量保持不变。此外,从hit到lead的研发过程中,在三分之二(43/65)的情况下,至少增加了一个杂环氮;在三分之一(20/65)的情况下,至少增加了一个氟原子。Young和Leeson详细描述了许多成功的hit-to-lead和lead-to-clinical案例,并概述了使项目团队能够成功实现研发目标的四种主要策略:(a)寻找“必要”的氮;(b)甲基化;(c)氟化和(d)羟基化。
图4. hit-临床前候选药物对的Tanimoto最大通用子结构(Tanimoto-MCCS)的比较
图片来源于JMC
总结
本文通过整合文献案例获得了66对hit-临床前候选药物对,并归类为特定的先导化合物生成方法和分析了分子属性和结构多样性的变化。作者发现大约一半(46%)的临床前候选药物源自先前已知的化合物,第二大类来自随机筛选方法(31%)。此外,还可以从集中筛选、基于片段的先导化合物生成和DNA编码库筛选方法中得到。对理化性质的分析表明,分子量通常是从hit转到临床前候选药物的唯一显著变化,且平均增加了一个可旋转键,但亲脂性几乎没有变化。总的来说,文章分析表明,使用先前已知的化合物作为起点是一种成功的先导化合物发现策略,但随机筛选方法在不存在已知化合物或需要特定作用方式的情况下也是十分有用的策略。其他策略(例如FBLG和DEL)也已经显示出良好的潜力。还应注意的是,很少能直接从筛选hit项目中找到药物,并且大多数临床前候选药物都是进行了重要的化学优化的结果。
参考文献
Dean G. Brown and Jonas Boström, Where Do Recent Small Molecule Clinical Development Candidates Come From? 2018, 61, 21, 9442-9468. DOI: 10.1021/acs.jmedchem.8b00675.