

合成一系列甲酰肽受体 2 (FPR2) 激动剂分子来优化药效和代谢稳定性,并通过对接分析了作用模式。生物学实验表明,化合物能在分子水平和细胞水平抑制炎症。
背景介绍
中枢神经系统炎症(CNS)会损害神经功能并导致神经退行性病变。在炎症消退阶段,专门的促消解介质 (SPM)可促进炎症反应自发消退。SPM 通过特定的膜受体发挥作用,N-甲酰肽受体2(FPR2)是其中的一个重要靶点。FPR2是甲酰肽受体家族的成员,可以被结构不同的激动剂激活。不同的激动剂还会触发FPR2的促炎反应或者抗炎促分解效应。
第一代小分子 FPR2 激动剂(图 1中的compound 43 和compound 17b)在急性心肌梗死模型中显示出不同的心脏保护特性。4-苯基吡咯烷酮类FPR2 激动剂 BMS-986235可抑制中性粒细胞趋化性并刺激巨噬细胞吞噬作用,从而改善心力衰竭小鼠模型的功能。环戊烷类化合物 1(图 1左)在心血管炎症的体外模型中具有抗炎特性。
作者之前开发的脲基丙酰胺类 FPR2 激动剂是化合物 2, 它在亚微摩尔浓度下具有抗炎药效和良好的体外药代特性,机理与脂氧素 A4 (LXA4)类似但活性太弱。作者尝试优化分子,改善药效和药代特性。
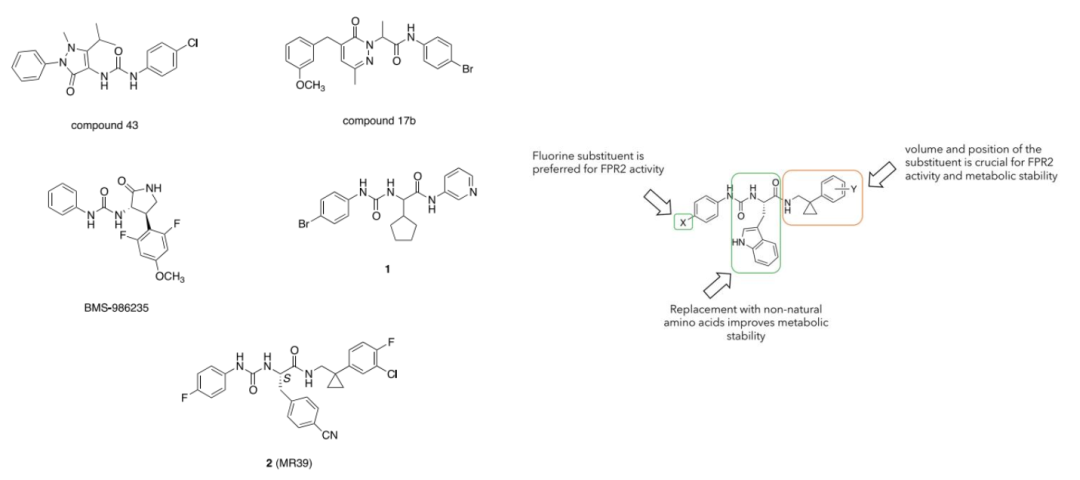
图1. 代表性的FPR2小分子激动剂(左)和设计策略(右)。图片来源:JMC
主要内容
作者从化合物2出发合成了一系列分子,发现氟取代基可提高活性,吲哚改成芳香族残基可显著提高稳定性。苯基环丙基甲基片段的体积和位置对 FPR2 的活性和代谢稳定性十分重要(图 1右)。大取代基可改善代谢稳定性,但会降低活性。为了兼顾两者,作者用不同基团替换苯基环丙基片段。作者先引入杂环(如表1所示),确定最佳的取代基,再优化代谢稳定性。
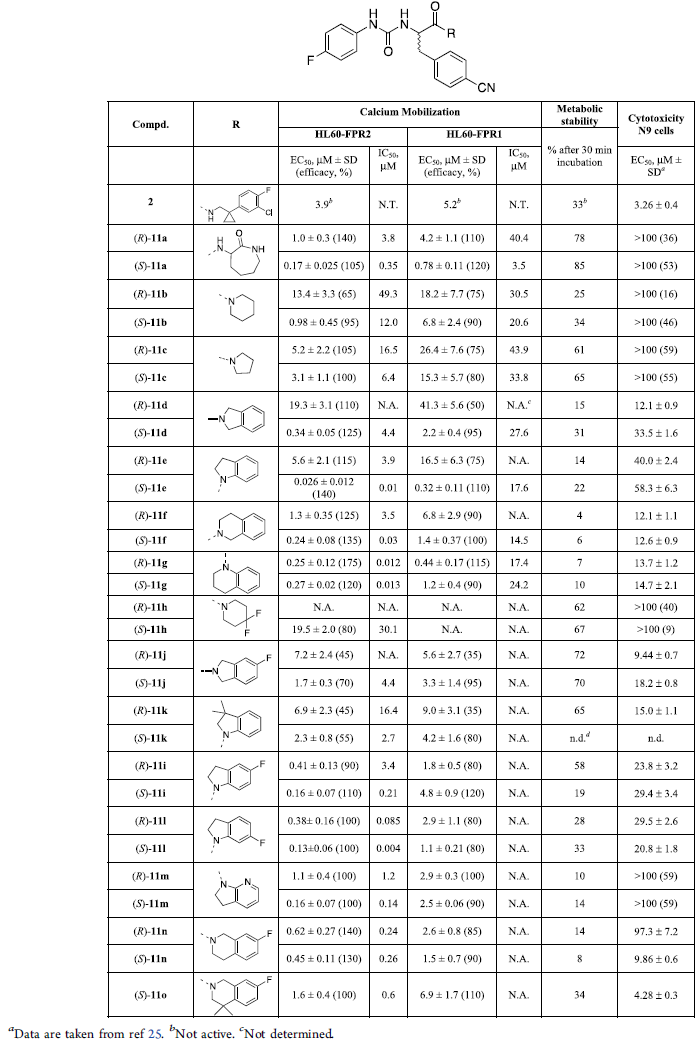
表1. 合成化合物的活性(IC50)、诱导拮抗作用(EC50)、代谢稳定性、毒性。表格来源:JMC
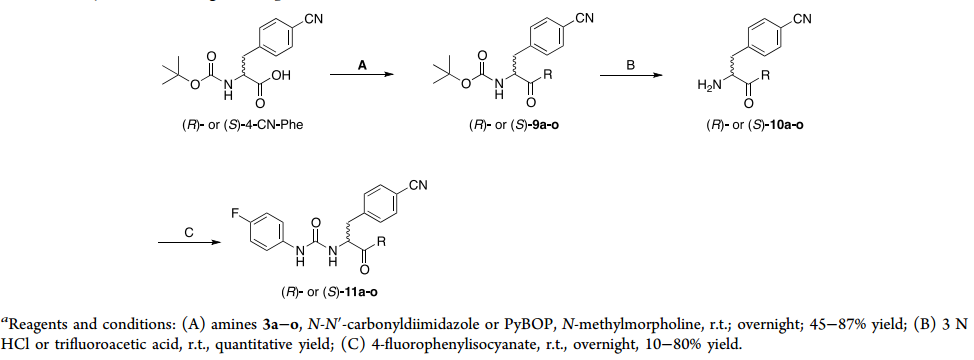
Scheme 1. 目标化合物的合成路线。图片来源:JMC
活性和代谢稳定性分析
作者测量化合物在转染FPR的HL-60 细胞中诱导钙离子的能力来评估活性,记作EC50。此外,考虑到FPR1和FPR2在用激动剂刺激后,可能出现拮抗作用,作者还用 FPR标准激动剂产生的抑制作用来评估化合物在 FPR诱导拮抗作用的水平(IC50,表 1)。
与 2 相比,ε-己内酰胺衍生物 (S)-11a 的药效增加了 20 倍,哌啶基衍生物 (S)-11b 的效力比 2 高 4 倍,而吡咯烷衍生物 (S)- 11c 与 2 等效。在这组化合物中,(S)-对映异构体比 (R)-对映异构体更有效。在杂环衍生物11d、11e、11f、11g观察到相同的趋势。更重要的是,所有 (S)-对映异构体的效力至少是 2 的 10 倍,其中 (S)-11e 是该组中最有效的 (EC50 = 26 nM)。结果表明与酰胺相连片段的大小和手性对 FPR2 的激动效果有很大影响。
作者发现分子随着活性提升,代谢稳定性会变差。于是作者尝试修饰11b、11d、(R)- 11e 和11f,阻止分子氧化代谢。11b和11h在4位取代后,提升了代谢稳定性,活性降低 20 倍。11e在二氢吲哚的修饰后也出现相同情形,11e引入氮杂基团均降低了活性和代谢稳定性。与第一组化合物对比,结构修饰提高了选择性,其中11i的选择性达到了30倍。所有化合物都能够有效降低钙离子流动,IC50 总体达纳摩尔级,FPR1的IC50 在微摩尔级。第二组化合物中的修饰虽然没有提高活性,但是显著提升了代谢稳定性。
分子模型
已发表的FPR2复合物的结构中,分子在GPCR中呈现经典的跨膜排列的姿势,宽阔的结合口袋位于膜的上三分之一处,并对外部环境呈开放状态。正负电荷、脂肪和芳香片段指示了口袋中的结合热点区域。
对接方法为:以SMILES输入,在Maestro中生成各式手性三维构象,然后用Open Babel通用力场优化。作者采用Maestro的Protein Preparation Wizard处理受体蛋白(A链,PDB:6OMM),移除配体和水分子,加氢,优化坐标并加电荷。接着使用AUTODOCK对接分子构象,按照构象的最佳自由能,筛选并作为配体最佳结合模式。
先对接的分子是compound 43。结果表明4-氯脲基苯基片段与 Phe110、Trp254 和 Phe257形成堆积作用,与Asp106 和 Arg201 形成氢键。上半部分的苯环与His102 和 Phe178形成堆积作用,异丙基与 Leu81 和 Val105 产生范德华力(图 2左上)。这些都是激活FPR 的重要残基。
(S)-11e 也有相似的结合模式, 4-氟苯基环和脲基片段形成相同的相互作用,经水分子与Ser288形成作用(图 2右上)。二氢吲哚还与 Arg201 的胍结合成电荷转移复合物。(S)-11e与 Glu89 共同吸住一个水分子。 (R)-11e 反向构型降低了结合效率。
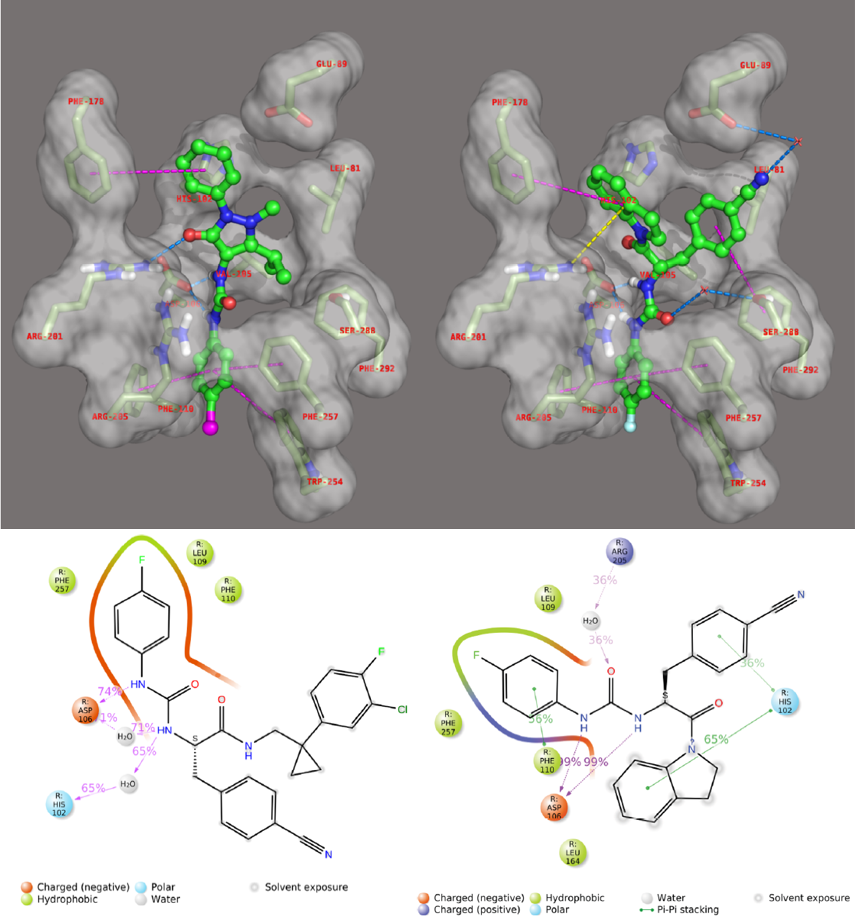
图2. 上:Compound 43(左)和(S)-11e(右)在FPR2活性位点的结合模式(PDB:6OMM)和下:2(左)和(S)-11e(右)的相互作用图。图片来源:JMC
小体积的二氢吲哚可以让(S)-11e产生更多的活性构象,而环丙基迫使 2 的结合活性构象更加扭曲。因此,(S)-11e与残基结合的时间更长,结合的构象更加多样且牢固。该结论通过分子模拟得到了证实。在图 2 相互作用图中,(S)-11e和2的 4-氟苯基脲基片段能够产生与 Leu109、Phe110 和 Phe257 的疏水相互作用,相比之下, 2 仅 70% 通过脲基片段的相互作用锚定到受体表面, 4-氰基苯基和环丙基部分不会接触受体的其他部分。
(S)-11e 几乎 100% 通过几个氢键直接与 Asp106 结合,并通过水分子与 Arg205 结合。二氢吲哚和 4-氰基苯基环也与 His102形成π-π 堆积作用。此外,分子模拟表明构象中心到受体的距离也有显著差异,尤其是在模拟的最后 500 ns 中:2和(S)-11e的构象到受体的平均距离为 11.10 ± 0.38 和 10.19 ± 0.26 Å。结果表明后者与受体结合得更好,如图3所示。
图3. 2和(S)-11e的模拟过程中构象中心到受体的距离的变化情况(上)和对接结果(下)。图片来源:JMC
生物学实验
作者用N9 细胞MTT测定细胞毒性。结果显示11a、11b、11c、11h无细胞毒性,其余化合物仅在微摩尔浓度下具有细胞毒性。作者使用LPS(革兰氏阴性菌细胞壁内毒素)诱导细胞内产生炎症,以评估药物阻断炎症的效果和细胞毒性作用。在静息条件下,除了化合物(S)-11g和(R)-11l之外,其余化合物对细胞活力没有显著影响。
接着评估药物对促炎介质 IL-1β 和 TNF- α分泌的影响。结果表明化合物 (S)-11a、(S)-11e、(S)-11i 和 (S)-11l 能够有效减少 LPS 诱导的细胞因子产生,表现出抗炎特性。
除此之外,评估了(S)-11e和(S)-11l在静息条件下和用 LPS 刺激 24 小时后对细胞活力和一氧化氮产生的影响。两种化合物在静息条件下均未对细胞活力或 NO 产生任何影响,这证实它们没有促炎作用。
作者还评估了(S)-11e 和 (S)-11l对线粒体膜电位和对半胱天冬酶 3 活性的抑制作用,发现LPS可以显著降低胶质细胞线粒体膜电位。而用 (S)-11e 或 (S)-11l 预处理可使 LPS 刺激 24小时后的线粒体膜电位正常化。作者发现 LPS 刺激还可促进促炎介质释放加速细胞凋亡, (S)-11e和(S)-11l 预处理细胞可显著缓解凋亡。这表明两种化合物都具有神经保护、抗炎和促分解作用。
选取(S)-11l做体内药代动力学实验。腹膜内注射后,(S)-11l较快到达体循环,给药后30 min血药浓度最高,在血浆给药后 8 小时。大脑采样证实 (S)-11l能够渗透血脑屏障并在脑中蓄积。
结论
为了研发具有更好药代性质的FPR2激动剂,作者通过合成及计算方法得到了一组高效且代谢稳定的化合物。一系列生物学实验表明这些化合物具有抗炎作用并可穿透血脑屏障。
参考文献
Margherita Mastromarino, Maria Favia, Igor A. Schepetkin, Lylia N. Kirpotina, Ewa Trojan, Mauro Niso, Antonio Carrieri, Monika Leskiewicz, Magdalena Regulska, Massimiliano Darida, Francesco Rossignolo, ́Stefano Fontana, Mark T. Quinn, Agnieszka Basta-Kaim, Marcello Leopoldo, and Enza Lacivita. Design, Synthesis, Biological Evaluation, and Computational Studies of Novel Ureidopropanamides as Formyl Peptide Receptor 2 (FPR2) Agonists to Target the Resolution of Inflammation in Central Nervous System Disorders, 2022, XXXX, XXX, XXX-XXX