背景
药物设计的一个主要目标是针对特定靶标获得高亲和力的配体,同时保持对潜在脱靶的选择性以减少副作用。当靶标和脱靶之间的结合位点趋于保守时,设计选择性配体就变得困难重重,已被报道的选择性抑制剂的潜在分子机制通常仍不清楚。N-肉豆蔻酰基转移酶(NMT)催化一种共价修饰反应,将14碳饱和脂肪酸从肉豆蔻酰辅酶A上转移到一系列真核和病毒蛋白的N-末端甘氨酸上。肉豆蔻酰基化在真核生物中是一个共翻译修饰过程,并在诸如信号级联转导,膜泡运输和蛋白定位等细胞进程中发挥重要作用。NMT对寄生虫的存活和毒性至关重要,是一个非常有前景的用于抗癌和一系列寄生虫和病毒性疾病的药物靶标。来自原生动物寄生虫(LmNMT)和人源HsNMT1,两种酶序列相似度为45.4%,但具有高度保守的结合位点,仅有3个残基不同。以该酶为研究对象,通过计算和实验结合的方法,揭示具有保守位点的蛋白质中决定选择性的特征并指导科学家理性设计这类蛋白的选择性抑制剂。
分子动力学模拟结合X-射线晶体学
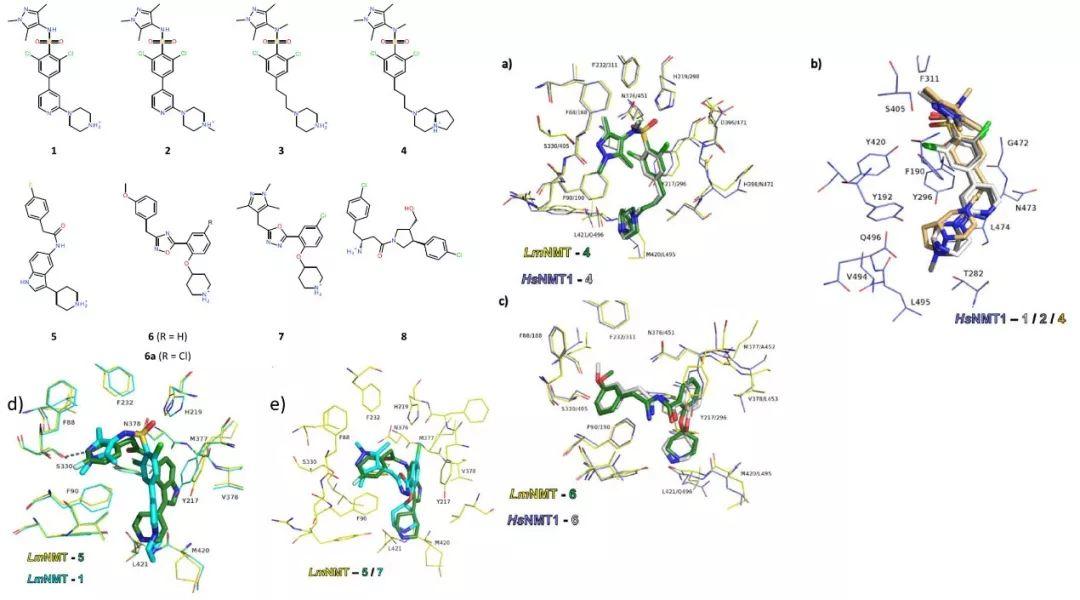
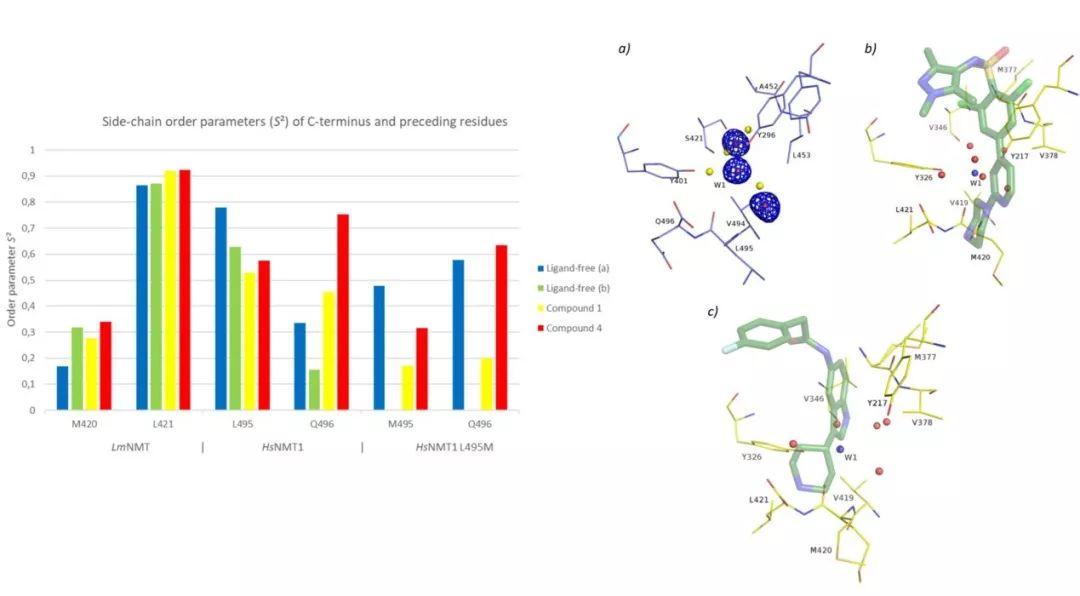
从文献中收集了8个NMT抑制剂,1-3为非选择性配体,4-6和8为LmNMT选择性配体,6a和7为HsNMT1选择性配体。所有化合物都含有碱性中心与C末端相互作用但是是与具有开放结合位点的构象结合,即由于Tyr217的旋转,化合物能够进入主要的疏水口袋。对化合物5而言,其对LmNMT和HsNMT1的选择性达到了约108倍,为了详细解释造成选择性的原因,进行了与分子动力学模拟结合的定点突变实验以获得配体与LmNMT和HsNMT1结合的具体情况。配体不是与两酶不同的三个氨基酸残基的侧链原子直接相互作用,因此将彼此不同的残基相互交换即获得具有HsNMT1结合位点的LmNMT,反之亦然。突变结果显示1-3和4只稍微改变选择性,化合物5的选择性大幅下降。而仅突变一个氨基酸则使得抑制剂4选择性大大提高。进行野生型和突变型的空蛋白结构以及与配体结合的复合物的MD模拟,所有模拟显示蛋白质高度的稳定性,在50ns内没有更大的构象变化。计算侧链有序参数(S2)来量化侧链柔性的改变。数值越低柔性越高,在所有模拟中,化合物4结合HsNMT1时,观察到C末端残基Gln496侧链柔性的剧烈降低,证明4的选择性是由侧链柔性变化造成的并观察到侧链柔性变化使得配体远离残基。化合物5的选择性则由结合位点内的水网络有关,MD轨迹模拟出的水密度图显示水分子W1与HsNMT1的结合强于对LmNMT的结合,且5的结合需要在HsNMT1替换W1,突变后的MD模拟进一步证实了W1对于化合物5的选择性至关重要的假设。化合物6和8的结合模式使用X-射线晶体学和MD模拟证实了针对NMT的选择性分别由水分子的干扰和侧链柔性的改变造成。
虚拟筛选
基于在HsNMT1中水分子W1位置导致选择性差异的假设进行LmNMT选择性抑制剂的基于药效团模型的虚拟筛选。药效团的核心特征是需要一组干扰假阳性靶标HsNMT1中的W1,位置与化合物5的C2相似,另外,添加抑制剂1-7与NMT的相互作用以获得合理的结合亲和力。接着将药效团查询到的分子对接到结合位点,并选择6种化合物用于测试酶抑制能力。实验证实了化合物筛选得到的化合物9-11具有对LmNMT的特异性和选择性。结晶结果支持化合物的选择性是由通过W1干扰的假设。
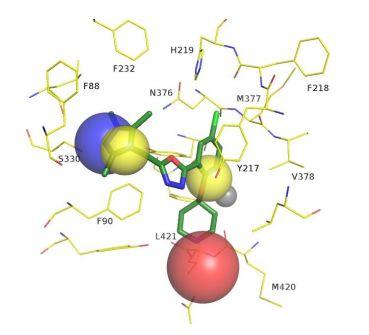
图3. 用于虚拟筛选的药效团模型
图片来源JMC
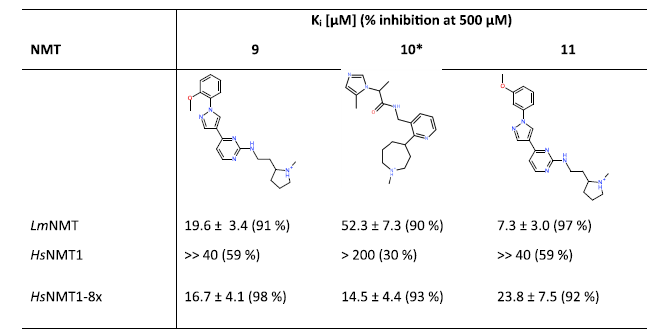
表1. 化合物9-11在500μM的抑制百分比
表格来源JMC
计算部分总结
靶点
寄生虫源N-肉豆蔻酰基转移酶(简称LmNMT),人源N-肉豆蔻酰基转移酶(简称HsNMT1)
筛选化合物库
ZINC 15约68万化合物库
计算方法
分子动力学模拟(Molecular Dynamics Simulations),基于药效团筛选(Pharmacophore Model),分子对接(Docking)
计算软件
分子动力学模拟:AmberTools17, Gaussian09, VMD 1.9.2
虚拟筛选:MOE 2015.1001
药效团模型:Omega
分子对接:LeadIT-2.1.6
总结
本文采用计算机辅助药物设计和实验结合的策略,使用分子动力学模拟,等温滴定量热法,酶抑制测定,定点诱变和X射线晶体学结合的方法,确定了两种具有高度保守结合位点的不同来源的N-肉豆蔻酰基转移酶的不同选择性的决定因素并提供了可量化的指标。侧链柔性的变化和干扰水分子都能造成选择性的差异。并对68万化合物库进行虚拟筛选,通过分子对接发现了经理性设计得到的受水分子干扰的3种LmNMT选择性抑制剂,成功将文中知识运用在了具有高度保守结合位点的蛋白的选择性抑制剂设计中。
参考文献:
Kersten, C.; Fleischer, E.; Kehrein, J.; Borek, C.; Jaenicke, E.; Sotriffer, C.; Brenk, R. How To Design Selective Ligands for Highly Conserved Binding Sites: A Case Study Using N-Myristoyltransferases as a Model System. Journal of medicinal chemistry 2019, 10.1021/acs.jmedchem.9b00586
