背景介绍
基于片段的药物发现(FBDD)已经成为一个用来识别探针分子和先导化合物的强大工具。过去20年里,FBDD发现了4种已批准的药物,数十种FBDD衍生化合物目前正在临床试验中。
片段热点映射不同于其他方法,它提供了对片段利用结合位点内特定相互作用的倾向的定量估计。此外,图的可视化使用户对结合口袋有了直观理解。这两个特性的结合使得这种方法对于以理性和数据驱动的方式发现命中片段的方法来说特别有吸引力,同时也支持专家的洞察力和直觉。
哈佛大学Mihaela D. Smilova团队开发了一种“集成”热点图方法(图1)。通过比较两个集成映射,可以得到一个热点选择性映射。这从蛋白结构维度解释了决定化合物对同一蛋白结构域家族成员的选择性差异。结果图可以通过Hotspots API自动生成的脚本在PyMOL中可视化,或者在任何支持.ccp4或.grd格式的分子查看软件中进行可视化。这种方法已经在Exscientia公司的许多药物发现项目中被采用。作者以溴域蛋白BRD1和BRPF1,CAMK家族激酶p38α和ERK2,以及更远缘的激酶PIM1和CK2α为例对该方法做了介绍。
项目代码公开地址
https://github.com/prcurran/hotspots
https://github.com/ccdc-opensource/hotspots/tree/master
https://github.com/CMD-Oxford/hotspotEnsembles
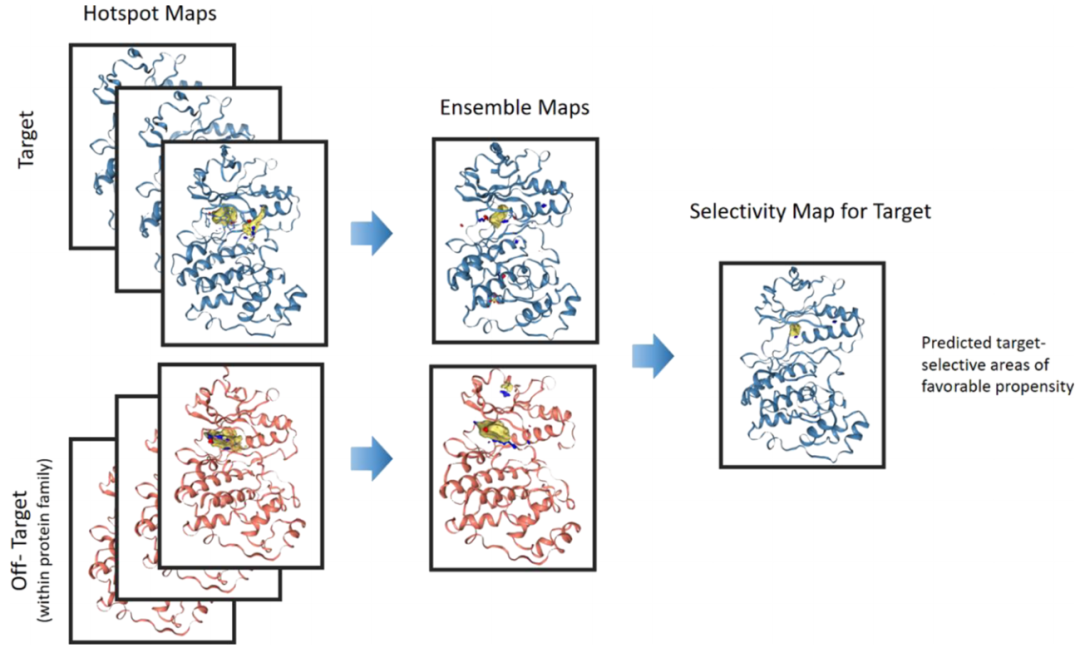
图1. 生成集成和选择性映射的工作流程。图片来源:JCIM
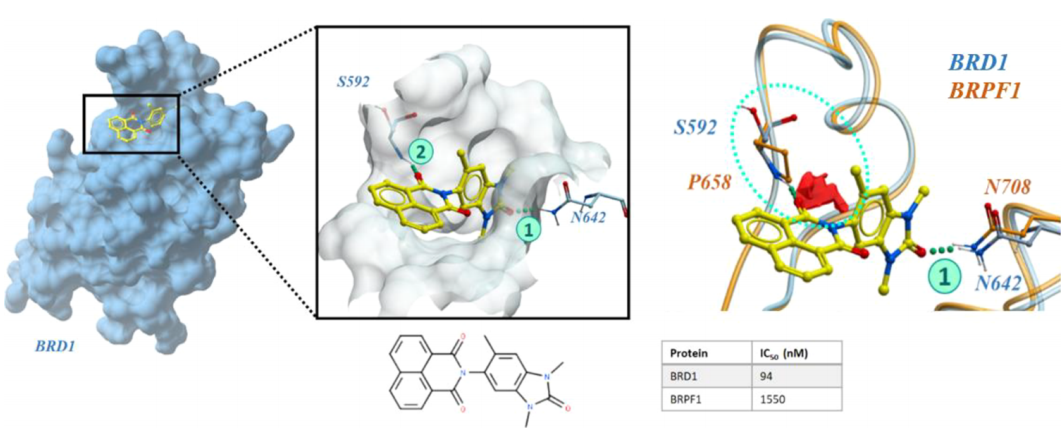
溴域:BRD1和BRPF1之间的选择性
溴域蛋白属于一种表观遗传调控因子家族,在过去的十年中,研究者对选择性溴域抑制剂的开发产生了重要的兴趣。首先,作者使用23个BRD1和26个片段结合的BRPF1结构计算了集成图。图2显示,这些图谱能够识别选择性结合特征,自动捕获这些信息,而不需要肉眼检查大量的蛋白质结构。BRD1和BRPF1的受体选择性图证实了这种差异,由受体倾向的区域(红色)显示。在这个例子中,从一个集合中生成选择性图是至关重要的,因为选择性特征并不存在于来自BRD1结构的所有单个图中。这是由于氢键对供体和受体基团的取向敏感,其中主链中的扭曲运动可能意味着在少数构象中没有检测到这种特征。
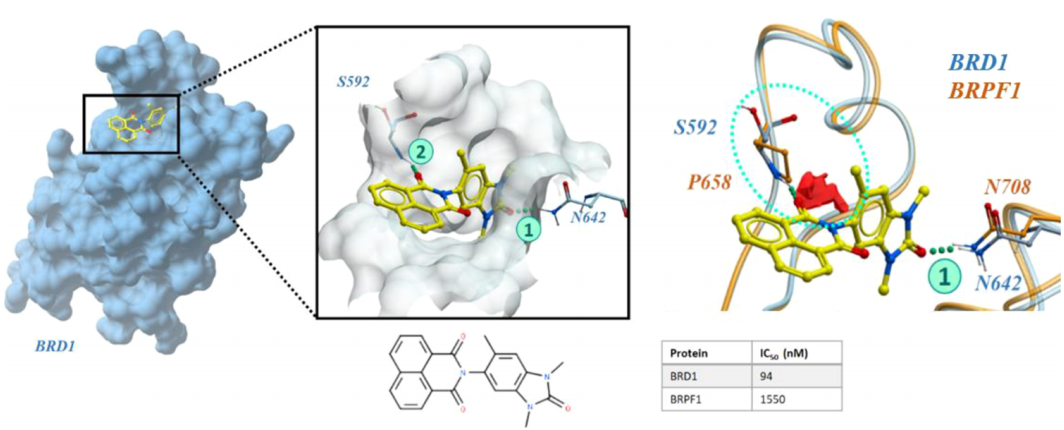
图2. 人类溴域的选择性:BRD1优于BRPF1。图片来源:JCIM
设计密切相关的激酶:p38α和ERK2之间的选择性
在人类蛋白激酶家族中,一个被称为“守门人”的ATP结合口袋残基是选择性的一个重要决定因素。这是被p38α选择性抑制剂SB1所利用的,如图3,它对相关的MAPK激酶,尤其是ERK2具有选择性。5个片段结合的p38α结构对17个ERK2的片段结合结构的非极性选择性图可以识别和突出抑制剂结合的选择性疏水口袋,如图3所示。
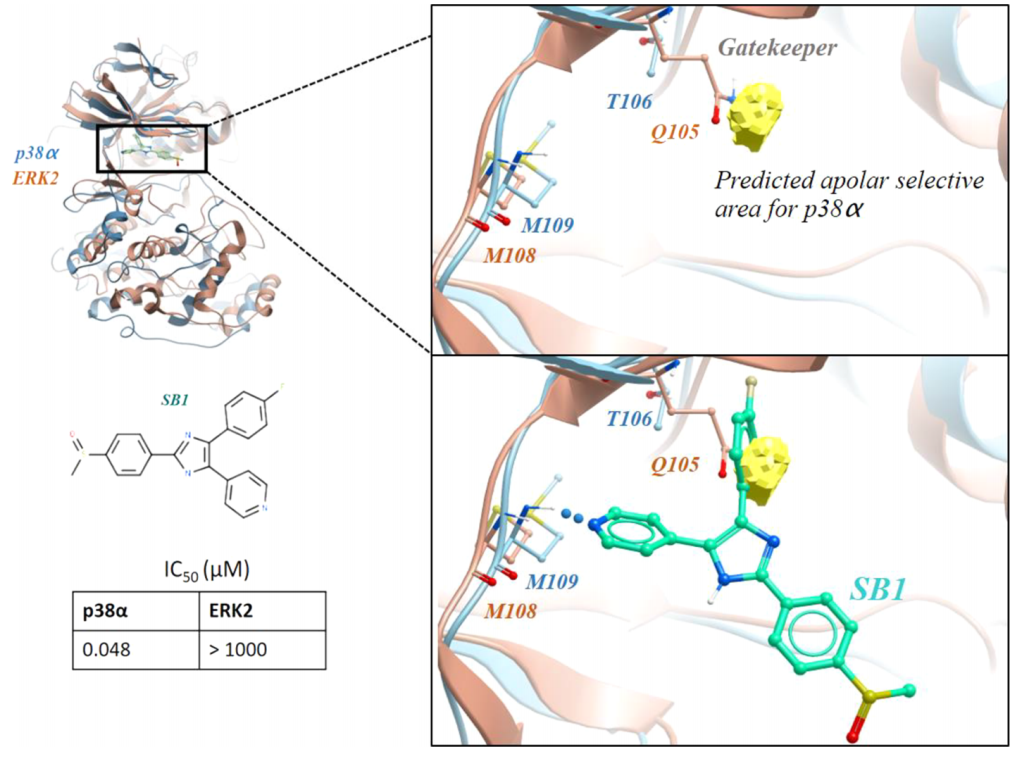
图3. 激酶选择性:识别gatekeeper的差异。图片来源:JCIM
SB1的氟苯基占据了p38α的选择性疏水后袋,并与ERK2的谷氨酰胺gatekeeper发生冲突。热点映射能够仅使用片段结合结构作为集成映射的输入来识别这个特征。在针对p38α进行片段筛选的情况下,选择性图可以用来指示哪些片段(以及片段中的化学基团)可能对p38α而不是ERK2具有选择性,这为在化合物设计过程的早期阶段实现选择性提供了建议。
尽管只使用了5种结构,但p38α集合中的所有配体都有独特的Murcko支架,而且它们都探索了选择性口袋。最小药效团氯苯酚与典型激酶铰链热点相比,它优先探索gatekeeper后面的选择性区域。ERK2集成包含更多的结构和更高的配体多样性(19个结构和11个独特的框架),而结构如PDB ID:3ERK(不包括在集成因为它在300Da限制下)可以达到口袋ERK2,大多数ERK2片段则不能。尽管p38α集合中的结构数量相对较少,而且p38α和ERK2集合之间的结构数量明显不平衡,但该方法仍然能够帮助识别选择性特征。
CK2α和PIM1:与同一配体结合的远缘激酶
在最后一个案例研究中,作者探索了一个来自不同亚家族的激酶之间选择性的回顾性例子:人类CK2α(CK2亚家族)和人类PIM1(CAMK亚家族)。
CX-4945最初是作为一种ATP竞争的口服CK2α抑制剂来开发的,对其靶标具有nM亲和力,但对PIM1激酶显示出脱靶活性。CK2α抑制剂CX-5279则保留了对CK2α的亲和力,同时对PIM1具有选择性。
CK2α对PIM1的非极性选择性图显示了CK2α中的一个非极性倾向区域。由于 PIM1 结构中残基 F49 的构象,该区域在 PIM1 中是不可接近的(图4)。选择性图表明,在苯基位置的苯环上放置一个更大的、高亲脂性的取代基可能会提高CK2α对PIM1的选择性,这与文献报道的一致。
CK2α和PIM1之间的另一个区别在于铰链区域,并且可以通过选择性图来识别。供体选择性图突出显示了这个特性(图4)。但文献中表示这部分对选择性没有明显影响。然而,所得到的配体亲脂性较低,并形成额外的氢键,这在设计过程中是可取的;选择性图证明了这种修饰。在非极性选择特征的情况下,对整体结构的目视检查显示,F49始终采用与选择性配体相冲突的向内构象,增加了对该特征的选择性的信心。
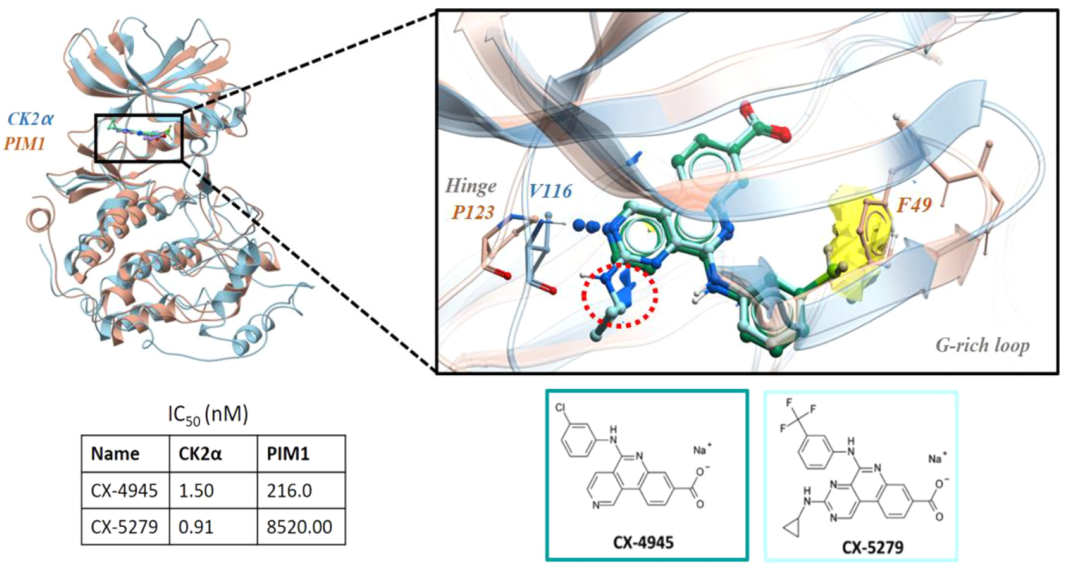
图4. 调节CK2α抑制剂对PIM1的选择性。图片来源:JCIM
探索和调整方法参数
集成映射的质量高度依赖于输入集成数据的质量和数量。集成的一个关键属性是所包含的结构的数量。而晶体学片段筛选实验可以提供多达数十个配体与目标蛋白复合物结构,这样的数据并不总是可用的。通过降低集成图的频率阈值,单个结构对集成图的贡献也可以在更大的集成中被放大。对此,作者给出了不同的阈值范围设定的建议。
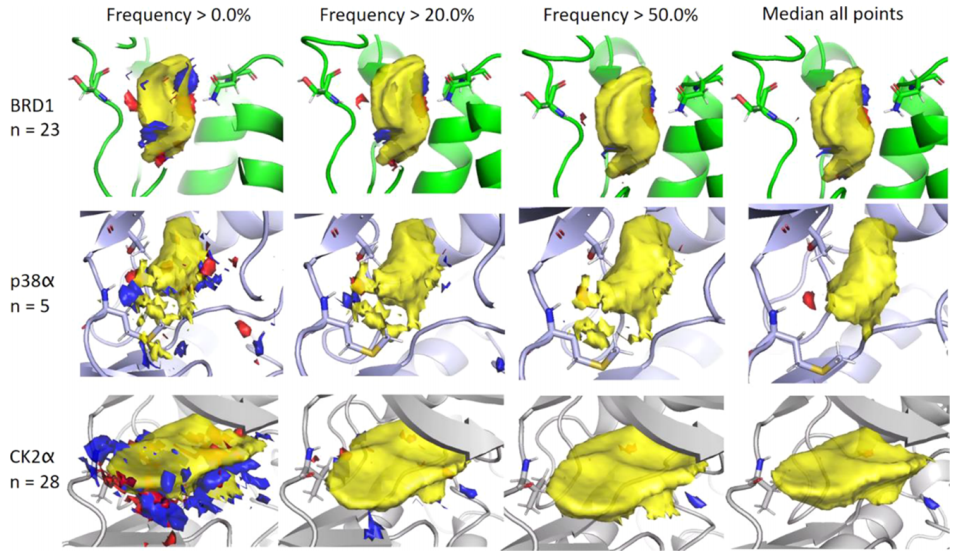
图5. 设置集成图的频率阈值参数。图片来源:JCIM
在组装蛋白质集合时需要考虑的另一个关键点是相互排斥的蛋白质构象状态的存在。在上面讨论的激酶例子中,只包括了DFG-in构象中的结构。在蛋白质可以采用互斥状态的情况下,作者发现,为每个状态编译单独的集合可以为根据特定构象设计化合物提供更详细的信息。
原则上,理想的选择特征既得分很高,又与其他具有脱靶结合倾向的特征保持合理的距离。作者在文中给出了在不同情况下进行计算分析设定的不同截止值范围。
选择性图谱识别了同一蛋白家族中
不同目标子集之间的选择性决定区域
在确定选择性图能够识别同一家族中蛋白质对之间的已知的选择性特征后,作者开发了一种程序,允许跨目标蛋白家族进行自动和客观的分析。
作者再次选择关注人类溴域,图6中,作者选择BRD1作为目标蛋白,并与高序列同源性和低序列同源性脱靶进行比较。选择性图被组合成“总结”选择性图,使用为编译集成图而开发的方法。频率截止点被设置为零。总结选择性映射包含关于可以利用该特性的特定脱靶目标的信息。两个显著特征如图6所示。
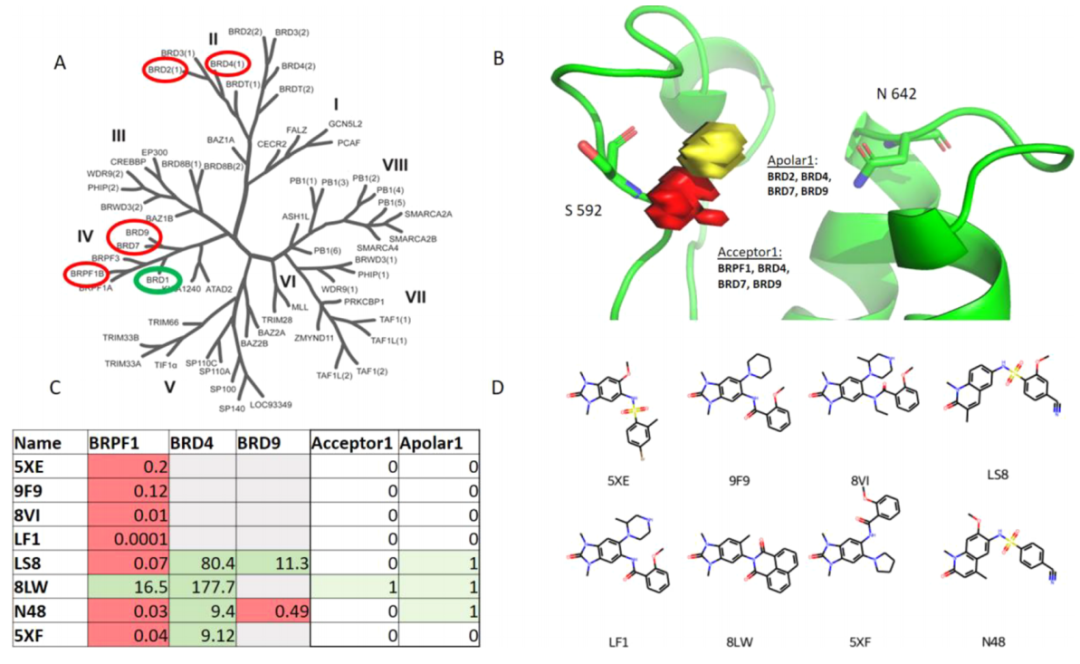
图6. 选择性图识别了同一蛋白家族中目标子集的选择性决定区域。图片来源:JCIM
接着作者在文献中鉴定了已发表的抗BRD1活性的化合物,以及至少一种脱靶以及已发表的具有至少一种脱靶的复合物的晶体结构。确定了8种化合物,它们可用于结合BRD1和至少一种脱靶物,它们也已与其中一种感兴趣的蛋白质在复合物中结晶。
使用Hotspots API对这8种化合物的结构进行了重新编码,以确定与预测的选择性区域相互作用的取代基。如果在复合结构中至少有一个重原子获得了一个特定的特征(图6 C中的最后两列),则定义一个命中。
选择性图证明能够检测到这些特征,而且由于对复合构象的评分计算速度非常快(每个构象几秒钟),这类分析可以用来客观地对大批量对接的潜在后续构象进行评分。之前发布的Hotspots API还允许从图中提取药效学特征,然后可以作为CrossMiner等程序的输入,用于化合物的生长和合并。
结论
调节化合物的选择性时,蛋白质家族中的结合位点比较是一个关键信息。结合位点的差异可以用来赋予特定靶点的选择性,而共享区域可以提供很多药理学的见解。随着结构化数据数量的增长,需要自动化的方法来处理、总结并向用户呈现这些数据。本文中,作者证明了片段热点映射能够识别在过去的药物发现中用于引入选择性的选择性决定域。集成图和选择性图是一种快速和可扩展的方法,可以直观地呈现密切相关的蛋白的结构信息,并产生实现选择性的假设。
参考文献
Smilova MD, Curran PR, Radoux CJ, von Delft F, Cole JC, Bradley AR, Marsden BD. Fragment Hotspot Mapping to Identify Selectivity-Determining Regions between Related Proteins. J Chem Inf Model. 2022 Jan 24;62(2):284-294. doi: 10.1021/acs.jcim.1c00823. Epub 2022 Jan 12. PMID: 35020376; PMCID: PMC8790751.