药物发现的目的是为了寻找具有特定化学特征的新型化合物,这些化合物可以作为先导化合物进一步研究。高通量虚拟筛选(High-throughput Virtual Screening,HTVS)已被证明是一种有前景且资源有效的先导化合物开发工具,为了说明HTVS对制药行业新型化学系列挖掘的积极影响,美国Janssen公司总结了3个应用高通量虚拟筛选方法加速先导化合物开发的研究案例,于2月份发表在JCIM杂志上。这3个前瞻性案例的研究靶标分别是Bruton Tyrosine Kinase (BTK)、RAR-Related Orphan Receptor γ t (ROR γ t)和Human Leukocyte Antigen DR isotype (HLA-DR)。前面我们介绍应用HTVS筛选到六种BTK抑制剂的BTK研究案例以及同源模建获得蛋白结构后应用HTVS筛选到ROR γ t抑制剂的ROR γ t研究案例,今天这篇文章主要为大家介绍HLA-DR研究案例。
背景
II类主要组织相容性复合物(MHC-II)糖蛋白在抗原呈递细胞如B细胞,巨噬细胞和树突细胞的表面共表达。三种人MHC-II分子,人白细胞抗原(HLA)-DR、HLA-DP和HLA-DQ,将抗原肽呈递给CD4 + T细胞并引起抗原特异性CD4 + T细胞活化和免疫应答刺激。每种MHC-II蛋白可以结合多种肽,一些肽也可以结合多种MHC-II等位基因。这种结合控制着抗原特异性反应,即身体抵抗多种可能病原体的特异性免疫反应。HLA-DRB1基因是调控类风湿性关节炎(RA)最重要的风险因素。由RA相关的HLA-DRB1等位基因编码的分子在DR-β链中共享一个共同的氨基酸序列,称为共有表位(SE),85%的RA患者携带至少一个MHC II类风险等位基因。因此,靶向HLADR、抗原肽和T细胞受体(TCR)之间的相互作用是阻止RA产生的关键。
HLA-DR蛋白是由α链和β链组成的异二聚体,如图1所示。每个亚基由两个细胞外结构域组成,即跨膜结构域和细胞质尾部。如图中晶体结构PDB ID 1J8H所示,当与TCR复合时,TCR位于肽结合口袋的正上方,并与MHC-II和肽接触。肽结合口袋是暴露于溶剂的大开放腔,由子袋P1-P9组成。肽的结合特异性来自与一系列相对深的疏水子袋(由等位基因特异性多态性残基组成)的相互作用,为给定等位基因的每个给定口袋提供不同的化学环境。P1口袋是最大且最重要的用于结合抗原肽的位点,而P4在SE中被观察到具有高可变性。
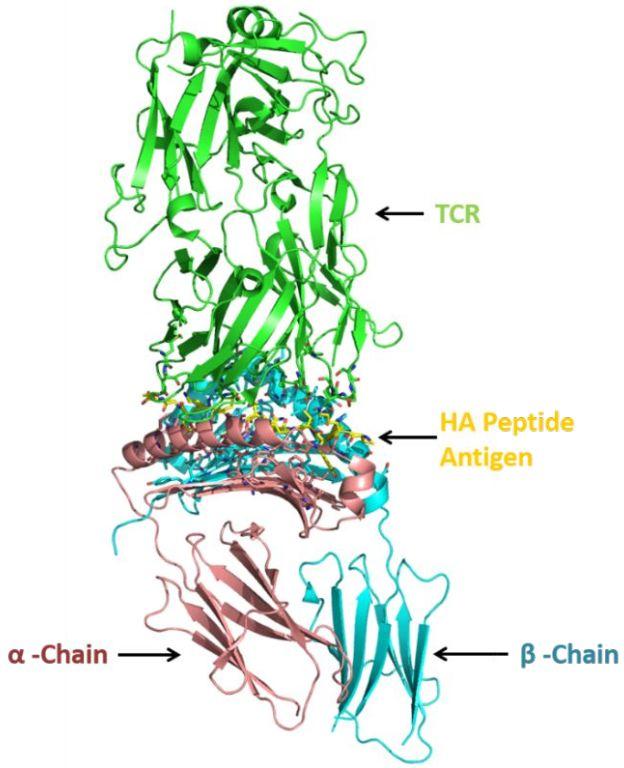
图1. 与人α/βT细胞受体和流感HA抗原肽(PDB ID 1J8H)复合的HLA-DR4的结构。
对于PPI靶标,筛选阻止关节炎肽表面呈递的小分子抑制剂是特别具有挑战性的。结合位点是大的溶剂暴露的口袋,其对于实现小分子抑制剂置换抗原肽提出了挑战。虽然目前已有HLA-DR4 / DR1的有效肽模拟抑制剂,但迄今为止报道的HLADR4的小分子抑制剂41只有非常低的抑制效力(17-50μM),突显了其小分子抑制剂筛选的难度。
口袋评估和验证
迄今为止,没有已知的HLA-DR共晶结构可用于小分子对接。因此,虽然结合口袋的位置是已知的,但如前所述,该部位非常大,暴露于溶剂中并包含九个子袋P1-P9。研究者首先使用vMAP23对口袋体积进行分析,以确定哪个子袋最适合于小分子结合并以此进行虚拟筛选。HLA-DRB1 * 04:01(PDB ID 4MD4)和HLA-DRB1 * 04:04(PDB ID 4MD5)等位基因被选择用于该研究,因为它们含有由> 80%的RA群体携带的SE。
如图2所示,研究者在HLA-DRB1 * 04:01和HLA-DRB1 * 04:04结构中找到了三个不同的子袋:P1、P4和P9。P1及其相邻的子袋区域具有约800 Å3的体积和两个等位基因的显着疏水体积。P4和相邻的子袋区域在HLA-DRB1 * 04:01中具有614 Å3的体积,但在HLA-DRB1 * 04:04中体积略大,体积为886 Å3。P1和P4一起为小分子设计提供了显着的体积和多样化的锚点。对于HLA-DRB1 * 04:01、P9及其相邻的子袋区域的体积为1166 Å3,其中282 Å3位点暴露于溶剂。但是,这个口袋在HLA-DRB1 * 04:04中较小,体积为48 Å3(暴露于溶剂中为101 Å3)。该口袋还具有显着的疏水体积。基于该分析,可以得出结论,P1是具有显着体积的最深口袋,并且可能是HTVS的最佳口袋
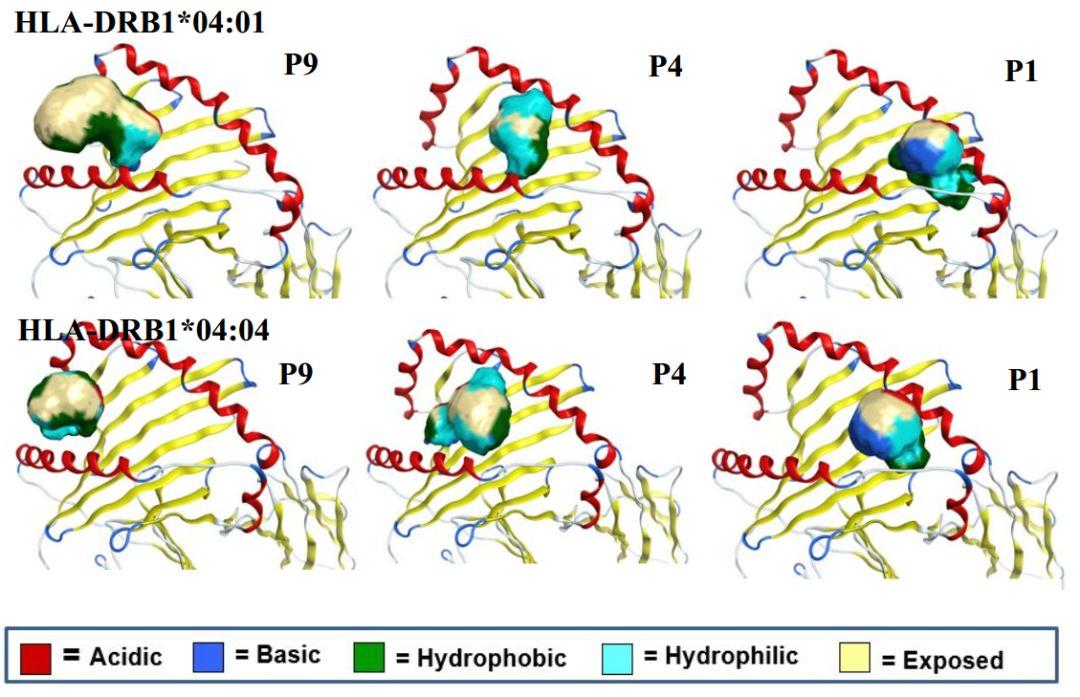
图2. 口袋体积分析以确定适合HLA-DR4:01和HLA-DR4:04的小分子结合口袋。
为了验证由vMAP23识别的口袋,使用Glide-SP完成了七次小型无限制对接。将一组11K化合物(完全随机)对接到每个口袋中。对接结果显示,将化合物对接至HLA-DR4:01和HLA-DR4:04中的P1和P9任一结合位置,化合物获得对接打分都很低,很少一部分化合物被定义Hits。另外,将P4-P9的口袋合并用于HTVS,获得对接结果和P1或P9单独对接结果类似。然而,P1-P4的组合口袋用于HTVS,HLA-DR4:01和HLA-DR4:04都能产生许多具有合理打分的Hits。因此,最终选择P1-P4组合口袋作为HLA-DR4:01和HLA-DR4:04的抑制剂结合位点。
HTVS鉴定出与HTS类似的理想化合物
研究者应用Glide-SP对接方法,以HLA-DR4:01和HLA-DR4:04为受体,虚拟筛选了Janssen数据库中的1,033,001个化合物。保留与HLA-DR4:01对接后GlideScore < -8.5的化合物(12,919),与HLA-DR4:04对接后GlideScore < -8.25的化合物(6,722)。将保留的化合物合并,且消除重复的化合物,应用各种过滤器,例如HTS过滤器对化合物进行过滤。然后使用Pipeline Pilot专有聚类方法对得到的12,972个分子进行聚类分析,获得7,260种化合物的聚类库,并进行HTS初级评估。在这些化合物中,63%(4,587 Hits)已经是HTS筛选库的一部分,计划与HTVS一起进行筛选; 因此,如果仅使用HTS作为鉴定方法,则会缺失2,673种其他化合物。
在HTVS优先考虑的7,260种重要化合物中,以50%抑制实验确认了199种活性物,最终的命中率为2.7%。相比之下,在HTS筛选中的632,000种化合物中,确认了1,529 Hits,命中率为0.2%。研究者指定了502种化合物(其中11种由HTVS鉴定),以便根据IC50值和化学结构进一步分析,以确保易处理性。完成502种化合物的聚类分析以确认该组的多样性。使用专有聚类方法,0.5相似性水平有145个聚类,每个聚类中位数为2个化合物。25.5%的簇是单化合物,23.4%的簇包含4到69种化合物。
最终研究者确定了5个系列的先导化合物。这5 各化合物中有3个由HTVS和HTS共同定义,有2个单独由HTS定义。从HTS和HTVS鉴定的原始命中的HTRF IC50值分别为3.31μM、4.72μM和5.78μM,仅HTS鉴定的化合物的HTRF IC50值分别为1.50μM和6.06μM。虽然HTVS在502种指定化合物中只占了11个化合物,但是却有3个化合物(27%)被用作先导优化的化合物,这说明虚拟筛选可以鉴定具有多种化学结构的富集化合物列表,适合作为潜在的候选药物。将化合物进一步优化至纳摩尔细胞效力并基于对接模型,假设结合在P1-P4子袋中,如图3所示。预计该系列化合物将占据P1子袋,类似于肽抗原并跨越P4子袋。
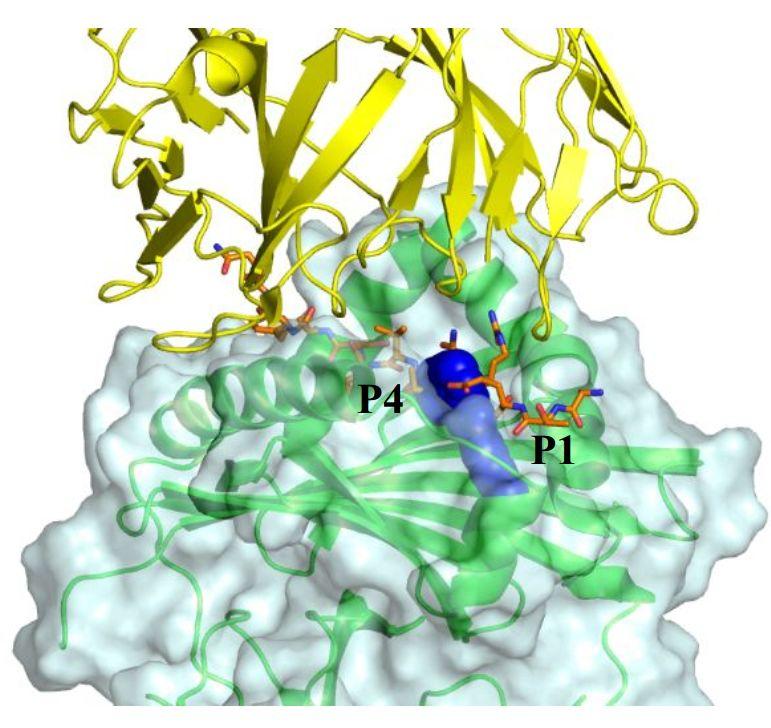
图3. 应用代表化合物(深蓝色)预测得到的结合模式。HLA-DR显示为绿色,与橙色的肽结合(PDB ID:4MD4)。TCR位于结合裂缝的顶部(黄色; PDB ID:1J8H)。
高效的虚拟筛选
在这个案例中,约100万个化合物被用于HTVS,经过仔细的筛查,一个由7,260种化合物组成的子库被认为具有适当的大小和化学功能,可以通过实验进行测试。与此同时,632,000种随机、多样化合物在HTS中进行了实验测试。两种方法都确定了先导化合物,但是应用HTVS获得的具有多种化学结构的子库进行实验测试,可以大大提高活性化合物发现的成功率。
文章来源:
Kelly L. Damm-Ganamet, Nidhi Arora, Stephane Becart, et. “Accelerating Lead Identification by High Throughput Virtual Screening: Prospective Case Studies from the Pharmaceutical Industry” Journal of Chemical Information and Modeling (2019).