前言
粘蛋白型(GalNAc型)O-糖基化(以下简称O-GalNAc糖基化)是具有重要生物学功能的翻译后修饰类型 [1-3]。近年来,许多研究表明蛋白质特异性位点的O-GalNAc糖基化与肿瘤、神经退行性疾病等多种严重威胁人类健康的疾病密切相关, 如冠状动脉疾病,阿尔茨海默氏病 [4-5]。ppGalNAc-T酶是O-GalNAc糖基化修饰的起始糖基转移酶,在人体中,ppGalNAc-Ts家族由20种同工酶组成,根据其相似性分为Ia,Ib,Ic,Id,Ie,If,Ig,IIa和IIb七个亚家族。ppGalNAc-T酶通过对底物位点的选择性催化,精密调控蛋白的O-GalNAc糖基化。已有研究报道,ppGalNAc-T酶催化结构域的catalytic loop在整个催化反应中至关重要。O-GalNAc糖基化的第一步是由一大类称为多肽N-乙酰半乳糖胺基转移酶(ppGalNAc-Ts)的酶完成的,该酶将GalNAc组从UDP-GalNAc转移到蛋白质的丝氨酸或苏氨酸残基,得到产物TN(GalNAcα1-O-丝氨酸/苏氨酸)和抗原释放出游离UDP。
对于ppGalNAc-Ts体系,前人通过600ns的分子模拟来研究catalytic loop的构象转变。他们的结果表明,loop的闭合是与UDP-GalNAc结合引起。但研究未能揭示loop打开/闭合的完整动态过程,这个过程可能发生在数十微秒甚至更长的时间尺度内。
本项研究中,研究人员采用了长时间的分子模拟(约20μs),来研究模拟过程中UDP-GalNAc结合后T2中完整的catalytic loop打开/闭合的过程,模拟的结果捕捉到3个关键的构象变化中间态。另外,本研究发现,活性位点附近的若干氨基酸残基对调控catalytic loop的动力学过程起到关键作用,进而影响后续的底物识别。更进一步,结合计算的结果,研究人员对若干氨基酸位点进行了突变实验,并测定了它们的酶动力学、亲和力参数及糖基化位点。本研究揭示了catalytic loop在底物识别和糖基化位点选择性上的关键作用。
如何在分子模拟中构造马尔科夫模型(MSM)
最近2年,在分子模拟领域,对于感兴趣的构象变化的问题处理,研究,通过大量短时间MD模拟,构造马尔科夫状态模型(MSM)的方式被证明是行之有效的方法 [6] 。
构建MSM模型,一般要选择n个状态,使得它们涵盖了整个动力学行为,并且滞后时间τ足够长以成为马尔科夫模型,但又短得足以解决系统动力学问题。如果能够成功做到这一点,则MSM仅从其过渡矩阵提供有关系统的有价值的信息, 如下图所示,a图表示的是八段不同的短时间的模拟轨迹,每一段模拟中可以选取不同帧的由一个模拟时间步分开。B图表示将轨迹分解为若干离散状态,其中已识别出四个状态(绿色,蓝色,紫色和粉红色)。C图表示的是观察到的转换计数矩阵,d图是可逆转换概率矩阵,,通过对观察到的转换计数矩阵及其转置进行平均得到,以确保每个正向转换都可以发生相同次数的向后转换。每行的概率总计为1。e图是总体概率分布的饼图,这是概率矩阵的第一个特征向量。占比比较高的状态在热力学上也更趋于稳定。F图是轨迹数据集主要特征过程的示意图。绿色状态的特征通量为负,而所有其他状态的特征通量为正,因此此过程表示从绿色状态向其他状态的运动。总体总和为1,每个过程的特征通量总和为0。此过程的时标是五个轨迹时间步长。
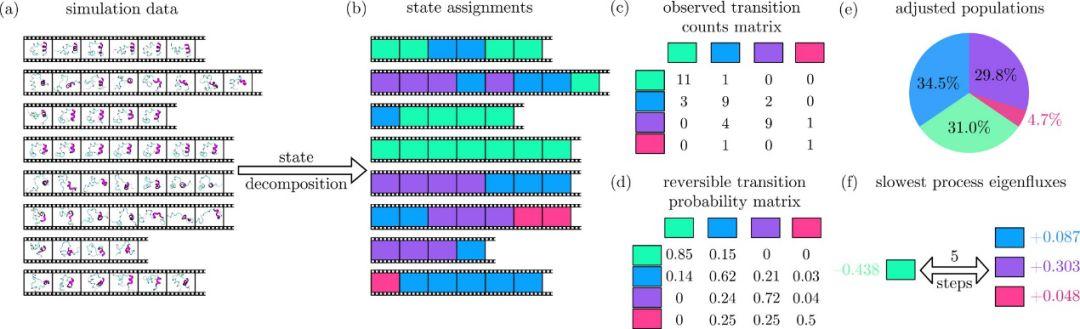
图1:马尔科夫模型构建的方法
图片来源自J. Am. Chem. Soc
本文构造马尔科夫模型的过程
研究人员通过tICA降维和聚类分析,将199条时长 100-ns MD模拟的所有构象聚类为不同数量的微状态。然后,为了研究catalytic loop闭合过程中动力学的详细机制,进一步使用PCCA +算法将一个500状态的动力学模型归纳为5个宏观状态,随后使用不同的仿真数据集进行MSM的收敛性测试。
结果
catalytic loop打开→闭合过程中关键亚稳状态的发现
通过构建MSM模型,研究人员发现在闭合过程中识别出catalytic loop的五个亚稳态,即S1-S5(图2 A,B)。S1和S5状态分别对应于完全打开和完全关闭的状态,其他三个状态是loop闭合期间的关键中间状态。进一步分析过渡路径,揭示了两个主要的构象转变途径:S1→S2→S3→S4→S5和S1→S2→S3→S5(图2 C)。S1的结构特征类似于最初的开环构象,和主链的I253残基形成一个稳定的氢键(占71.3%)(图2 d,3 A,B,E,F)。从S1开始,catalytic loop首先过渡到S2状态,其中Y367失去与I253,W282和F361的相互作用,catalytic loop的结构朝向UDP-GalNAc的构象。然后S2可以进一步过渡到S3,在此期间catalytic loop到达接近封闭构象的区域,并且H365,Y367和F369的侧链可以与V330,W331,F377,L204,H145和UDP-GalNAc的尿嘧啶形成疏水作用(见图2 D,3 E)。
最终,从S3状态,catalytic loop可以直接转变到闭合的状态S5,或者经过另一个中间状态S4, 到达S5状态(见图2 C)。S5是完全闭合状态,其中H365,Y367,F369,F377,H145,L204,V330,W331和UDP-GalNAc的尿嘧啶基团可以形成稳定的疏水区域(见图2 D,3 E ,F)。这些相互作用网络有助于将catalytic loop稳定在封闭状态。
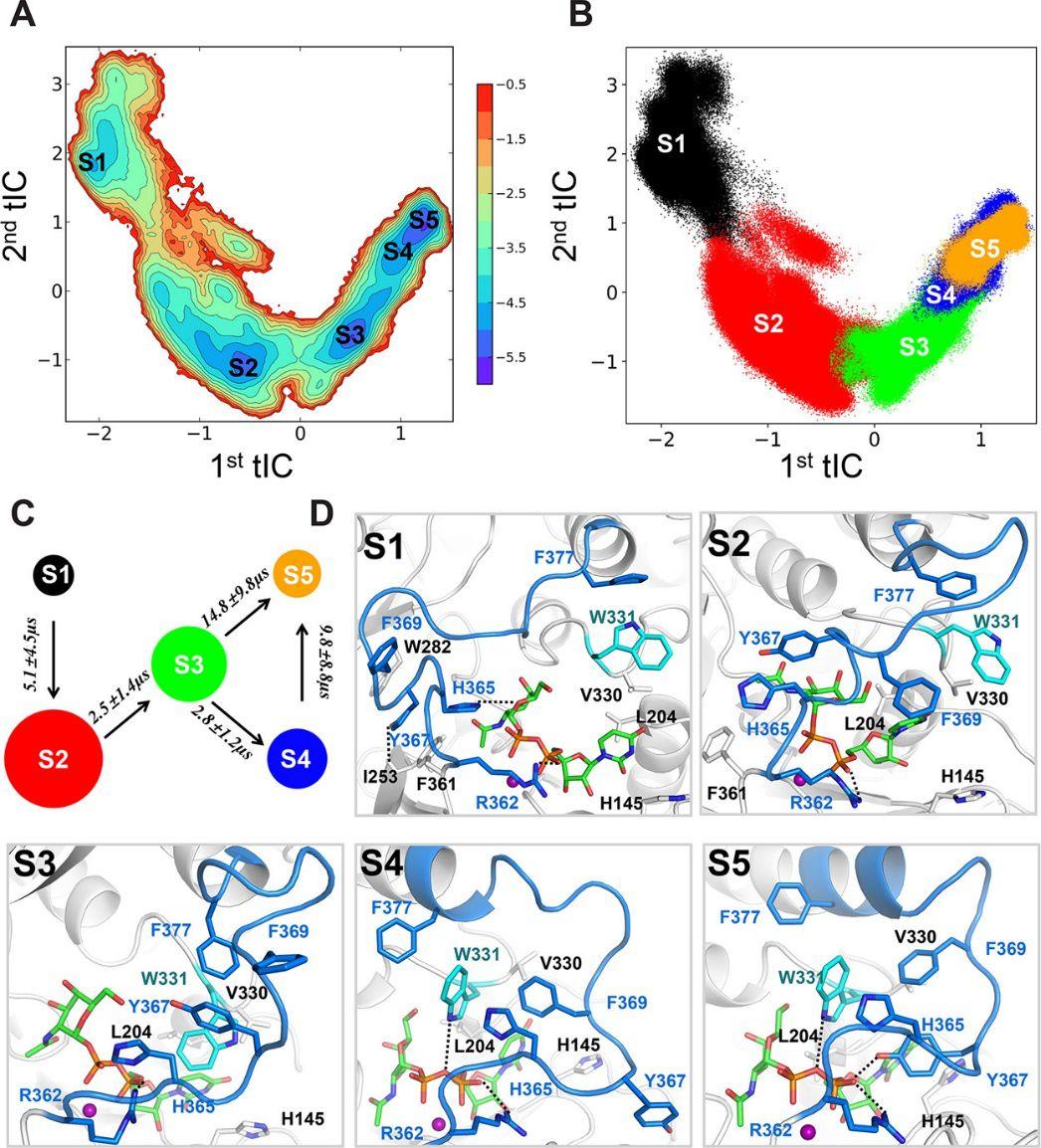
图 2:MSM模型确定了catalytic loop在闭合过程中存在5个亚稳态。(A)在前两个最慢tIC维度上,模拟中构象的自由能投影。(B)两个最慢的tIC上,模拟中构象的散点分布图。S1到S5分别用黑色,红色,绿色,蓝色和橙色表示。(C)源自MSM的五态动力学模型,每个圆圈代表一个亚稳态(D)每个宏观状态下具有代表性的构象展示
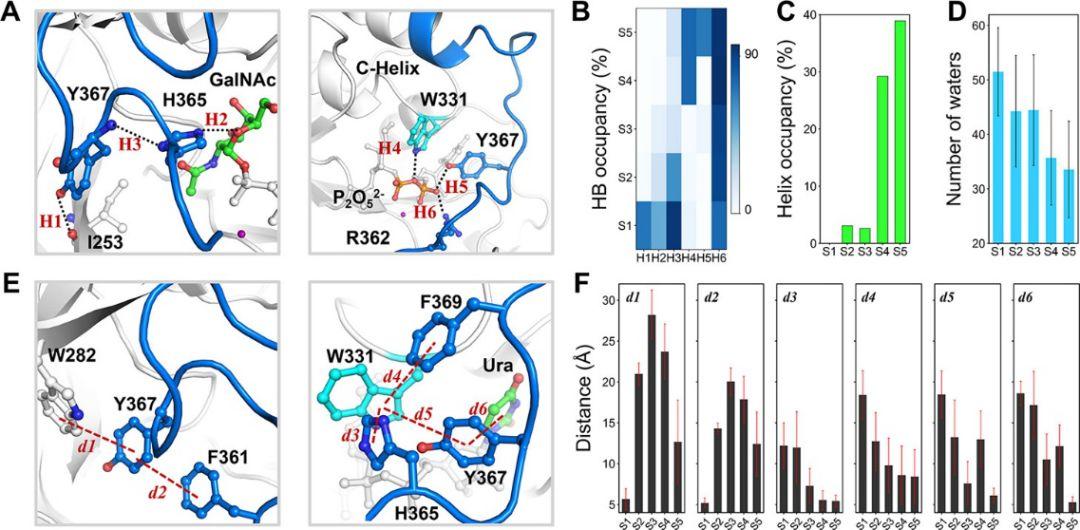
图 3: catalytic loop 闭合过程中关键的结构变化。(A)六个关键氢键在模拟过程中所占有的概率(B)每个亚稳态的HB占据H1,H2,H3,H4,H5和H6。(C)在每种状态下,催化环C末端区域螺旋占有的概率(D)距UDP–GalNAc小于3Å的距离内的水分子数量。(E)距离计算时几个残基对的定义(F)在每个亚稳态下d1,d2,d3,d4,d5和d6的测量距离。
图片来源自ACS catalysis
为了更好地观察监控整个loop闭合的过程,研究人员将所有MD的构型投影到第一个tIC以及回转半径(Rg)上。如图4 A 所示,在loop闭合期间,Rg的平均值从S1状态时的~10 Å减小到S5状态时的~7 Å。具体地,在S1中,W331,H365,Y367和F369的位置比较分散,形成了相对较高的R g值(见图3 E,F和4),等到了S5状态,完全闭合的构象S5显示出所有五个状态中均显示出最低的R g值(请参见图4)。
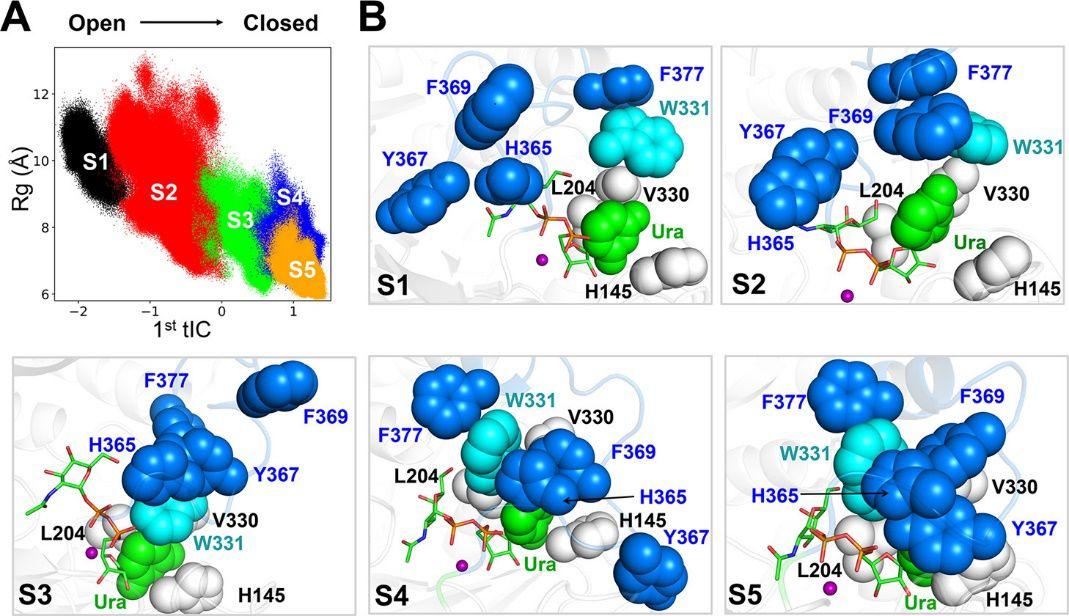
图4. S2是catalytic loop关闭动力学的关键中间状态。(A)散点图,每个MD构象都映射到第一个tIC上,H145,L204,V330,W331,H365,Y367,F369,F377和UDP的尿嘧啶部分(Ura)的回转半径(Rg) (B)每个状态(S1-S5)的代表性结构展示。
图片来源自ACS catalysis
UDP-GalNAc结合绑定促进了Catalytic-Loop的关闭
有趣的是,本项研究发现占比最高的状态不是闭合的状态S5, 而是中间态S2。分析表明,S2中catalytic loop的构象非常不均一,既包含开放的构象(有较高的R g值),也包含封闭的构象(较低的R g值,见图4 A)。而在到达S3之后,catalytic loop渐渐趋向闭合的状态,综合以上结果,研究人员推测S2是催化环闭合动力学的关键中间状态,在这期间,UDP-GalNAc可能参与促进了catalytic loop从开放形式向封闭形式的构象转变。为了验证这个假设,研究人员对apo T2结构(不与UDP-GalNAc结合的构象)进行了额外的模拟,目的是为了研究UDP-GalNAc在闭合过程中的作用。结果表明,UDP-GalNAc的存在可以使catalytic loop稳定在起始构象,甚至可以促进loop的闭合。相反的,当没有UDP-GalNAc之后,大约一半模拟的构象趋向转变为开放状态。进一步的分析表明,与UDP-GalNAc直接接触的几个关键残基,包括L204,V330和W331,在去除UDP-GalNAc之后经历了较大的结构波动。
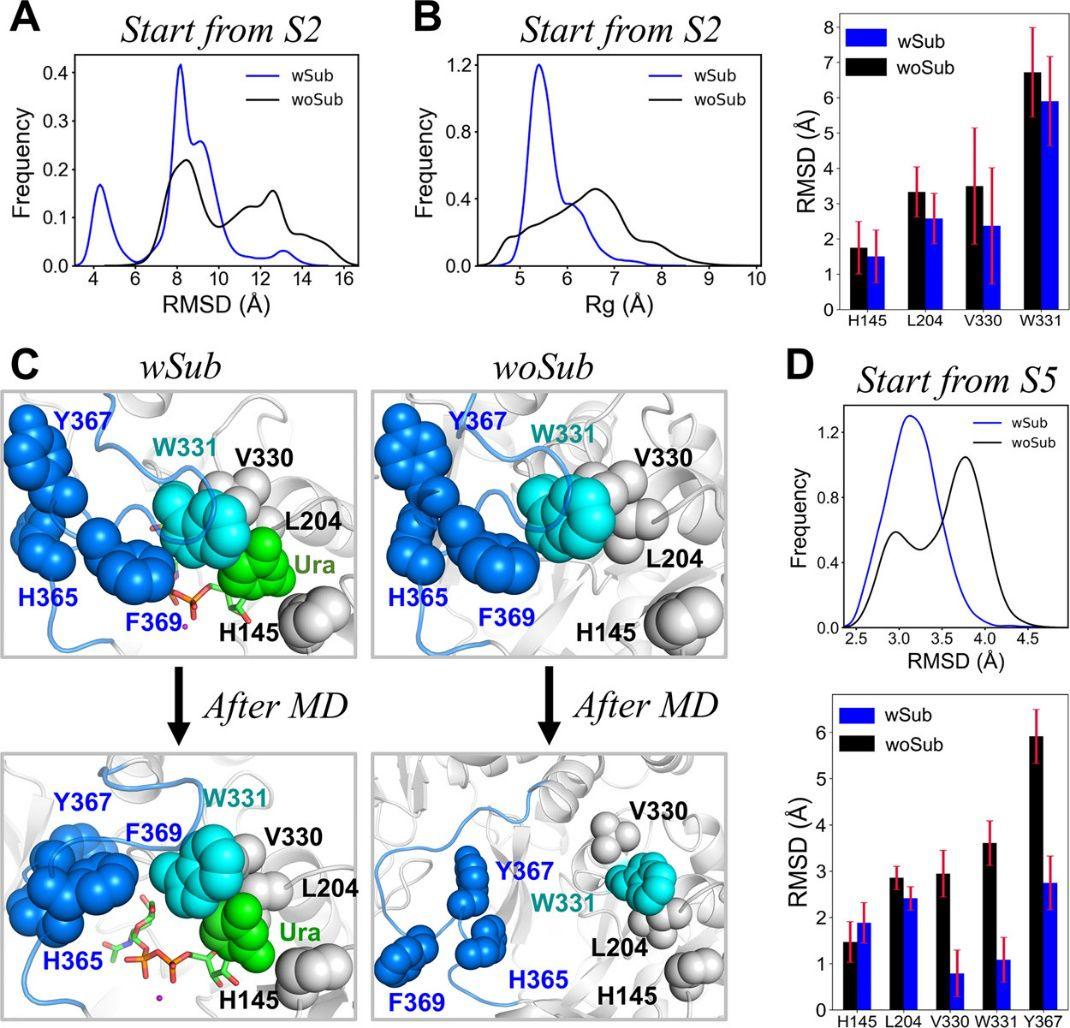
图5. UDP–GalNAc的存在促进了催化环的闭合。
图片来源自ACS catalysis
结语
本项研究中,研究人员通过广泛的计算模拟,揭示了在UDP-GalNAc结合后T2中catalytic loop的闭合/打开运动的完整动力学过程。构建的马尔科夫模型(MSM)可以识别催化环在其闭合运动过程中的五个关键中间状态,这在之后的识别底物和后续的催化反应中起到了关键的作用。
参考文献:
(1) Ju, T.; Otto, V. I.; Cummings, R. D. The Tn Antigen-Structural Simplicity and Biological Complexity. Angew. Chem., Int. Ed. 2011, 50,
1770-1791.
(2) Gill, D. J.; Tham, K. M.; Chia, J.; Wang, S. C.; Steentoft, C.; Clausen, H.; Bard-Chapeau, E. A.; Bard, F. A. Initiation of GalNAcType O-Glycosylation in the Endoplasmic Reticulum Promotes Cancer Cell Invasiveness. Proc. Natl. Acad. Sci. U.S.A. 2013, 110, E3152-E3161
(3) Gill, D. J.; Clausen, H.; Bard, F. Location, Location, Location: New Insights into O-GalNAc Protein Glycosylation. Trends Cell Biol. 2011, 21, 149-158
(4) Liu, F.; Xu, K.; Xu, Z.; de Las Rivas, M.; Wang, C.; Li, X.; Lu, J.; Zhou, Y.; Delso, I.; Merino, P.; Hurtado-Guerrero, R.; Zhang, Y.; Wu, F. The Small Molecule Luteolin Inhibits N-Acetyl-alpha-Galactosaminyltransferases and Reduces Mucin-Type O-Glycosylation of Amyloid Precursor Protein. J. Biol. Chem. 2017, 292, 21304-21319
(5) Halim, A.; Brinkmalm, G.; Ruetschi, U.; Westman-Brinkmalm, A.; Portelius, E.; Zetterberg, H.; Blennow, K.; Larson, G.; Nilsson, J. Site-Specific Characterization of Threonine, Serine, and Tyrosine Glycosylations of Amyloid Precursor Protein/Amyloid Beta-Peptides in Human Cerebrospinal Fluid. Proc. Natl. Acad. Sci. U.S.A. 2011, 108, 11848-11853.
(6) Husic, B. E.; Pande, V. S. Markov State Models: From an Art to a Science. J. Am. Chem. Soc. 2018, 140, 2386-2396.