

目前,治疗耐药菌感染患者的药物种类十分有限,急需开发抗菌肽(AMPs)。本文汇总现有技术下对AMPs的结构、动力学和功能开展的研究,有利于与实验研究形成互补。
背景介绍
抗生素本身是治疗感染疾病的有效方法,然而抗生素的滥用使致病菌抗药能力得到“锻炼”,因此治疗效果大打折扣。此时,AMPs应运而生。作为一种抗菌肽,AMPs主要特性是两亲性和阳离子性,该特性有利于其通过各种可能的方式破坏细菌的阴离子细胞膜(图1),而不影响两性离子宿主细胞膜。此外,AMPs的作用机制似乎是由其二级和三级结构决定的,这些结构可以是α-螺旋,β-折叠或loop(图2)。尽管AMPs十分重要,但是现如今对于AMPs相关实验研究难度较大,需辅以计算模拟数据。本文通过收集与AMPs相关的计算研究来为AMPs研究人员提供有用的指南,其中包括:利用模式识别和机器学习预测新型AMPs的特征和结构以及采用分子模拟方法解释AMPs与细菌膜的相互作用机制。
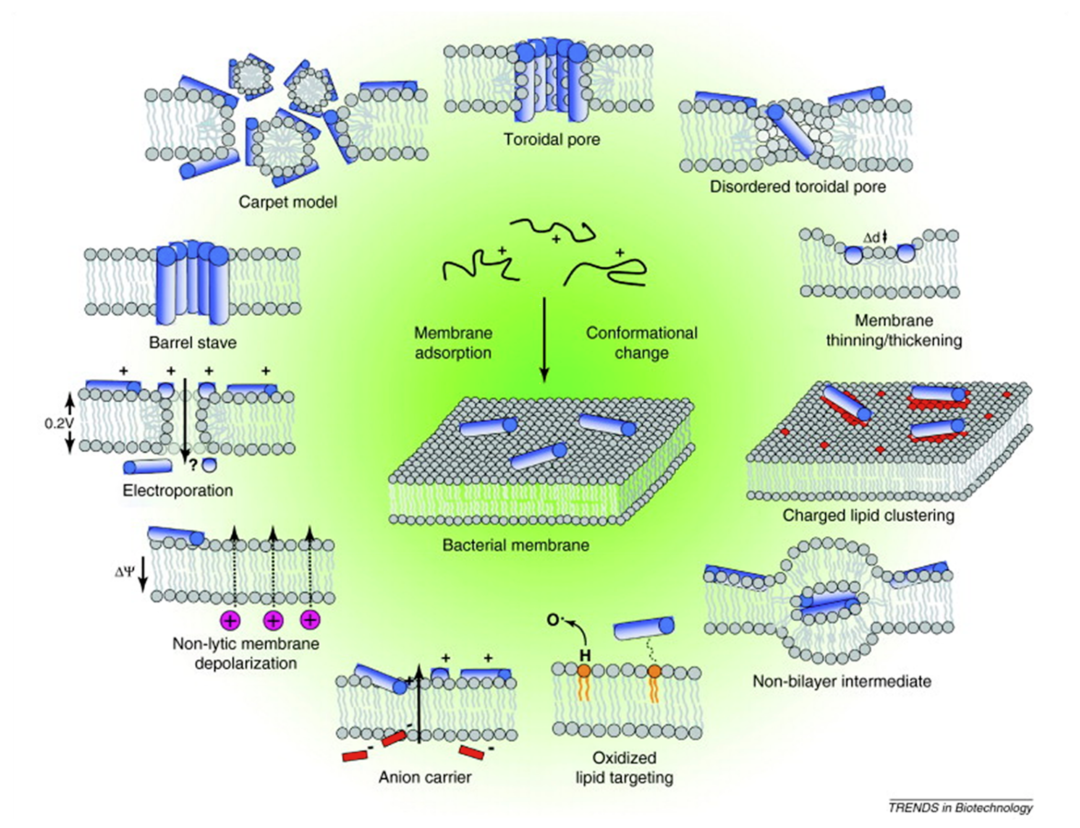
图1. AMPs作用机制示意图。图片来源于:JCIM
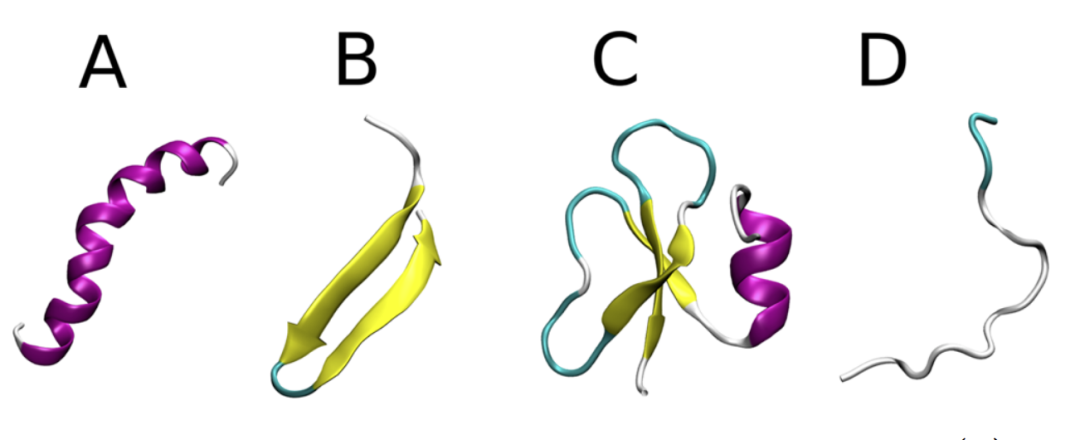
图2. 常见的AMPs结构。图片来源于:JCIM
AMPs结构和活性的预测方法
现有对于识别新型AMP的前瞻性研究中有许多工具可供使用。其中有几个可以收集和分类已知序列的数据库可供访问,例如CAMPR3、APD、YADAMP等。有些数据库还带有经过验证的预测工具。这些预测工具能够在数千个已知的抗菌肽上进行训练,以推断序列与特性之间的关系和相关性,从而获得假定序列具有抗菌活性的可能性;不仅如此还可以尝试预测特定假定AMP的作用机制。现有的分析预测工具有CAMPR、AMPScanner、ADAM等(表1),其中在多个数据集中表现最好的是amPEPpy和AMPfun,在最新发现的10个AMPs中正确率最高的则是IAMPE。
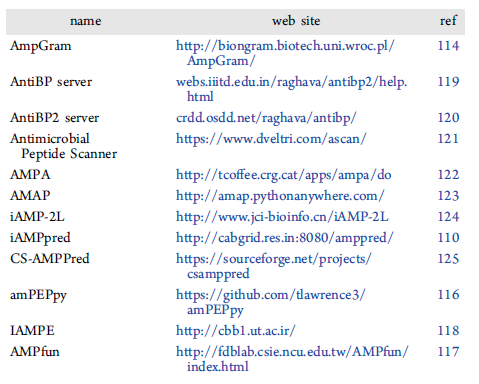
表1. AMP活性分析预测工具。表格来源于:JCIM
为了更具针对性的查找和预测,大量的机器学习方法应用于此。机器学习(ML)利用统计数据来发现和学习大量数据中的模式,从而推断氨基酸组成和具有抗菌活性的多肽的理化性质之间的经验关系。研究人员利用ML算法对AMP的氨基酸序列用相关的物理化学特性进行标注,其中包括AMP的肽长度、分子量、氨基酸组成、电荷、亲脂性和净电荷,以这些特性为训练算法的特征向量。然后,根据训练数据可用性进一步调整预测模型以达到了解AMP氨基酸序列与活性之间关系的目的,设计具有增强抗菌疗效的AMP(图3)。从现有的机器学习算法中汲取灵感,开发了基于KNN算法的iAMP-2L模型可以预测AMP不同作用模式和目标的例子;基于ANN算法的iAMPpred模型可以计算与给定肽序列相关的抗菌、抗病毒和抗真菌的概率;基于SVM算法的CS-AMPPred125模型可以基于二级结构和序列特性的五个描述符预测抗菌活性;还有两层RF分类器,准确率大约在87%。第一层预测一个肽是否是AMP,第二层预测其作用模式和靶生物。神经网络最近也在AMP预测领域得到了应用。深度神经网络(DNN)与长短期记忆网络(LSTM)相结合生成具有AMP特性的新序列,并且预测精度优于随机生成的多肽。
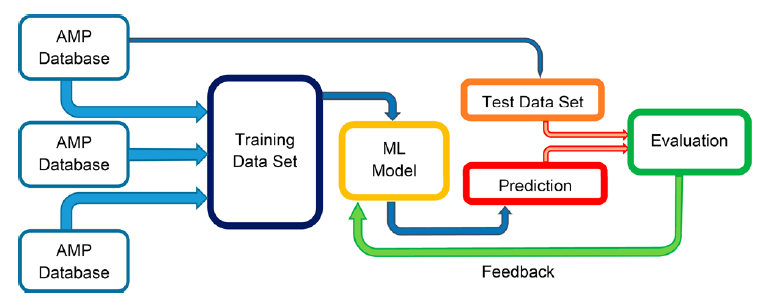
图3. 应用机器学习预测AMP的流程图。图片来源于:JCIM
一旦确定了一个具有潜在AMP活性的新序列,利用表2所示方法对其二级和三级结构的预测可以进一步提高了解其抗菌能力的准确性。聚集也是一些AMP的重要性质,使用如表3所示的方法也可以进行预测。

表2. AMP二级结构预测工具列表。表格来源于:JCIM
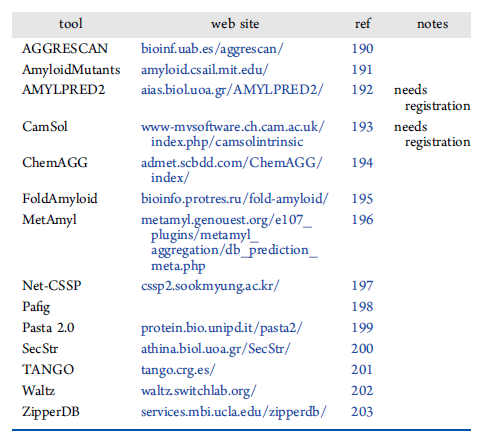
表3. AMP聚合预测工具列表。表格来源于:JCIM
AMPs的结构、作用机制和特性的模拟方法
分子动力学模拟用于研究AMP在不同环境下结构动力学的时间演化,这有助于我们了解AMP在膜中的结构取向变化、AMP插入和破坏细菌膜以及AMP聚集成孔的情况。
MD模拟表明带正电荷的AMP的α-螺旋通过静电和疏水相互作用稳定结合在带负电荷的细菌膜上,这使得AMP插入细菌膜。随着温度升高,AMP插入细菌膜的速度变快,并且折叠成已知的螺旋结构。粗粒化模拟表明AMP能在磷脂双层膜上聚集,平均大小为14个单体每簇,其中AMP自组装形式如图4所示。AMP聚集后形成孔结构从而破坏细菌膜的双分子层。值得注意的是,对于AMP聚集的研究往往需要多种类型的模拟来充分取样,从而准确分析AMP聚集成孔并破坏膜的机制。目前研究AMP聚集的常用模型为Melittin和Magainin 2。
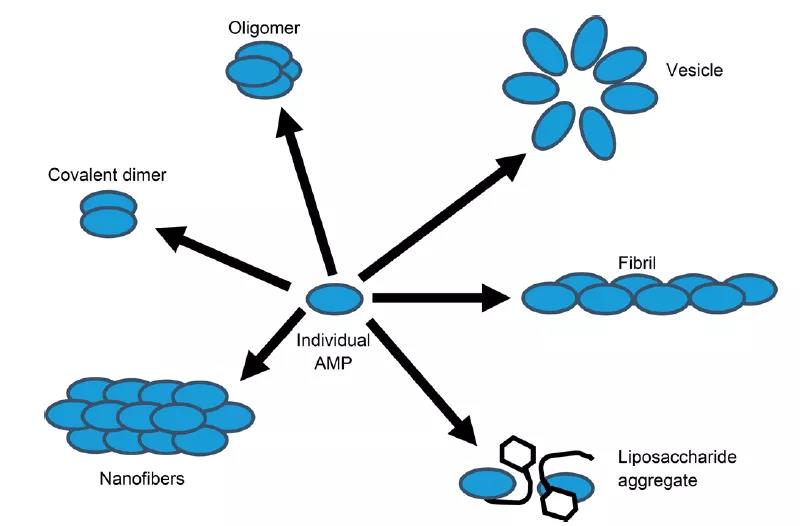
图4. AMP自组装的示意图。图片来源于:JCIM
一些研究利用了双分子层的自组装方法观察AMP嵌入双分子层的组装,包括脂质、AMP、和水分子,从而发现AMP孔隙结构穿透细菌膜不需要克服能量障碍。除了细菌的细胞质膜外,还通过改变脂质比率以代表不同生物体的膜(表4)与AMP的作用,其中AMP可形成四聚体优先与阴离子脂POPC相互作用,并且膜表面会显著变形。总而言之,计算模型和模拟对于帮助我们理解AMP是如何在细菌细胞膜中插入、破坏和/或形成孔的非常重要。
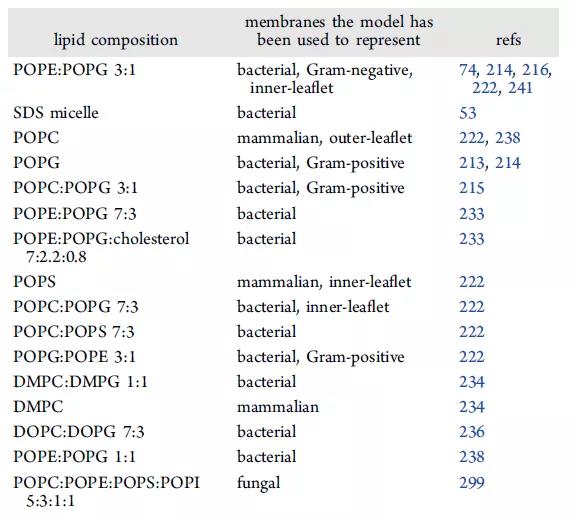
表4. 脂质成分及其代表的膜。表格来源于:JCIM
参考文献
Pietro G A Aronica, et al. Computational Methods and Tools in Antimicrobial Peptide Research. J. Chem. Inf. Model. 2021, 61, 7, 3172-3196. DOI: 10.1021/acs.jcim.1c00175.