引言
新型冠状病毒(SARS-CoV-2)已在全球范围内爆发,该流行病迅速传播到212个国家,并被世卫组织宣布为全球卫生紧急情况。目前还没有临床有效的疫苗或特定的抗病毒药物可用于预防和治疗COVID-19感染。因此,迫切需要高效、安全的特异性抗SARS-CoV-2药物。

基于Mpro结构的药物设计
SARS-CoV-2的主要蛋白酶(Mpro)是介导病毒复制和转录的关键酶。Mpro的活性位点在所有冠状病毒的Mpros中高度保守,通常由四个位点(S1’、S1、S2和S4)组成。通过分析SARS-CoV Mpro(PDB ID:2H2Z)的底物结合口袋,中国科学院上海药物研究所柳红/蒋华良团队联合上海科技大学杨海涛/饶子和团队和中国科学院武汉病毒所张磊砢/肖庚富团队共同合作,设计并合成了两个针对SARS-CoV-2 Mpro的新型抑制剂—拟肽类化合物11a和11b,两者均表现出优异的抑制活性和较强的抗SARS-CoV-2感染活性。
活性测试
活性实验研究表明,当药物浓度为1µM时,11a和11b的抑制率分别为100%和96%。使用基于荧光共振能量转移(FRET)试验来测定IC50值。结果表明,11a和11b的IC50分别为0.053±0.005µM和0.040±0.002µM。
复合物晶体结构揭示结合模式
化合物11a和11b与SARS-CoV-2主蛋白酶复合物的晶体结构揭示了两个化合物与Mpro的相互作用模式。11a醛基的C和SARS-CoV-2MPRO的催化位点Cys145形成了标准的1.8-Å C-S共价键。醛基的氧原子还通过与S1‘位点上残基Cys145的主干形成2.9-Å氢键,在稳定抑制剂的构象方面起着关键作用。11a的P1处 (S)-γ-内酰胺环与S1位点吻合良好。(S)-γ-内酰胺基团的氧与His163的侧链形成2.7-Å氢键。Phe140的主链和Glu166的侧链也参与稳定(S)-γ-内酰胺环,分别与其NH基团形成3.2和3.0-Å氢键。此外,11a链上的酰胺键分别与His164(3.2-Å)和Glu166(2.8-Å)主链形成氢键。P2位11a的环己基部分深入插入S2位,与His41的咪唑环堆积在一起。环己基还被Met49、Tyr54、Met165、Asp187和Arg188的侧链包围,产生广泛的疏水相互作用。11b与11a显示出类似的抑制剂结合模式。表明这两个化合物具有相似的抑制机制,即两种化合物均占据底物结合口袋,阻断SARS-CoV-2 Mpro的酶活性。
成药性评估
此外,该团队还对化合物11a和11b进行了药代动力学特性评价以及体内毒性研究实验,结果表明这两个化合物均展示出良好的体内药代动力学性质和安全性,有望开发成为抗SARS-CoV-2的新型抑制剂。
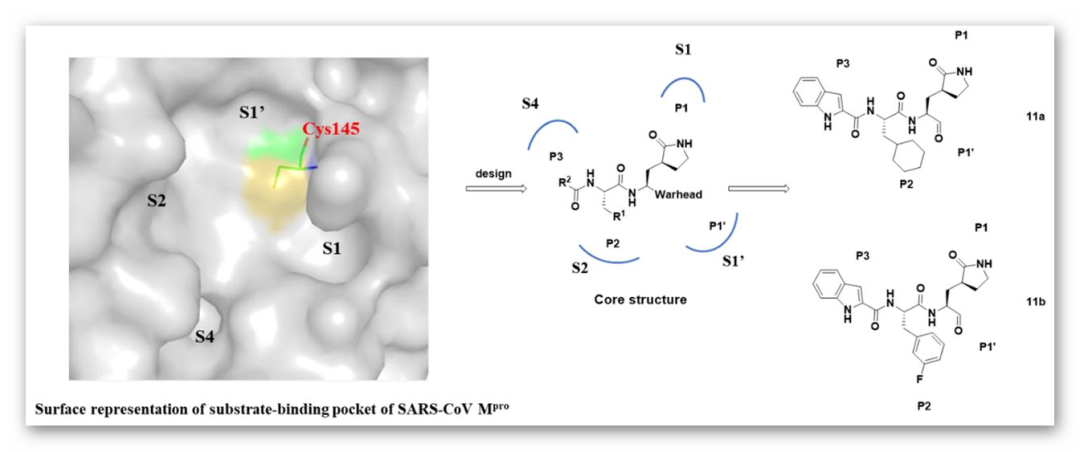
图1. 新型SARS-CoV-2主要蛋白酶抑制剂的设计策略及11a和11b的化学结构
图片来源:Science
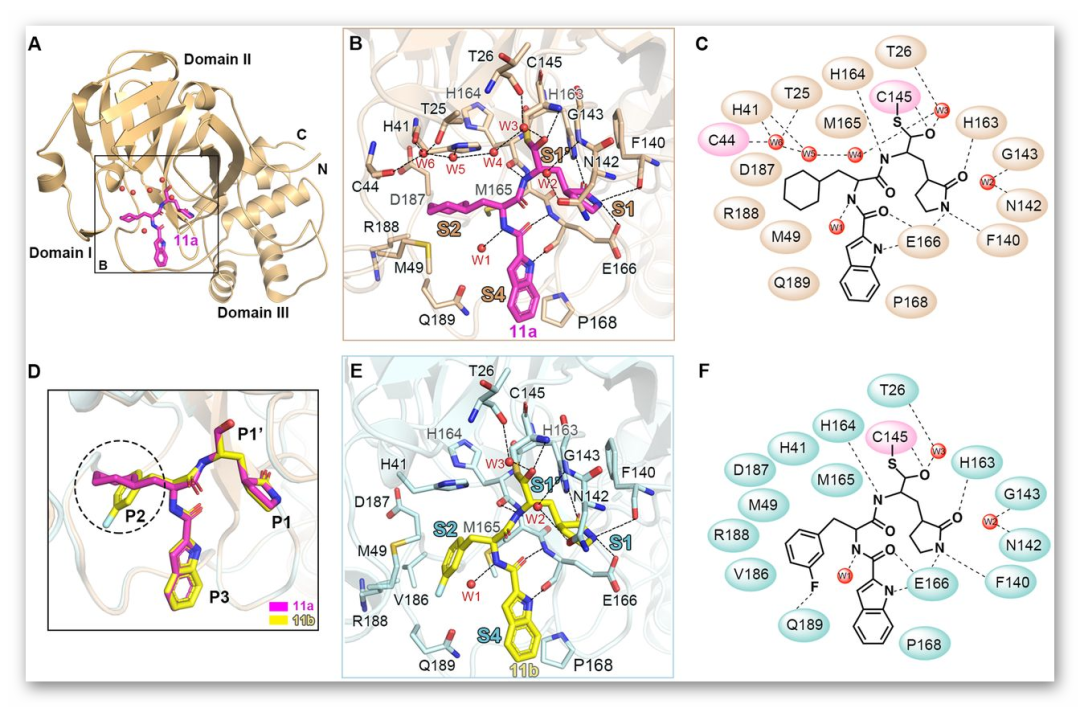
图2. Mpro蛋白酶与11a和11b的结合模式
图片来源:Science
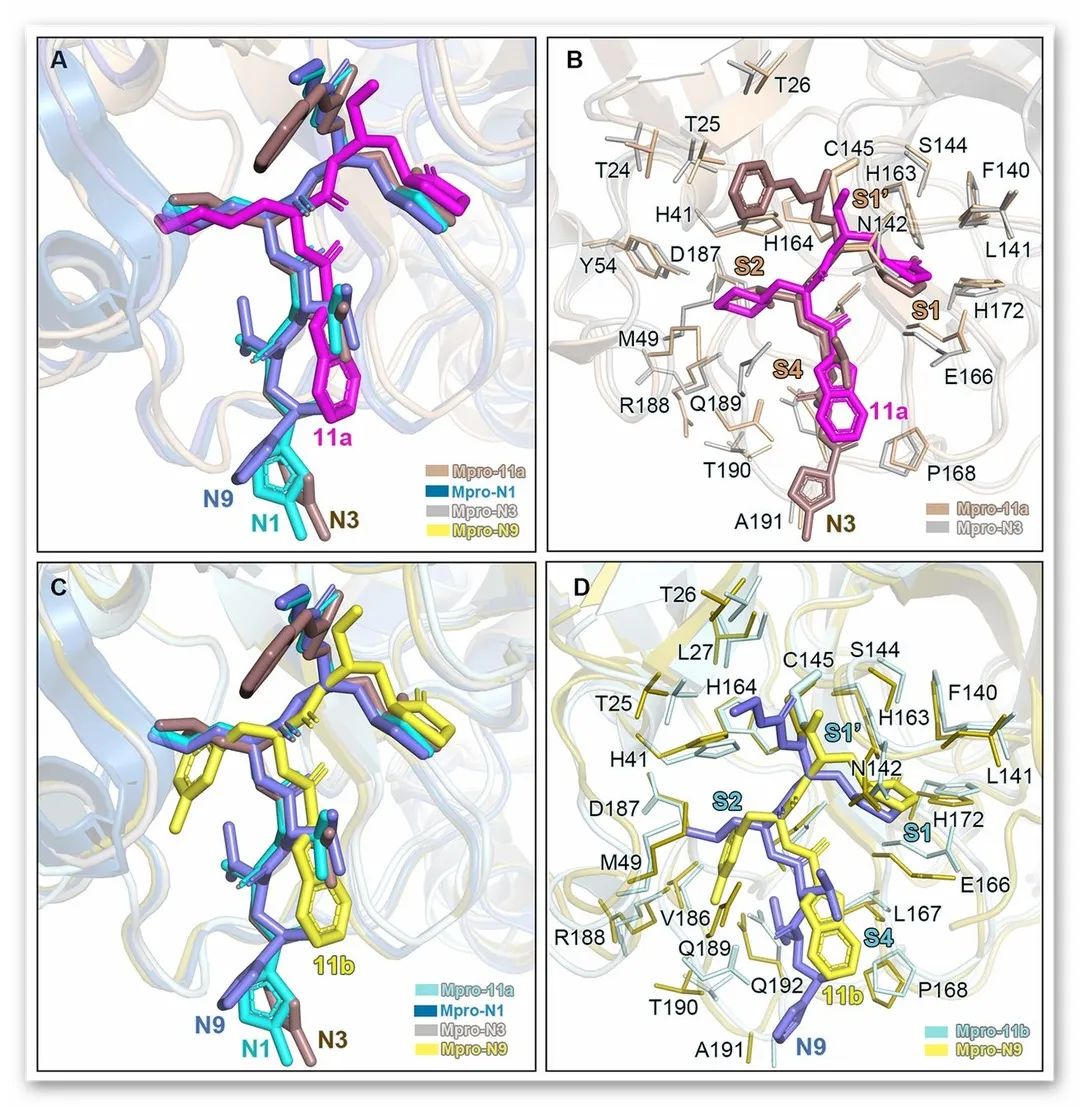
图3. SARS-CoV和SARS-CoV-2 Mpros中抑制剂结合模式的比较
图片来源:Science
参考文献
Dai W, Zhang B, Jiang X M, et al. Structure-Based Design, Synthesis and Biological Evaluation of Peptidomimetic Aldehydes as a Novel Series of Antiviral Drug Candidates Targeting the SARS-CoV-2 Main Protease[J]. bioRxiv, 2020. DOI:10.1101/2020.03.25.996348