蛋白质设计是一门时兴的交叉学科,蛋白质设计可以对已知结构的蛋白质分子性质与功能的改良,甚至发现新的功能;也包括从头设计全新蛋白,以期得到期望的蛋白三维结构与功能。众所周知,许多生物学功能的发挥依赖于蛋白所处的环境,甚至环境条件的变化可能驱动蛋白在不同状态之间切换,如pH-响应的蛋白构象变化。目前,对于pH-调控蛋白构象变化的分子设计受限于蛋白构象的pH响应很难被准确预测和调整,这对于蛋白质从头设计则是更大的挑战。
最近,David Baker课题组利用蛋白亚基界面间的组氨酸氢键网络,从头设计出了可调节的pH-响应低聚蛋白(pROs)。由于组氨酸残基在低pH值下质子化会破坏氢键网络,可导致亚基界面间出现空间和静电排斥。所设计的α-螺旋束的重复几何截面,允许以模块的方式添加或删除氢键网络,从而可以通过改变组氨酸氢键网络数量,调整蛋白响应的pH范围以及协同性。这是一个理论预测结合实验验证的工作,其蛋白分子设计的成功得益于Bakerl团队开发的Rosetta软件,该软件可以说是当前蛋白质结构预测中最著名的软件了。
如图1所示,首先,他们采用把组氨酸氢键网络埋入亚基界面间,并结合周围疏水作用包装起来的思想,利用Rosetta蛋白设计软件首先设计出了三个同三聚体(pRO-1,2,3)和两个异二聚体蛋白(pRO-4,5),随后在实验中进行了表达和测试。在pH为中性时,除pRO-1外,所有设计蛋白均组装为预期的低聚态。后续他们的实验分析测定基于pRO2-5进行,并选择了效果最好的pRO-2做进一步的分析改进。通过对比pRO-2和将其氢键网络替换为不含组氨酸的pRO-2-noHis发现,当pH降至酸性时,pRO-2会发生协同的、pH依赖的蛋白四级结构分解(低聚体蛋白解离为单体),而pRO-2-noHis中则无此现象。在pRO-3,4,5中也均具有pH依赖的低聚体解离现象。此外pRO-4中L23A/V130A突变可进一步增强pH敏感性。

图1 pROs的设计
图片来源:Science
模型根据亚基进行着色(绿色,青色和粉红色),红色框内表示包含组氨酸氢键网络的截面。(A)设计策略:组氨酸残基在低pH条件下质子化时会破坏分子间界面稳定性。(B)将所设计pRO-2中含组氨酸的氢键网络替换为pRO-2-noHis中不含组氨酸的氢键网络。(C)质谱结果显示 pRO-2中(上)当pH降至5.5以下时,会发生协同的、pH依赖的蛋白四级结构分解。pRO-2-noHis中(下)则无此现象。(D)CD MRE图显示pRO-2稳定性显著依赖于pH。(E)所设计含组氨酸的同三聚体模型pRO-3和异二聚体pRO-4、pRO-5。(F)对应模型的质谱结果。其中pRO-4的L23A/V130A突变可以削弱截面作用增强pH敏感性。
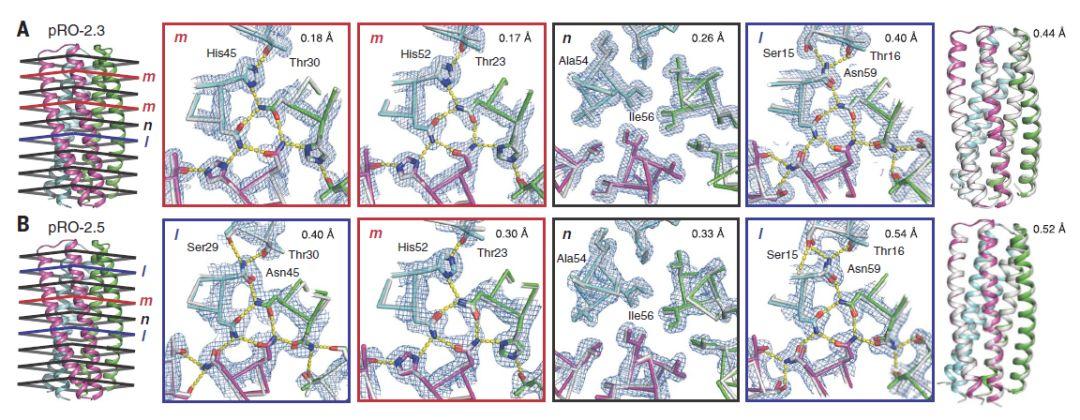
图2高分辨率x射线晶体结构与设计模型非常接近
图片来源:Science
左图,设计模型示意图;中图,所选结构与晶体结构的比较;右图,蛋白主链结构与晶体结构叠合。其中设计模型按照亚基着色,晶体结构显示为白色。
在此基础上,利用设计蛋白氢键网络模块化的特征,结合pRO-2和pRO-2-noHis的氢键网络,设计了在pH回升至7时可重新组装为低聚体并更利于结晶的pRO-2.3和pRO-2.5。获得pRO-2.3和pRO-2.5的晶体结果并将设计模型与晶体结构叠合,发现设计模型的整体结构及氢键网络均与晶体结构中十分一致(图2)。进一步结合组氨酸氢键网络层,非组氨酸氢键网络层及疏水性层三个相互作用层,尝试调节不同层类的数目并进行组合后发现,蛋白响应pH变化所发生的四级结构分解(低聚体解离)的转变点pH可以随相互作用层的不同组合发生变化。具体来说,当组氨酸氢键网络层与疏水性层的比值越高时,转变点pH值也随之升高。这使得设计蛋白的pH-依赖性构象变化可以根据不同相互作用层的组合进行精确的调控(图3)。也就是说,Baker他们所设计的这些蛋白可以利用pH来调控其自组装行为。
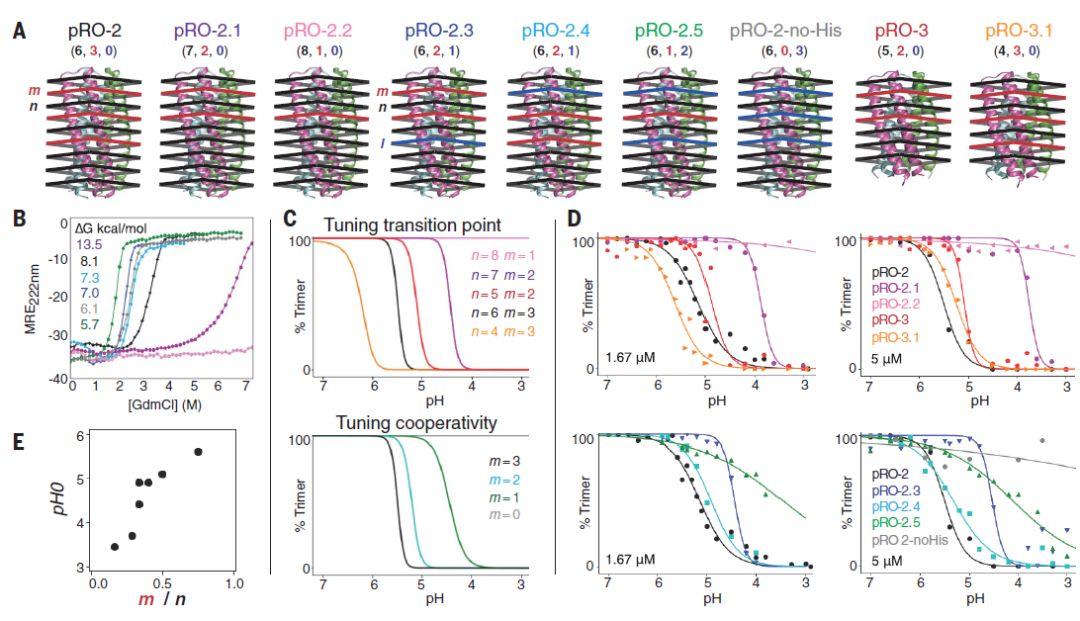
图3转变点pH及协同性的系统性调节
图片来源:Science
(A) 疏水性层(n,黑色)、组氨酸网状层(m,红色)、缺乏组氨酸极性网状层(l,蓝色)的不同组合模型示意图,数字为对应层的数目。(B) 对应模型的CD MRE图。(C) 理论模型:三聚体丰度与pH的关系。(D) pH诱导的四级结构分解质谱监测图。(E) m/n的比值越高时,转变点pH (pH0)也随之升高。
此外,实验还发现所设计蛋白具有脂质体渗透活性。由于所设计三聚体蛋白界面中包含若干疏水残基,这些残基可在pH诱导的亚基解离后暴露,生成的水脂两亲性螺旋结构能够破坏细胞膜。这使得设计蛋白无论在体外还是细胞内被内吞后,都能响应pH值发生构象变化破坏脂质膜,使他们成为可能的生物制剂传递系统设计方案(图4)(图5)。因此,文章设计的蛋白不仅实现了可调节的由pH驱动的构象开关变化,以及利用模块化相互作用调节蛋白设计模型性质的方法,还为生物制剂胞内递送提供了潜在的新思路。
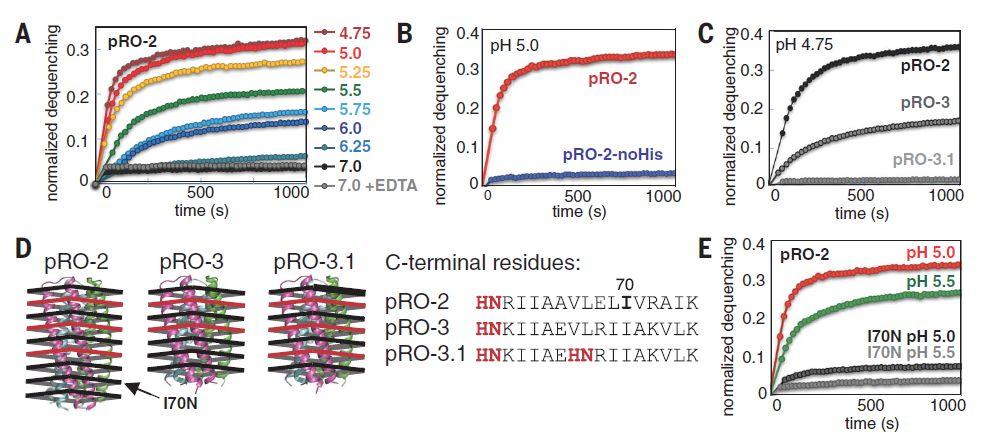
图4 pH-依赖的膜渗透作用
将蛋白添加到包裹了猝灭SRB荧光染料的合成脂质体中,通过从破裂的膜中渗出的染料来测量活性。
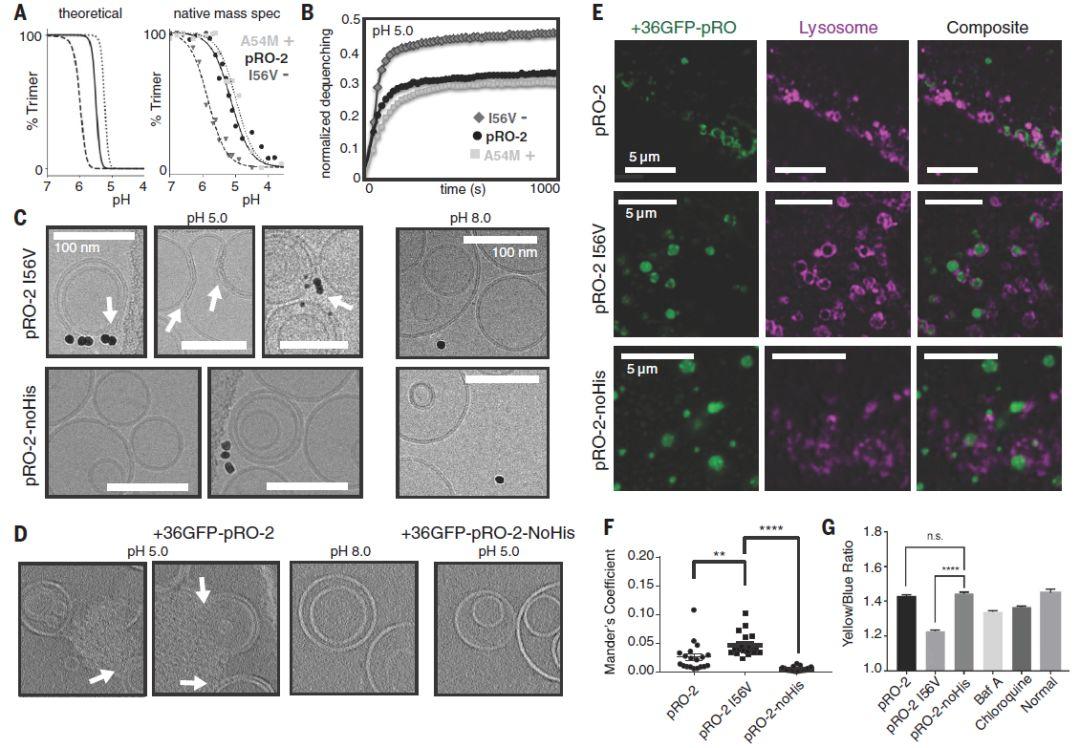
图5 pH-诱导膜渗透的影像
将蛋白添加到包裹了猝灭SRB荧光染料的合成脂质体中,通过从破裂的膜中渗出的染料来测量活性。
参考文献
Boyken, S. E.; Baker, D.* et al., Science 2019, 364, 658–664.