
引言
意大利佩鲁贾大学研究者概述了基于连续流系统、自动化和生物测定的创新药物化学策略的最新发展,并描述了加速药物化学发现周期的自动化流程系统和端到端原型的设备和代表性例子。
背景介绍
药物化学在化学生物学、药理学和药学研究中发挥着基础性和潜在性的作用,以此用于发现安全有效的药物。小分子药物化学依赖于由化合物设计、合成、测试和数据分析组成的迭代学习循环,为全新的和成药性靶点提供新的化学探针和先导化合物。然而,使用传统的方法,从初设到得到结果的时间可能会延长,从而限制了可以进入临床研究的化合物的数量。这一挑战可通过利用在改进药物发现过程中显示出巨大潜力的技术来解决,例如,连续流系统、自动化和生物测定等。在此,意大利学者在下文中对以上技术进行了概述。
药物化学演变和进化:
缺点和技术解决方案
药物化学是一门集化学生物学、药理学和医学于一体的交叉学科,在药物发现中发挥着重要作用。药物化学的主要目标有:(i)发现尚未研究的生物靶点的化学探针和先导化合物;(ii)证明靶点的成药性;(iii)解决决定药物研发成功或失败的核心问题。最重要的是,药物化学能够识别临床候选药物,并提供新的策略,据此来提升靶点-和先导-发现阶段的范围和质量,尽管这些阶段常常被低估,但它们对减少药物发现过程中的损耗至关重要。事实上,大多数药物的失败是由于缺乏疗效和安全性,这可能与靶点和/或先导化合物系列的化学结构有关。
因此,选择哪个系列的先导药物是影响药物发现成功率的关键。然而,从多种可能性中找到正确的系列仍然很困难。近三十年来,人们提出了许多解决这一问题的方法,如基于组合化学(CombiChem)和多样性导向合成(DOS)的平行化学探索方法,同时,预测模型的精度也越来越高。尽管取得了一些进展,但就时间和成本而言,确定新的先导物仍然是一项极其复杂和繁重的任务。据估计,对于每一种通过批准的药物,平均需要大约20个靶点-到-先导物的探索和15个先导物优化项目,成本约为6亿美元(占新药开发总成本的32%)(图1A)。因此,加快早期药物的发现是一个长期存在的问题,它需要多模式的方法和创新的解决方案。
直至1980年,关于生物靶标及其对疾病机制的影响以及它们潜在的治疗应用的信息还非常有限。由于缺乏快速的体外筛选能力,化合物通常设计并以克为单位单独合成,以满足动物模型试验材料的要求。鉴于当时有限的方法和工具,这些合成通常是耗时并伴有风险的,而且效率很低。每周的输出产物很少,所以用于鉴定先导物的化合物库也非常有限。这些缺陷使得发现过程异常缓慢,然而成果的取得主要还取决于研究人员的直觉和创造力,甚至是来自于偶然的发现。随着时间的推移,这种化学-激发/药理学-驱动的方法已经在生物-激发/技术-驱动的过程中得以进化。高通量筛选(HTS)、计算建模以及最近的人工智能(AI)和学习机器(ML)的出现,使大量化合物的快速设计和评估成为可能。内部化合物收集的体外筛选和虚拟筛选活动可以揭示不同类别的活性化合物(hits),这些活性化合物经过化学修饰,可以提供具有改进性质的类似物(leads)。因此,在化合物吞吐量和可扩展性方面拥有强大的合成能力对于满足对化合物测试的持续需求至关重要。
此外,药物化学定义的结构-活性关系(SAR)的迭代学习过程包括计算设计、化合物合成、生物测定和数据收集,而这些分析将会驱动下一个学习周期的展开(图1B)。典型的,周期阶段是划分的,延迟是复合性、贯穿始终的,从假设到结果,经过缓慢的探索,到最后有限的化合物用于临床试验。
综上,研究者在此讨论了杰出的科学家对自动化流系统发展的贡献,以及他们对药物化学和药物发现的影响。研究者重点关注一些范例,这些范例展示了流技术在自动合成化合物收集方面的应用,可用于筛选以及闭环策略,突出了机器人和机器控制作为独立平台的潜力。对流动设备、分析设备、自动化工具和生物分析的概念、整合策略以及描述同样进行了阐述。
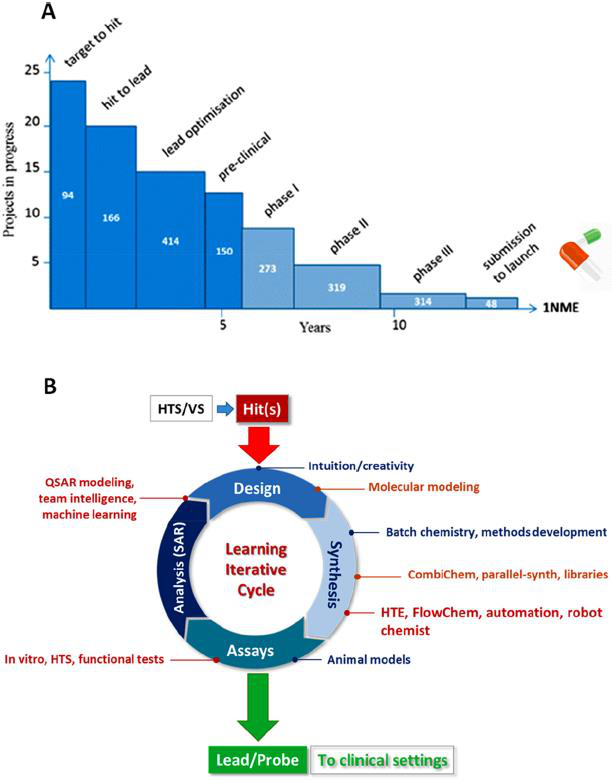
图1 (A)药物发现早期阶段的成本和时间。(B)基于不同学科活动的药物化学迭代学习周期,举例说明1980年以前(蓝色)、2000年以前(橙色)和现在(红色)使用的关键方法。
自动化流系统助力药物化学:
概念和设备
早在上世纪60年,固相肽合成就已实现了自动化。目前,自动的HTS筛选化合物库已经成为制药公司和学术实验室的常规工具。其他应用包括化合物存储库、高通量实验(HTE)、并行/组合合成、决策支持系统、虚拟筛选和分子设计。
在化学和生物学中,适当的自动化已经成为创新发现过程的重要驱动力,提高的效率同时,也降低了成本和时间。针对化合物集合的目标筛选是相对低成本、快速和极其有用的,尤其是在确定靶点化合物系列的优化阶段。然而,HTS活动的效率取决于化合物的可用性和合成。纯化合物的制备通常被认为是药物化学的一个限制因素,因为实验化学是一个劳动密集型和费时的工作。因此,化学合成与提纯分析的自动化、并行化、一体化,对于保证持续、快速的纯化合物供测试、提高重复性和降低成本(与人工、连续化合物合成相比)至关重要。
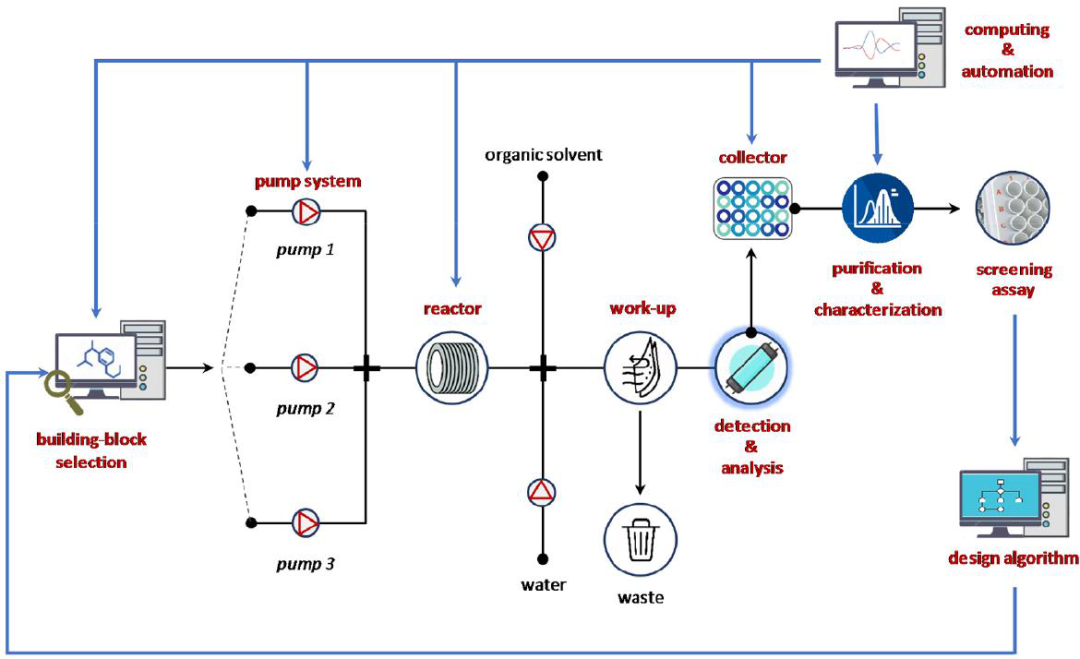
图2 集成流控工作流程用于自动分子设计、合成、筛选分析、优化迭代药物化学发现循环。
因此,合成和相关技术的自动化在先导物和药物发现方面发挥了核心作用,因为它们可以提供解决方案来克服当前的局限性。目前,基于机器-辅助-流的方法不仅增加了适合自动化的化学成分,而且提升了效率、安全性并减少了对环境的影响。此外,反应步骤与下游过程的集成,如在线软件辅助分析设备、预测计算工具和反馈控制,可以实现合成和药物化学过程的流线化(图2)。例如,ML合成平台与化学人工智能(CAI)的集成,将彻底改变化学家设计和发现新分子的方式,特别是在与实时筛选相结合的情况下。这种方法很吸引人,但实现完全集成的平台仍然非常具有挑战性,目前,只有制药公司和少数领先的学术研究小组可以做到。
流合成器
流合成器的使用,是批量化学理想地补充或替代,因为它具有以下几个优点:
-
精密控制。流合成器可以更准确地控制反应参数(包括浓度、温度、压力和反应时间等),这可以为转化更高的产品质量提供更可靠的方法,同时在制造工厂减少碳足迹。流动反应经历了有效的混合和传热/传质,对反应速率和生产力有有利的影响,而设备的增压允许操作在过热条件下扩大反应窗口。
-
安全。流合成器确保了危险或恶臭物质的密封和危险的化学转化的传导。在整条生产线上,流合成器与下游设备的集成、自动化和在线反应监测可以进一步减少手动操作和操作人员的风险,同时还适用于可伸缩和多步合成。
基本的流装置可以通过回收高效液相色谱和气相色谱仪器的部件(例如,泵或泵的一部分、连接器、油管、注射阀、自动取样器和馏分收集器)自行组装。计算机辅助设计(CAD)和3D打印技术的使用,使得现在允许自制定制的混合元素、停留时间循环、分离单元、芯片和反应器的特定流应用。对连续流化学的兴趣高涨也导致了相对简单、用户友好和商业上可获得的模块化流设备。
典型的流动装置由可互换和重复布置的模块组件组成,从而产生多种可适应的组合和设置。不同模块之间的连接使用油管和非湿润部件,即螺母和铁套管,用于将油管连接到各自的单元。管材的尺寸、几何形状和材料类型必须根据工作系统压力、化学相容性和需要,进行适当的选择。一般来说,对于低压和中压(< 30 bar)惰性全氟聚合物是合适的,而高压工艺则需要更坚固的材料,如不锈钢。根据流量、系统压力和反应溶液的性质,可以使用不同类型的泵来精确地将起始物料和试剂送入流系统,包括高效液相色谱泵、注射器泵、蠕动泵和旋转泵(图3)。高效液相色谱泵可用于流量大于0.1 mL min-1的低和高压设置,尽管可能会与挥发性溶剂泵发生故障。对于低压方案中较低的流量,注射泵可以确保更好的控制。这些泵由两个独立的注射器组成,其中一个将预先规定的液体输送到系统中,而另一个则同时进行灌装。无论是高效液相色谱泵还是注射泵,泵送系统都是与液相直接接触的,因此可能会由于试剂不相容、污垢或沉淀而造成损坏或中断。一旦出现以上问题,蠕动泵可作为在高流量和低压(最高可达10-15 bar),同时悬浮-良好的泥浆下泵送的替代品。此外,旋转泵也是一种选择:它们可以在比蠕动泵更高的压力下工作,并被赋予比HPLC装置更大的化学和机械阻力。
试剂可以直接从泵送到系统中,也可以预先装入样品回路中。第二种情况下,样品回路通过六路注入阀连接到流系统,并可以与自动取样器相连接,实现自动试剂输送。通过泵的动作,通过T-形或Y-形连接器或精心设计的用于高反应性转换的微混合单元混合后,反应物流被泵入反应器(图3)。反应发生在芯片、线圈和填充床反应器中,这些反应器的工作温度通过热电偶、低温装置、微波辐射和感应加热技术紧密变化(图3)。反应器类型和材料的选择取决于反应的性质和反应物。
基于芯片的反应器是由硅、玻璃、陶瓷或不锈钢制成的,尽管存在生产速度较低和潜在的堵塞问题,但其保证了对质量和传热的更好控制。线圈式反应器由不同外径和内径的氟聚合物(聚四氟乙烯[PTFE]、全氟烷氧基烷烃[PFA]和氟化乙烯丙烯[FEP])或不锈钢制造。这两种类型都可以通过光透明材料实现光化学反应。最近,管中管反应器、光化学反应器和电化学反应器已经商业化,可用于进行光化学、电化学和气体反应。最后,填充床反应器是理想的多相催化剂或固体载体的试剂。玻璃、聚合物和不锈钢柱或筒可与固体材料包装,以进行多相催化或清除树脂的粗提纯。回压调节阀(BPR)是一种特殊的阀门,可以保持系统压力恒定,允许在过热条件下工作,同时解决在常规批处理方法下可能出现的安全问题。此时,反应流可以在收集或进入下游操作前进行分析,包括通过膜或重力分离器进行液体/液体分离、色谱(模拟移动床色谱)、溶剂切换、在线蒸发、结晶和蒸馏。

图3 流动化学设备的范例
过程分析技术
FDA已将过程分析技术(PAT)定义为通过及时测量影响关键质量属性(CQA)的关键过程参数(CPP)来设计、分析和控制生产过程的系统。PAT包括大量的化学、物理和统计分析,以及各种分析测量,包括热电偶、红外、拉曼和紫外光谱、质谱、色谱、核磁共振、结晶监测以及粒子大小分析(图4)。
使用PAT的过程控制可以应用于各种质量参数(质量取决于设计,QbD)的实时分析、多变量和同步评估,以及过程危害的优化控制。当与流技术集成时,PAT对于在大规模开发期间的伸缩合成、库建设和流程优化的监控极为有用。在软件的帮助下,PAT可以与下游装置进行自动化合成,用反馈系统控制反应条件和优化代替筛选实验。通过串联合适的分析装置,使反应混合物在离开反应器后进行分析,从而实现在线分析。此外,分析也可以通过使用开关阀和流体分流装置进行采样来进行在线和离线分析。样品稀释器、溶剂切换装置和溶剂去除装置可设置在取样和分析之间。
根据研究过程的具体要求,目前有许多分析技术、工具和传感器可用于流装置(图4)。其中,高效液相色谱(HPLC)和气相色谱(GC)是最易于使用的技术,这是因为在大多数实验室中都有离线版本,成本低,在可检测的化学物质阵列方面通用性强,实施时间短。光谱学是PAT目前流体处理的首选方法,已被广泛应用于化学转化。光学传感器及设备可以直接插入反应器内部或旁边,从而避免了材料取样。根据所需的灵敏度、选择性和样品稳定性,不同的光学光谱技术可以与流仪器相结合,包括紫外可见光谱、荧光光谱、拉曼光谱和红外光谱(图4)。流化学与高分辨率PAT检测器的集成,如台式质谱(MS)和核磁共振(NMR),使能以高通量的方式对反应成分进行实时量化和识别成为可能。然而,与最常见的光学光谱和色谱技术相比,MS和NMR都更昂贵,且存在基质效应,因此在大多数情况下需要在分析前进行采样,以避免不必要的干扰。

图4 可用于连续流工艺的PAT的代表性范例。
计算工具和软件
一个自动化的基于流的机器需要在计算工具和软件的帮助下工作的。统计程序,如实验设计(DoE),进化,自我优化,或机器学习算法和基于云的系统都已经被证明是对药物化学和有机合成应用有效的监控,管理和调整操作流程系统。除了简单的试剂选择的管理和化合物收集库外,机器辅助流装置还可以应用于在闭环模式下的药物化学学习和过程优化的预测和决策行动。尽管这一领域仍处于起步阶段,但最近的进展已经推动了不同的流设备制造商、研究小组和专业公司为自动化药物发现平台开发特定的软件和编程语言。与此同时,用于自动化流系统的开源软件和计算机辅助方法也在迅速发展,包括LabVIEW、MatLab、LeyLab、OpenFlowChem、ChemOS和Chemputer等套件。
LabVIEW(实验室虚拟仪器工程工作台)是1986年由美国国家仪器公司开发的一种图形化编程语言,用于自动化控制和数据采集。图形表示基于直观的流程图,由三个主要组件组成:一个前面板,它是一个包含输入的模块;一个框图,它允许编辑代码,将图形化;以及一个连接器面板,作为连接的接口。这个看似简单的网络允许系统、驱动程序和桌面应用程序的集成和自动化,也可以通过多种方式实现远程控制。这种编程语言,在过去的几年里一直在更新换代,直到现在最新的19.0版本,包括大量的数据分析和过程控制功能,不同的代码框架(如COM, .NET和共享DLL),以及不同的通信协议(如RS232、GPIB和TCP/IP)。时至今日,LabVIEW已经在仪器控制、系统集成、机器人技术、自动化和数据库等方面得到了突出性的作用。
MatLab是由Mathworks公司发布的一种开源软件,支持可定制的高级数据分析。大量的工作已经证明了MatLab代码和LabVIEW编程语言的有益集成,可用于实现反应筛选和优化以及药物化学目的的自动化和完全集成的流程平台。
2016年,Ley集团开发了基于物联网概念的自动化流平台—LeyLab,可通过TCP/IP协议实现用户服务器和服务器设备通信,实现对其进行远程控制和监控(图5A)。该软件具有通过因特网浏览器访问的图形界面、存储与实验和设备有关的所有信息和数据的数据库、由不同代码、协议和命令组成的通信模块、以及包含针对单个设备的所有代码定义和命令的命令模块。利用该软件性能,分别采用在线IR和MS分析,已对Appel反应和丁腈水化反应进行了多维优化(图5B)。
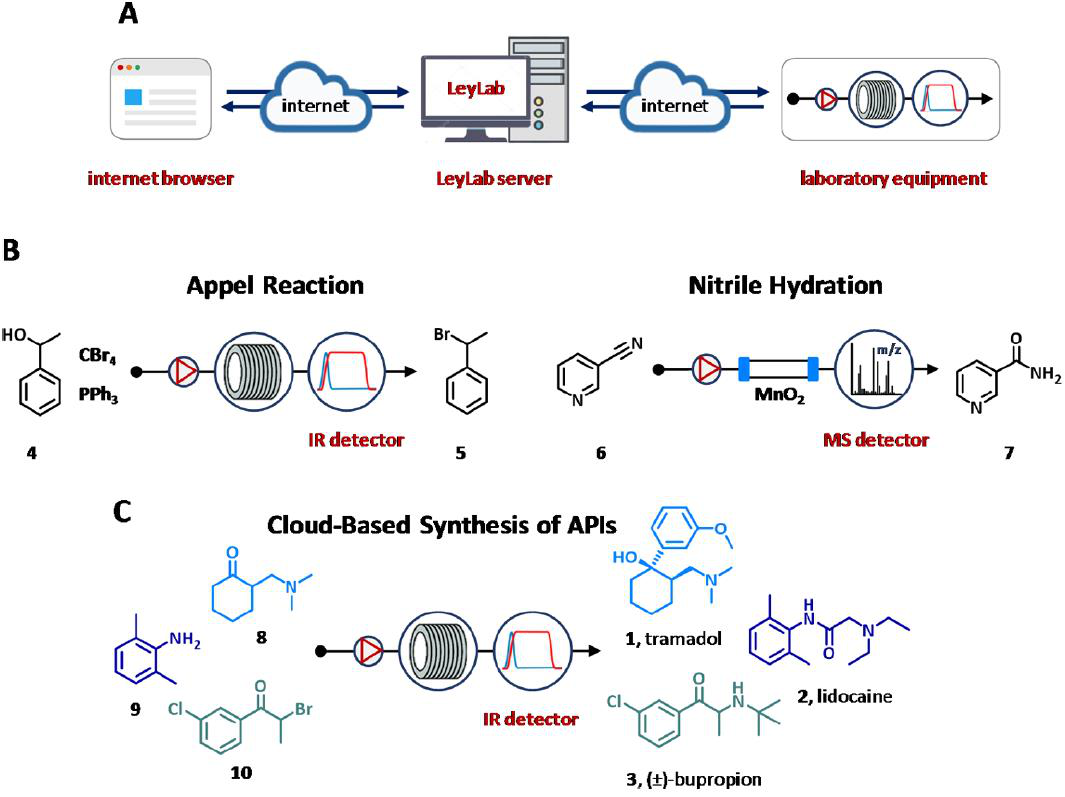
图5 LeyLab的示意图(A)和个案研究(B, C)。
此外,正如三个不同APIs的合成所演示的那样,LeyLab允许在服务器的不同位置定位和控制设备(图5C)。自优化的反应,其中包括合成(±)-曲马多的格氏加成(1);利多卡因胺环化和烷基化的方法(2);制备(±)-丁氨苯丙酮的溴化/胺烷基化步骤(3),都可在洛杉矶(CA,美国)使用剑桥(英国)的设备,通过位于日本的服务器监控和控制(图5C)。
OpenFlowChem,是最近一个用于流程自动化、控制和监控的开源平台,是为了简化不同软件之间的组合而创建的(图6)。基于LabVIEW和云的数据传输,通过MatLab借助SNOBFIT算法进行优化,该灵活的平台只需较少的编程工作,即可修改初始配置设置。OpenFlowChem平台由可处理连接设备的设备监视器、提供仪器间集成的系统模块和可选的外部安全装置组成。
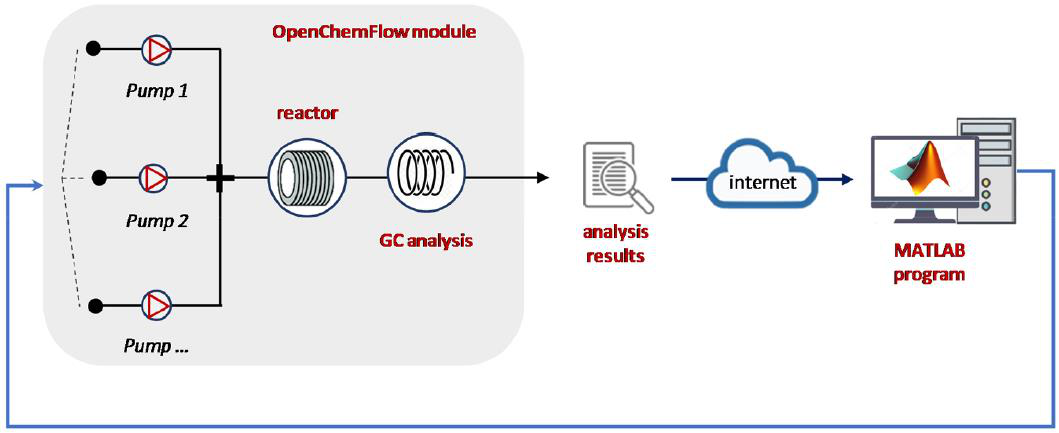
图6 OpenFlowChem平台的示意图。
最近开发的ChemOS是一个通用、灵活、模块化的软件包,它结合和编排了自动化机器人平台和AI算法。该平台还支持设备的远程控制和跨不同国家的实验室并行进行实验。ChemOS由六个模块组成,包括:(i)与研究人员的互动;(ii)数据库处理和管理;(iii)机器人技术;(iv)特征;(v)学习程序;(vi)分析。该系统的核心是学习模块,它能够在已有实验结果的基础上,自主、连续地提出新的实验参数集。
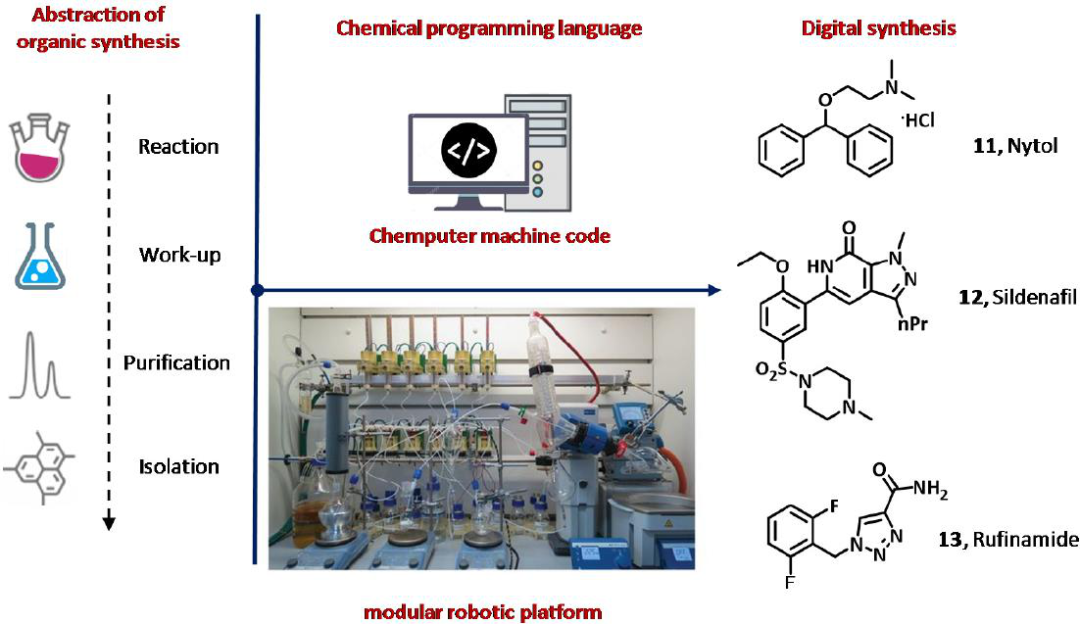
图7 Chemputer用于合成盐酸苯海拉明(Nytol, 11),西地那非(Viagra,12)和鲁芬酰胺(Banzel, 13)的示意图。
Chemputer是Cronin集团最近开发的一套软件。虽然迄今为止Chemputer仅应用于圆底瓶化学,但该软件能够控制整个硬件模块,并结合所需的单个操作单元,以完成所需化合物的实验室规模的自动化多步骤合成。可编程的机器操作和化学过程包括加热/冷却系统,搅拌和泵操作的控制,添加和混合试剂,系统清洗和启动,反应淬火,过滤和双相液体萃取,Chemputer用于控制复杂的多步骤合成序列,使用从Reaxys数据库收集的步骤,不需要任何的人为干预,并证实了其可用于盐酸苯海拉明(Nytol, 11)、西地那非(Viagra,12)和鲁芬酰胺(Banzel, 13)的合成。
生物验证
流平台与生物测定的结合提供了一个解决分隔和时空边界问题的机会,减少了药物化学循环中的闲置时间。此外,在线流量测试需要小容量(nL或pL)的测试解决方案,并已显示改进的数据重现性。众多研究已表明了与流系统兼容的特定生物测定法的发展,以及用于化学生物学研究的微流控芯片实验室设备的创造。
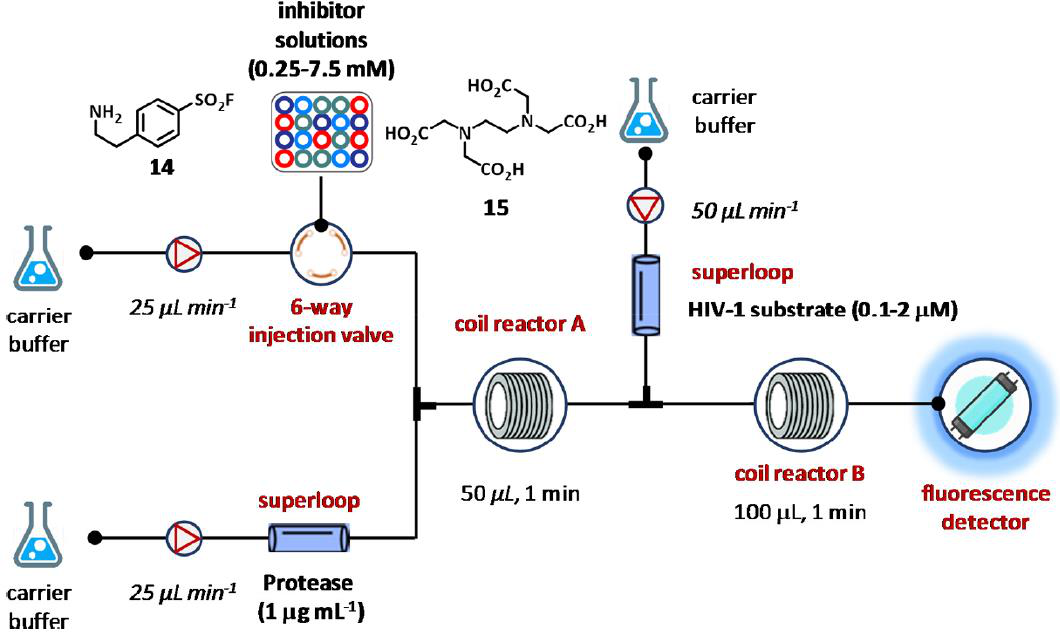
图8 使用荧光共振能量转移(FRET)的均匀连续流分析的代表。
第一个研究可以追溯到2003年,当Hirata和合作者描述了由荧光共振能量转移(FRET)组成的均匀连续流测定法,以测量在存在两种抑制剂的情况下人体免疫缺陷病毒(HIV)蛋白酶底物1的水解,即4-(2-氨乙基)苯磺酰盐酸氟(AEBSF, 14)和乙二胺四乙酸(EDTA, 15)(图8)。HIV蛋白酶底物1与两个染色体共价结合,即EDANS(供体)和DABCYL(受体)。该系统由泵、两个超回路和聚四氟乙烯线圈反应器、一个带有六端口注入阀的自动注入器和一个位于适当流量池内的荧光检测器组成(图8)。在优化条件下,将酶溶液(1 μg mL−1)和载体缓冲液(0.1 M磷酸盐缓冲液、0.1 M氯化钠和pH = 7.5时的0.05% (v/v)吐温20)以25 μg mL−1的速度泵入第一个反应器圈。超级旋转是安装第一个注射器和线圈之间反应堆提供酶溶液进入系统,而六端口喷射阀的自动注射器放置在第二个注射器和注射抑制剂浓度位于0.25到7.5 mM溶液的第一个反应线圈之间。得到的结果加上的HIV蛋白酶底物(0.1-2 μM)在50 μL min-1进入第二个线圈反应堆。最后,最后,混合物洗脱到荧光检测器以评估酶抑制和产生剂量反应活性(图8)。微流体生物测定随后通过插入在线偶联与尺寸排除液相色谱(LC)技术实现,该技术有助于从非活性化合物中分离蛋白酶抑制剂抑肽酶和AEBSF(14)。
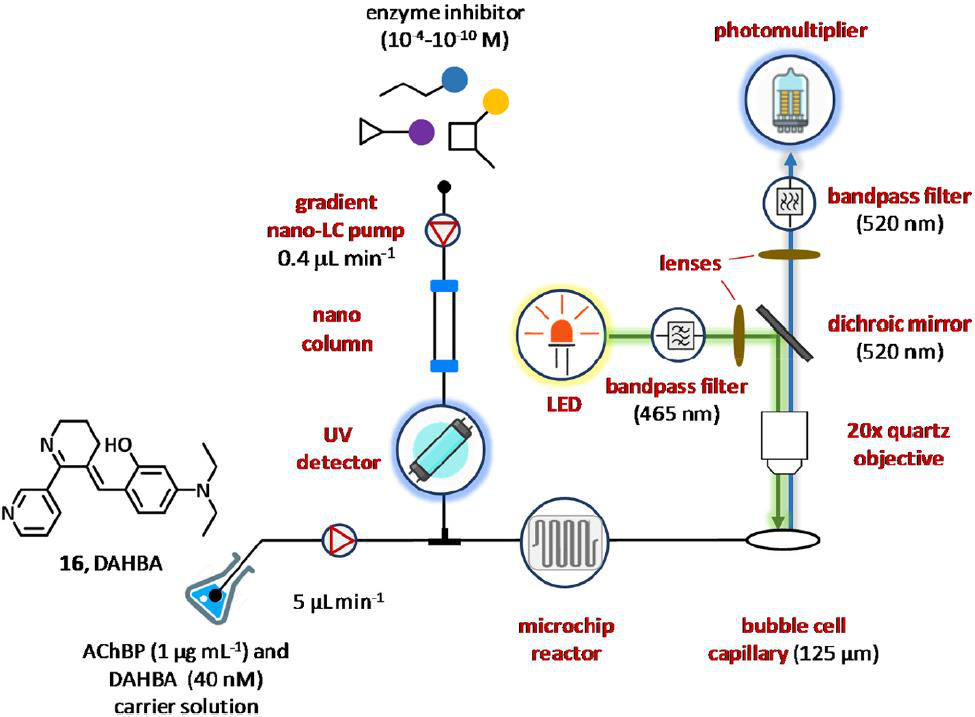
图9 一种用于鉴定乙酰胆碱结合蛋白抑制剂的微流控共聚焦荧光检测方法的发展。
2010年,Heus及其同事报告了一种新的方法,通过将在线纳米-LC与发光二极管(LED)和毛细管共聚焦荧光检测器耦合,可以最大限度地减少样品和试剂的消耗。用连字符连接技术成功应用的识别乙酰胆碱结合蛋白抑制剂(图9),特别是含有乙酰胆碱结合蛋白的生物测定溶液(AChBP,1 μg mL−1)和(E)3-(3-(4-二乙氨基-2-羟基苄基烯) 3,4,5,6-四氢吡啶-2-基)吡啶(DAHBA, 16, 40 nM)荧光示踪剂配体,由注射泵以5 μg mL−1的流量输送,并与0.4 μL m−1泵送的纳米-LC流出物在微型芯片(4 μL)中混合。在生化反应室中,DAHBA最终被纳米柱中的潜在配体洗脱,从乙酰胆碱结合蛋白上取代,导致荧光下降。该检测装置由高强度LED灯、一系列激发和发射滤光片、共聚焦透镜、二向色镜、光电倍增管和泡孔毛细管组成。LED灯发出的光通过一个465 nm的单带通滤光片过滤,用透镜准直,通过二向色镜反射90度进入泡池(520 nm)。随后,发出的光通过同样的二向色镜、聚焦透镜和一个520 nm的单带通滤波器,最后被光电倍增管检测出来。该检测系统与梯度反相纳米液相色谱相结合,在流注射分析模式和浓度响应方式下操作。综上,这些设备的组合可以确定9种抑制剂的IC50值,对于每个与约为~100 pmol的化合物只使用10 nL。
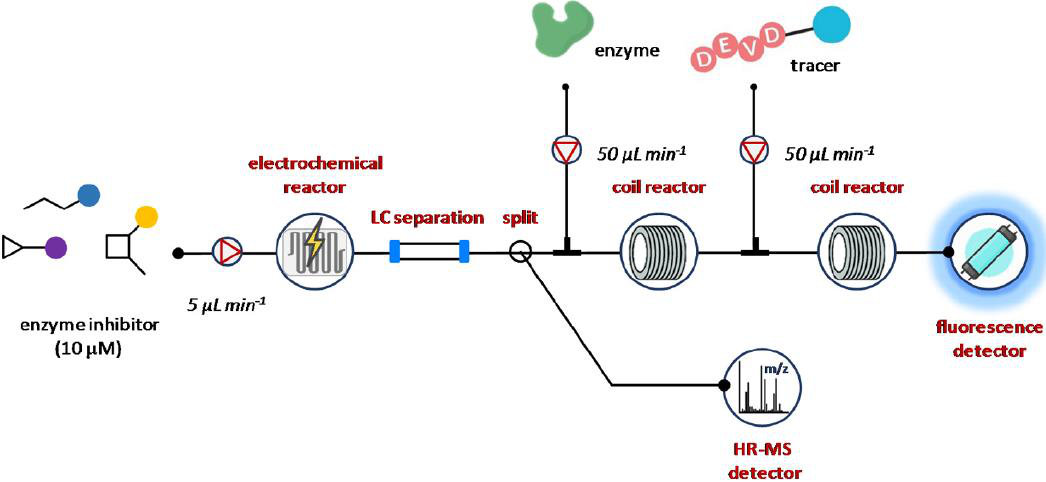
图10 电化学反应池与连续流生物亲和度测定和LC-HRMS分析的集成。
阿姆斯特丹大学的研究人员提供了一个优秀的概念证明,将连接的电化学反应细胞与连续流动生物亲和度测定和LC-HRMS相结合,以确定和表征电化学转化产物为p38α溶酶原活化的蛋白激酶抑制剂(图10)。该系统由四个模块组成:电化学反应池、LC系统、带荧光检测器的连续流生物亲和度检测单元和质谱仪。将激酶抑制剂的标准溶液溶解在适当的缓冲液(25% MeCN和75%的1mM水缓冲液)中,最终浓度为10 μM,用注射泵以5 μL min-1输送。缓蚀剂在线电化学转换后,拟合一个梯度LC柱对形成的产物进行分离。用柱后瓣膜通过p38α细胞生物亲和试验和质谱系统分离洗脱液。因此,将部分洗脱液(13 μL min-1)与p38激酶抑制酶混合,以50 μL min-1递送,并直接进入反应圈进行酶结合。与此同时,利用Shimadzu离子陷阱飞行时间混合质谱仪(LC-IT-TOFMS)在线分析了电化学转换(100 μL min-1)产生的第二次反应,以获得结合剂的结构信息。最后,添加示踪分子后,对酶进行检测。荧光示踪剂化合物允许快速表征新的p38α激酶抑制剂(图10)。
最近,Patel和同事开发了一种微流连续流注射滴定法(CFITA),用于监测凝血酶肽酶活性的抑制情况(图11)。CFITA检测设备基于四通道泵送系统,用于输送酶、底物、缓冲液和被测化合物。特别地,凝血酶(0.4 nM)及其基质(17.6 μM)均使用特定的milliGAT LF泵以250 nL min-1的速度泵送,用于高精度流体处理。止回阀和适配器连接在泵的后面,以防止回流和减少油管直径。将用含Cy5染料(500 nM)的缓冲液稀释的被测抑制剂填充在六路注射回路中作为内标。因此,抑制剂滴定是通过将阀门从负载位置切换到注入位置开始的,同时,一个额外的泵将缓冲液以500 nL min-1总流量输送到抑制剂通道中,以产生梯度。数字式流量计保证了对系统总流量的监控(1 μL min-1)。生物测定在不锈钢板中进行,而光学仪器是由带通滤波器共焦透镜具有两个励磁(488/650 nm)和两个发射(530/670 nm)二向色滤光片波长激光诱导同时励磁模块,和一组非球面共焦透镜的基线校正。结果,为每个被测化合物生成了生物测定数据和梯度数据的阶梯梯度滴定曲线。最近,这种流式生化分析方法已集成到环流控闭环药物发现的流平台中。
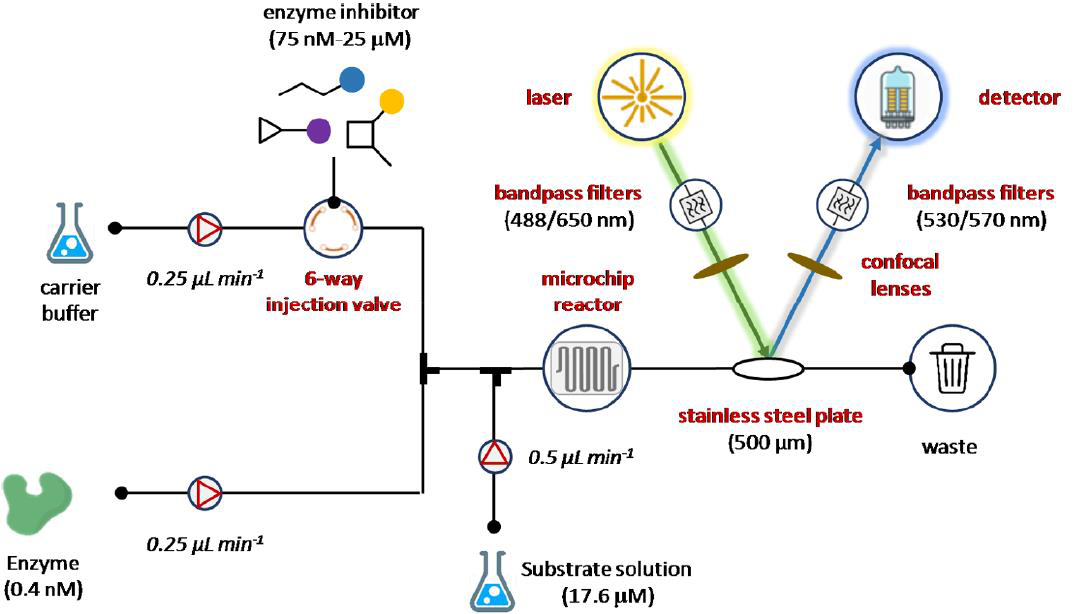
图11 微流控连续流注入滴定法(CFITA)监测凝血酶肽酶活性的抑制。
最后,在合成生物学的应用中,包括DNA组装、转化/转染、培养、细胞分选、表型测定、人工细胞和遗传回路等方面,已有大量的液滴微流体测定的例子被报道,Gach等人最近对此进行了综述。
自动化流合成和脱机化合物测试
在过去的几年内,众多研究表明利用可用于生物测试的化合物收集自动流合成是有利可图的。值得一提的是,Djuric和AbbVie等人在2011年实现的系统,可能是第一个在自动化流态下产生不同种类化合物的全集成系统(图12)。合成与集成流技术(SWIFT),是基于一个Accendo Conjure流反应器,其集成了自动取样器和制备高效液相色谱/设备(图12),可进行不同的化学转化,包括酰胺键和尿素的形成,还原胺化反应,三唑合成的Huisgen环加成作用、亲核取代,黄酰化反应,从而获得高纯产品。特别的是,该装置能够在10-20 mg的规模下合成由10-48个成分组成的不同化学库,产量从23%到63%之间不等,平均每小时可合成6个化合物。2014年,使用三菱机器人(图12)对SWIFT进行了进一步的补充,该机器人采集了整个过程的样品到下一阶段,包括合成、纯化、样品分配用于纯度评估、蒸发和样品制备用于筛选。
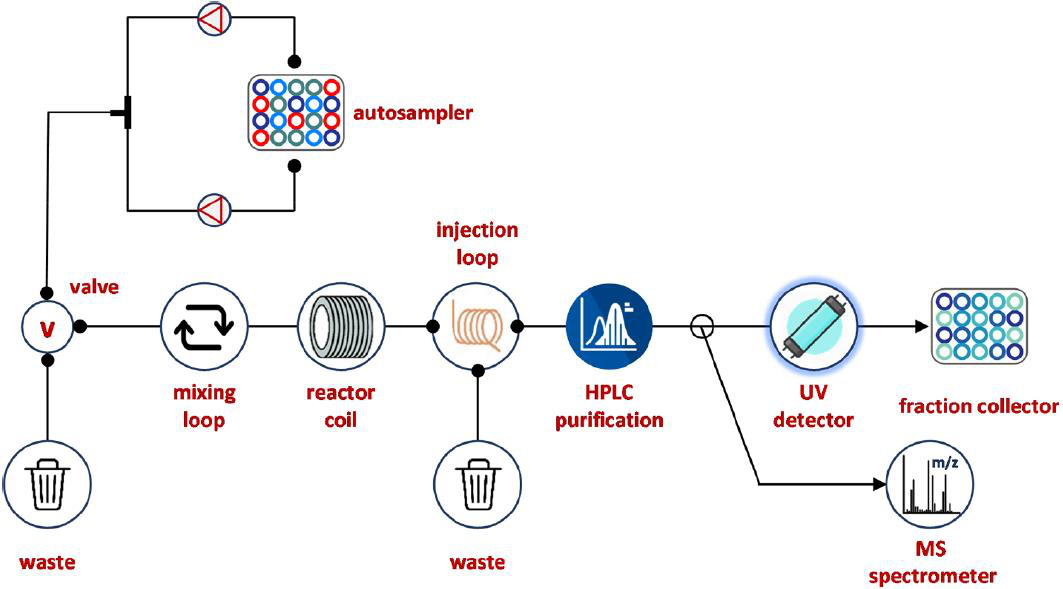
图12 AbbVie的SWIFT系统示意图。
最近,Perera和同事描述了如何将反应优化策略与化合物合成相结合,并在药物化学环境中拓宽反应化学空间。基于自动化流平台进行了Suzuki−Miyaura反应与交叉偶联产物合成的超快实验筛选(图13)。通过筛选不同的反应条件和组分(包括溶剂、催化剂和碱基),该单个模块单元得到了验证,从而在不到4天的时间内生成了约6000个反应的信息。然后采用最佳条件制备了一毫克级的Suzuki−Miyaura环加合物,该加合物产率≥85%,且纯度高。
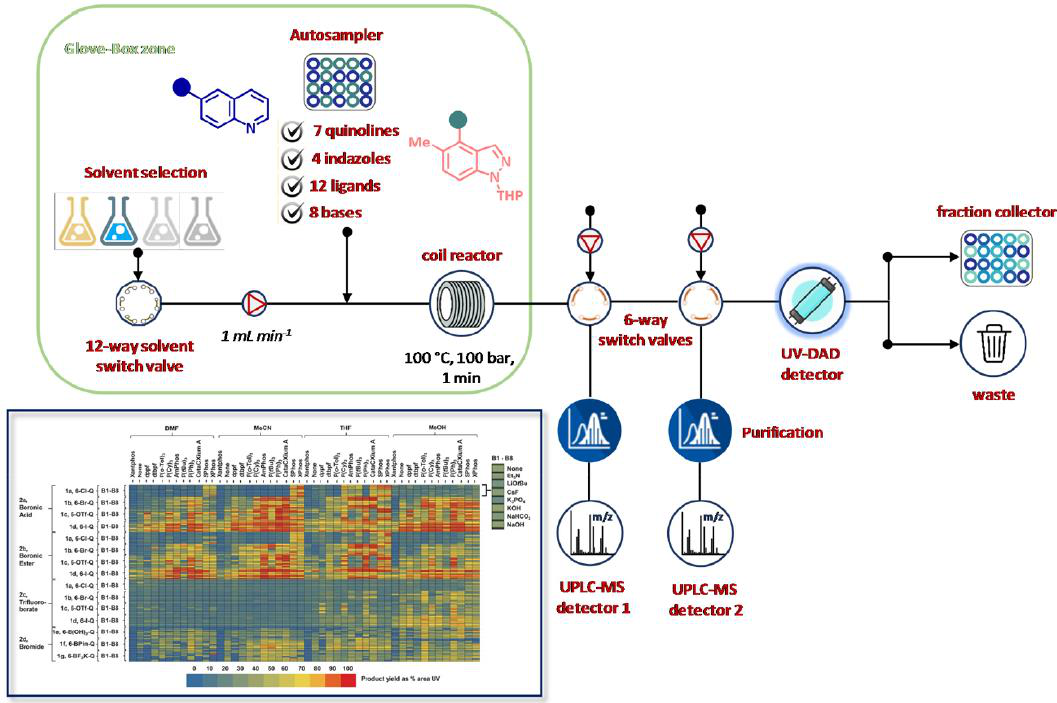
图13 用于Suzuki−Miyaura反应筛选、优化和验证的自动化流平台。
接下来的案例,将展示用于合成和表征化学库使用不同水平的自动化和离线生物评估的高通量流策略的发展。
2013年,Ley小组描述了一种自动三步流法合成咪唑[1,2-a]吡啶衍生物,包括GABA-A激动剂唑吡坦(17)和阿吡坦(18),通过前沿亲和色谱(FAC)测试白蛋白结合评估(图14)。该程序包括使用管式和盘管式反应器、支持试剂和清除器、用于给药的自动扩增器和分数收集器。在聚合磺酸树脂的诱导下,乙醛酸乙酯(在PhMe中1.5 M)和苯乙酮类似物(在PhMe中1M)在120 ℃下反应25 min,开始合成。过量的乙醛酸可用负载苄基胺的清除柱清除。由自动进样器以0.3 M浓度给药纯不饱和酮中间体,并在管状反应器中与少量过量的不同氨基吡啶反应,反应器中充满50℃加热的MgSO4(图14)。因此,在120℃的条件下,在盘管反应器内很容易形成Ketimines,粗混合物被酸树脂连续纯化。通过将酯部分转化为酰胺和羧酸基团,进一步提高了库的多样性。结果,在4天内以10-70%的收率制备了22个咪唑[1,2-a]-吡啶类似物。人工或自动稀释后,将合成的化合物通过含有固定化人血清白蛋白(HSA)的柱,以检测FAC的结合活性(图14)。除了测定的KD值与先前报道的唑吡坦(17)和阿吡坦(18)数据高度相关外,该方法可能对预测药物血清蛋白相互作用有重要的实用价值。
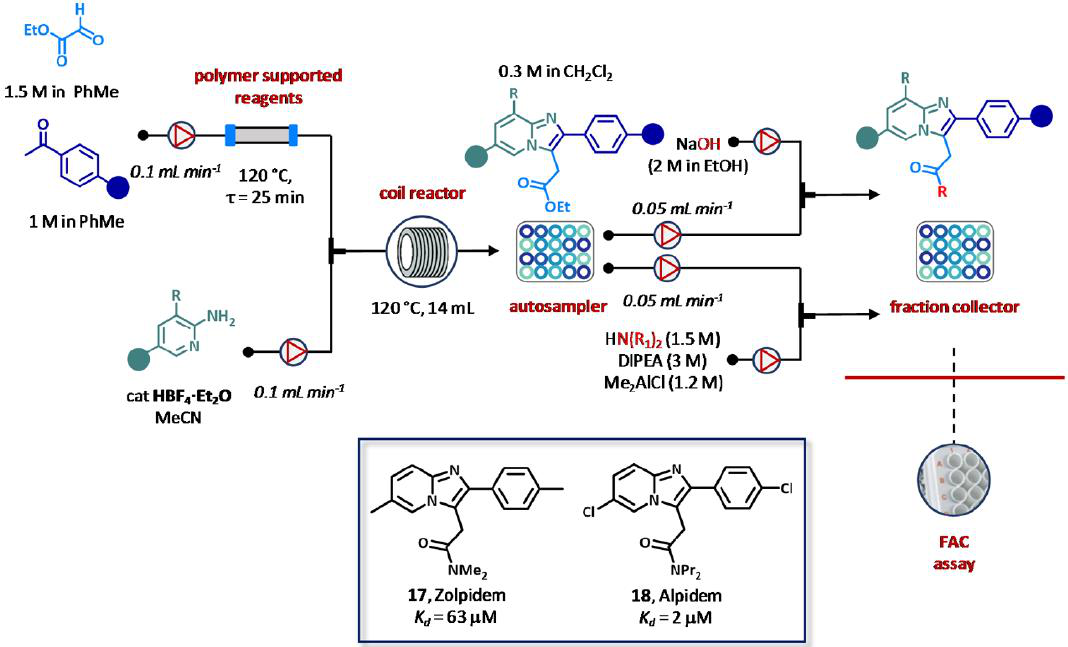
图14 前沿亲和层析法(FAC)检测咪唑[1,2-a]-吡啶的自动流式合成和纯化。
制备新型BRD9溴域抑制剂也采用了上述同样的策略。尤其是,当3,6-二氯吡啶-4-羧酸(19, 0.25 M)在Et3N (1 M),tBuOH (1.5 M)的存在时与二苯磷酰叠氮(DPPA, 0.375 M)进入中间体20的柯提斯重排反应,是用于制备氨基三唑吡嗪核(21)的器械,后来被用作合成结构相关类似物的构建块(图15)。采用远程控制流动设备生成酰基叠氮中间体,并在两个不锈钢反应器中进行热环化(120℃) (50mL, τ= 2.3 h)。一个在线压力调节器保证气体的控制过程中产生的反应,同时相比传统的批处理程序具有更好的热交换。最重要的是,不稳定的酰基叠氮中间体易于反应自主合成氨基甲酸酯20,产率为2 mmol h-1。接下来的步骤包括叔丁基羰基(BOC)的脱保护,三唑环的形成,铃木交叉偶联反应分批进行,从而生成6个BRD9溴域抑制剂。然后使用FAC-MS仪器对合成的化合物进行离线测试FAC-MS仪器是专为BRD9测定而设计的,由一个固定在链霉亲和素包覆珠上的生物素化BRD9溴域的定制柱组成。因此,化合物22被确认为是最有效系列的模拟物,另外在FAC-MS中显示了1167 μL的保留时间(Vret)和针对BRD9的热稳定试验+ 4.3的热转变(ΔTm)。此外,尽管比较少(Vret = 784 μL,ΔTm = + 2.4),但化合物23显示了对BRD4溴域有更好的选择性(图15)。
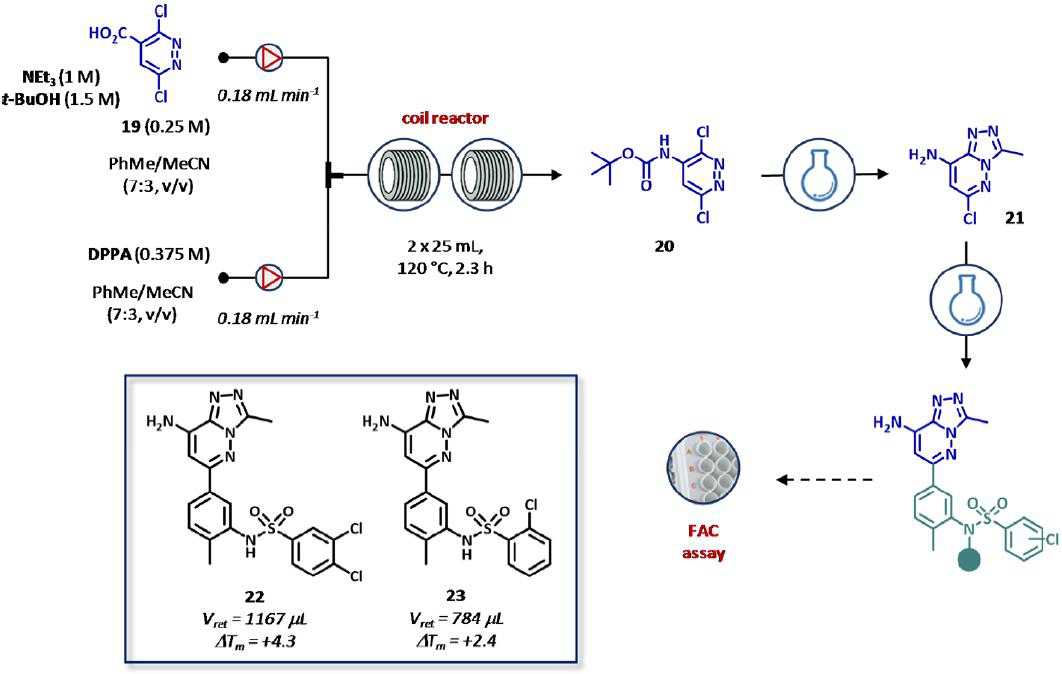
图15 通过前沿亲和色谱(FAC)测定BRD9溴域抑制剂的自动化流合成和测试。
此外,自动化流控平台还与全新的分子设计相结合,以驱动库扩展和靶点优化的构建块选择。Schneider及其同事报告了第一个例子,他们将微流控合成与基于计算机的靶标预测结合起来,用于快速制备和测试咪唑吡啶基化合物(图16)。
Ugi三组分反应在采用总体积为5 μL的硼硅酸盐DeanFlow芯片、锯齿形混合器和自动填充、稀释、分配的电磁阀组成的流装置中进行。初步筛选后的反应参数,反应是在泵送原液进行的,该原液由胺(0.3 M)、醛(0.3 M)、10%高氯酸在乙醇和异氰酸的乙醇溶液(0.3 M)组成的,总流量为15 μL min-1。因此,采用高效液相色谱法纯化咪唑并吡啶12,分离收率在5% ~ 53%之间不等,纯度≥95%。该系统与由ChEMBL数据库中469个已知药物靶点构建的高斯过程回归模型相结合,获得所有被测化合物对靶点的预测亲和力。因此,研究者选择了5个潜在靶点,包括腺苷受体A1和A2B、肾上腺素能受体α1A和α1B以及PDE10A进行进一步研究。通过放射性配体位移分析和基于细胞的功能活性测定从12个符合回归模型预测结果的化合物中找出9个,化合物24和25是活跃在肾上腺素能受体的拮抗剂α1B (Ki = 2-3 μM)和化合物26显示了对肾上腺素能α1A和腺苷A2B受体的拮抗剂配置(图16)。
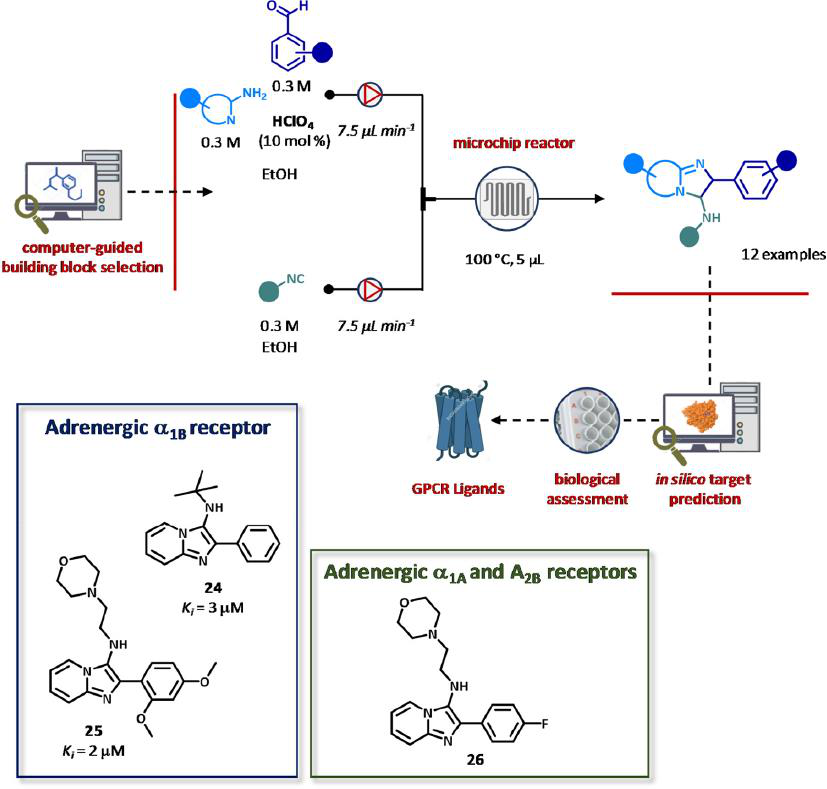
图16 合成咪唑并吡啶的微流控平台。
研究者最近报道了,作为新型孕烷X受体(PXR)激动剂的手性四环四氢喹啉的流合成、自动化、分析和计算工具的集成(图17)。采用多组分Povarov反应在连续流动和自动化条件下,在3个工作日内快速合成了29个类似物。用手性高效液相色谱法完成了纯非对映异构体的纯化和立体化学赋形,采用含时密度泛函理论(TD-DFT)计算实现了硅电子圆二色性(ECD)分析。然后将纯同分异构体通过AlphaScreen法鉴定可知:化合物27可作为PXR的低微摩尔激活剂(EC50 = 1.2 mol / μM),有效率为119%。总的来说,该系统提供了一种理想的基于流的方法,用于发现和优化多组分化合物库的自动生成和表征。所提出的工作流确实可用于具有相似自由度和原子的支架,以加快药物化学和立体选择性多组分方法的发展(图17)。
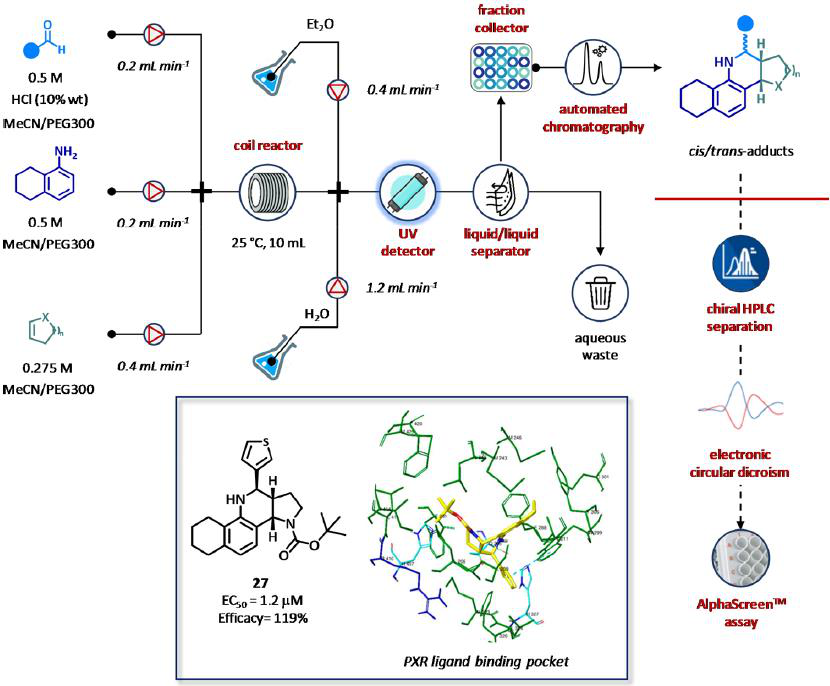
图17 用于新型PXR激动剂的四环四氢喹啉类的自动化流合成、纯化和分析。
端到端机器辅助发现
将自动化流合成与下游操作、PAT、生物测定和计算相结合,有可能实现最佳的发现周期时间。在小分子药物发现中,闭合合成、自动化、药物设计和数据分析之间的循环正在如火如荼地进行。
2005年,葛兰素史克公司的研究人员报道了一项开创性的工作,旨在创建一个能够集成合成和生物筛选的平台(图18)。他们制备了磺胺类药物库,并对T-细胞酪氨酸磷酸酶(TCPTP)进行了连续筛选。该设备由UHPLC泵送系统、微芯片反应器、自动采样器、稀释装置、检测系统和用于分析的LCMS组成(图18)。
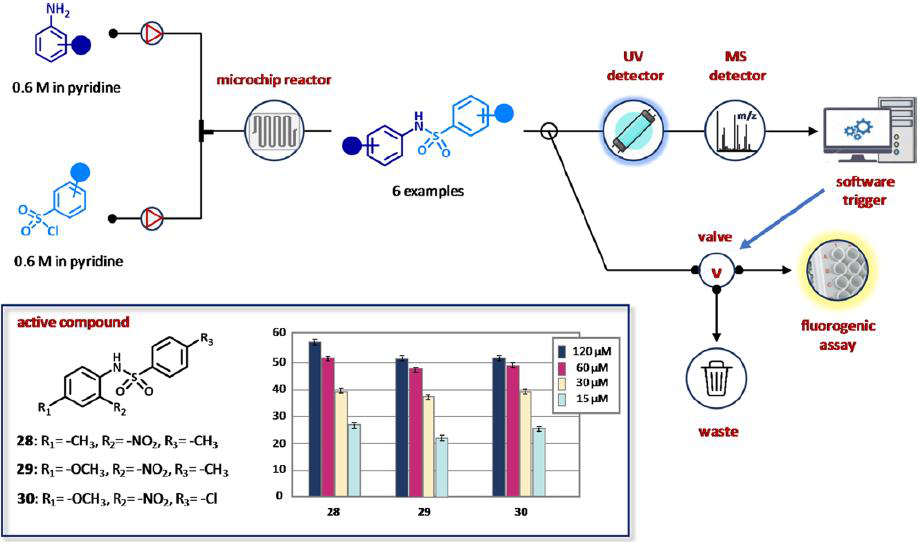
图18 用于自动化合成磺胺和T-细胞酪氨酸磷酸酶(TCPTP)抑制剂的在线生物筛选的集成流平台。
硝基苯胺(0.6 M)与磺酰氯(0.6 M)在吡啶存在下反应后,通过LC柱,裂解成两个样品:一个用于紫外线/ MS检测/分析,另一个用于荧光法在线筛选TCPTP的抑制作用。六分之三的磺胺类药物分别在120和15 μM处表现出高达60%和25%的抑制作用。
2013年,Cyclofluidic公司与Sandexis LLP、Accelrys公司以及Sanofi-Aventis公司合作,设计了一个在算法设计(CyclOps)辅助下的全集成自主平台,简化了多种靶点-到-先导化合物的优化方案(图19),其想法是提供一个能够集成自动化和连续流机器的闭环SAR系统。CyclOps是由具有液体处理元件的商用模块化反应器组成的,用于将起始材料和试剂输送到注入回路中。一旦反应混合物从反应器中洗脱后,粗混合物被制备型高效液相色谱(HPLC)提纯并进行分析,然后收集到一个馏分收集器中。一旦确定了最终的浓度和纯度,液体处理机器人就会取下一部分样品,用缓冲液稀释,然后在基于芯片的荧光分析中进行测试。IC50数值得到的结果非常容易通过设计算法处理,以建议下一个化合物在虚拟空间经过评估后被合成。
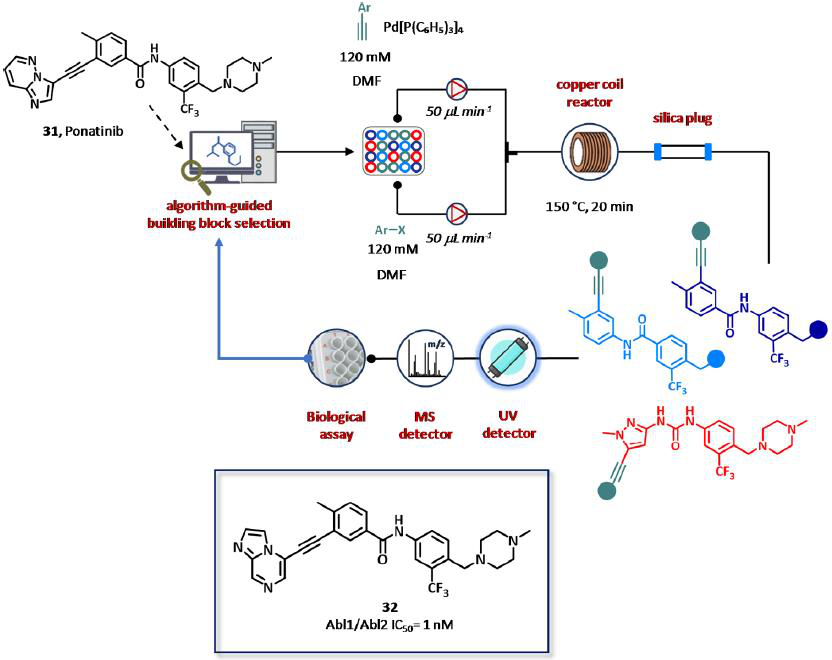
图19 Cyclofluidic公司的闭环CyclOps平台,基于辅助算法的药物设计用于Abl激酶抑制剂的全集成、全自动的合成、纯化和筛选。
该平台首次被验证可用于发现新的Abl激酶抑制剂(图19)。对帕纳替尼(31)的X射线衍射(XRD)结构得知,一个已知的抑制剂结合到Abl激酶的活性部位,两个经过识别结构热点用于配体的设计,在四(三苯基膦)钯(0)为催化剂、铜圈作为流动反应器的情况下,为芳基卤化物(10个片段,120 mM的DMF溶液)和炔(27个片段,120 mM的DMF溶液)的Sonogashira交叉偶联反应做准备。在第一轮合成SAR的过程中,仅在30小时内就在潜在的目标化学空间(270个化合物)内生成并筛选了22个化合物,并得到了热图矩阵,其中两种算法将辅助下一个化合物的分子设计。在第一个实验集的数据基础上,进行第二轮SAR循环。经过90个设计合成筛选周期,在大约4天内合成了64个新化合物,并对Abl1和Abl2激酶进行评价,总体合成成功率为71%,分离收率为5%至30%不等。从研究中,11种化合物被发现是Abl1/Abl2的有效抑制剂,IC50值在低纳摩尔范围内,与传统的生物测定方法相比,显示出高水平的相关性(图19)。有趣的是,所选择的靶点化合物也是所有临床相关Abl1突变体的有效抑制剂,并且对Abl1的选择性超过P38α的副产物,酰胺衍生物32也被赋予了良好的膜通透性和对人肝微粒体的适当清除。
CyclOps同样可通过两步法自动流合成应用到黄嘌呤基二肽基肽酶4 (DPP4)抑制剂的开发(图20)。特别地,反应是通过在N-甲基-2-吡咯烷酮 (NMP)中自动注入8-溴代黄嘌呤(0.3 M),并在同一溶剂中注入所需的保护二胺溶液(0.6 M)进行的。混合后,反应依次在2 mL不锈钢盘管中进行,加热温度为150℃,总流量为0.1 mL min-1(τ = 20 min)。随后,将反应器的产物与泵送50 μL min-1的甲烷磺酸水溶液(30 wt %)混合,并将混合物通过第二个2 mL盘管反应器泵送,在90℃加热(τ = 13 min)去除BOC。反应产物经在线液相色谱质谱系统纯化,缓冲液稀释,多孔板测定猪和人DDP4残留酶活性。采用这种迭代循环,12个化合物在24小时内被合成,收率从3%到38%不等。有趣的是,12个分子中的5个(化合物33-37)对两种酶都表现出纳奈摩尔级的抑制活性。利用从SAR分析中获得的数据,利用一系列氨基醇代替BOC-保护的二胺进一步扩展化学探测。总体来说,29种化合物在高纯度的制备和测试仅在三天内完成,化学成功率为93%。同样观察到与以前通过传统方法获得的数据高度相关(图20)。
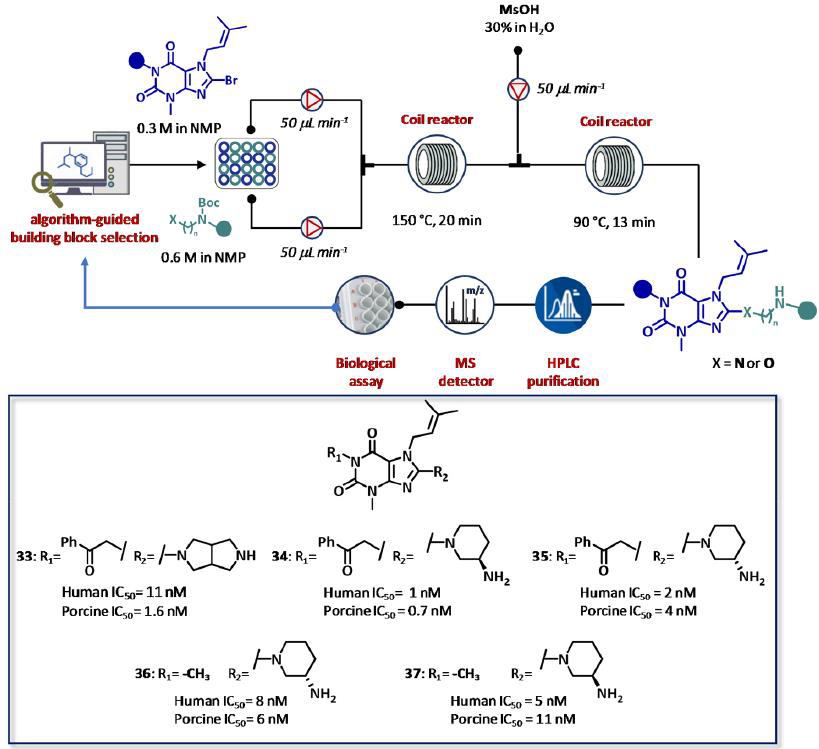
图20 Cyclofluidic公司的闭环CyclOps平台,基于辅助算法的药物设计,全面集成、全自动合成、纯化、筛选二肽基肽酶4 (DPP4)抑制剂。
最近,Cyclofluidic公司展示了CyclOps平台在蛋白酶抑制剂领域的成功应用(图21)。在本案例研究中,从商业上可获得的化合物中产生的初步合成的SAR数据输入被用来鉴定一系列具有显著效力、选择性和结构操作的化学适应性的靶标。特别地,从化合物38 (IC50 = 1.13 μM)开始,该化合物对尿激酶型纤溶酶原激活剂(uPA)具有良好的选择性(IC50 > 10 μM),采用液相色谱/质谱/蒸发光散射(ELSD)联用流合成器进行分析和纯化,结合生物法测定蛋白酶和uPA测试,以及在线色谱测定。该系统使用一种基质选择和效力预测算法完成(图21)。特别是,硅基化氨基酸三甲基硅基酯的贮存溶液(0.35M的CH2Cl2),在二异丙基乙胺(DIPEA)存在下,总流速为100 mol L min−1,并在60℃下反应到2 mL反应器线圈中,和所需的磺酰氯化物,酰氯化物,异氰酸酯(0.42 M的CH2Cl2)进行混合。20分钟后,盐酸脒、豆荚溶液(0.35M的NMP)以及六氟磷酸阿扎苯并三唑四甲基乌溴铵溶液(HATU)(0.35 M的NMP)整合成中间体,进而作为偶联剂以50 μL min−1的流量通过每一个泵进行泵送。在100℃加热时,混合物被反应到第二个2 mL反应器线圈(τ = 10 min)。选择了63种氨基酸、磺酰/氯酸/异氰酸酯和氨基酰胺的反应物,覆盖了5472种化合物的虚拟化学空间。最佳目标采样(BOUS)是一种多参数优化方法,用于设计新的改进的类似物。初步进行了24个闭环合成筛选实验,共63个产品,活性化合物含量为70%。第一次SAR运行允许将所调查的虚拟化学空间从5472减少到297个化学实体。采用Chase Objective tool进行多次闭环实验,鉴定出39,含有(R)-环己基甘氨酸残基的衍生物,其纳摩尔IC50值(33 nM)是最有效且选择性指数(蛋白酶/uPA)大于100的化合物。两套新的22合成筛选循环和21个封闭循环实验被执行使用氨基酸池的一个受限子集。(R)-苯基甘氨酸衍生物40是最好的化合物,具有纳米级蛋白酶抑制(IC50 = 22 nM)和高uPA选择性(> 6000倍)。根据10种丝氨酸蛋白酶的选择性谱、ADMET谱(溶解度、PAMPA通透性、小鼠和人微粒体的代谢稳定性、Hep-G2细胞的细胞毒性),对先导物40进行了表征,并在致癌功能测定中进行了测试。总的来说,使用CyclOps平台在9天内(每周期90分钟)提供了142个化合物(超过5000种可能的组合),其活性和选择性优于uPA。
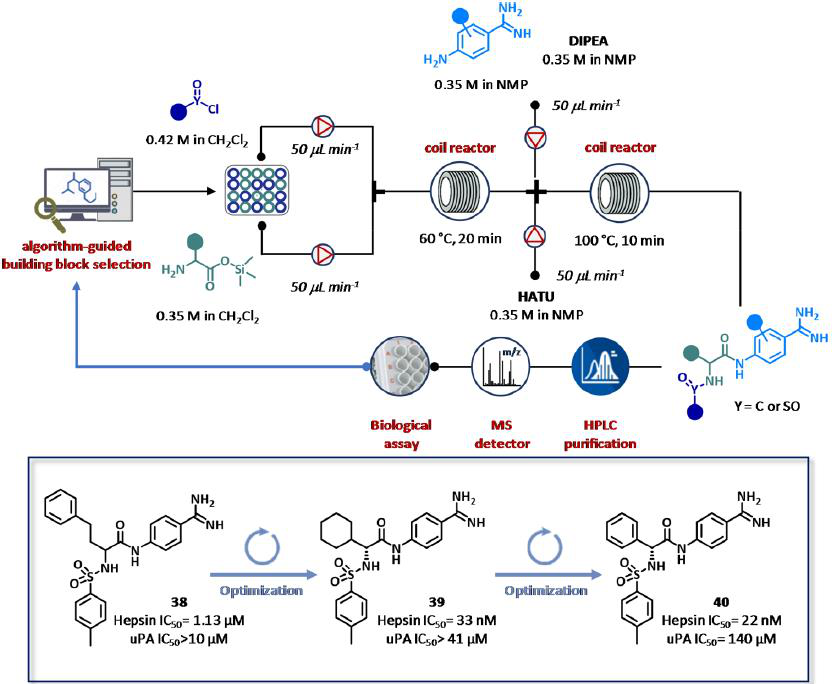
图21 Cyclofluidic公司的闭环CyclOps平台,用于蛋白酶抑制剂的全集成、全自动的合成、纯化和筛选,辅助基于算法的药物设计。
2014年,Hoffman-LaRoche大学的研究人员公开了一种类似的自主组装装置,用于快速生成β-分泌酶(BACE1)抑制剂。一个小的酰胺库可在4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基四氟硼酸铵(DMT-MM, 0.083 M, DMSO或DMSO/ DMF, 1:1)存在时,从两个商用苯胺类(0.06 M的DMSO或DMSO/DMF, 1:1)和10个羧酸合成纤维(0.0083 M的DMSO或DMSO/DMF, 1:1)得到,在流动条件下合成,用高效液相色谱法纯化(图22)。等分(4-5 mL)的纯化化合物是由液体处理器收集,分析了质量纯度估计(81-98%),用HPLC-ELSD校准方法进行量化评估最终的浓度,在剂量反应芯片分析和测试提供在60分钟每个化合物的总周期时间的IC50值。有趣的是,为了提高采样精度,同时最小化测试所需的化合物量,使用玻璃毛细管控制扩散产生了浓度梯度。值得注意的是,该系统产生的SAR数据可与传统方法获得的数据进行比较。化合物41最终被鉴定为库中最强的BACE1 (IC50 = 12 nM)。
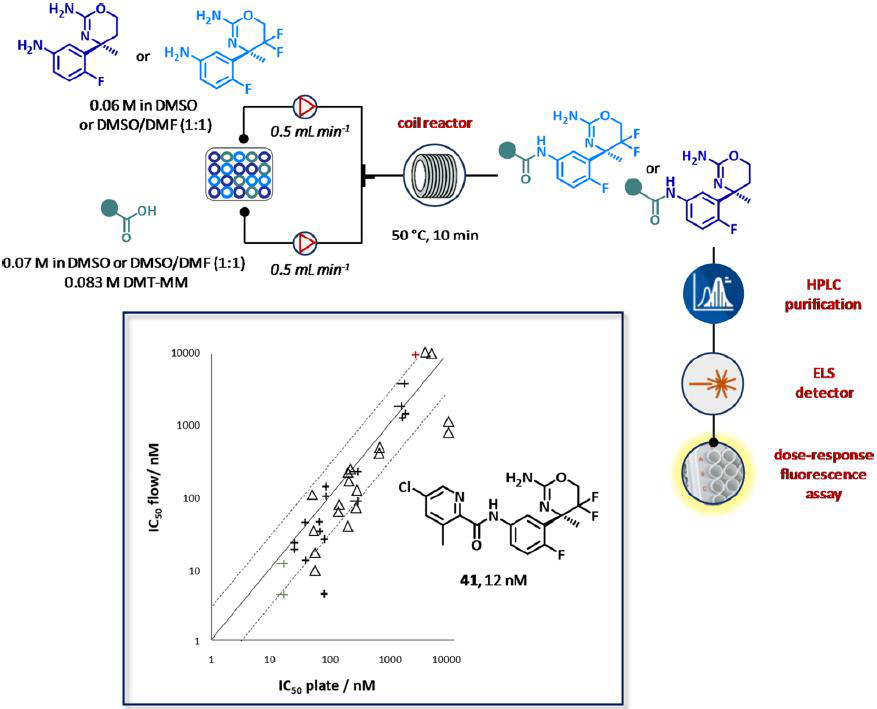
图22 完全集成和自动化流系统的生成BACE1抑制剂。
2016年,首个用于合成生物学的可编程多用途微流体组件被开发出来。该系统由微流控芯片、电子气动控制系统、温度调节器和具有基于web界面的自动化软件组成(图23)。该实验室-芯片平台能够利用分层DNA构建(IHDC)技术,将DNA库的设计、合成、转化为不同宿主(如大肠杆菌和酿酒酵母)等迭代合成生物学步骤集成自动化。这种方法是专门为微流体功能分析而设计的,包括细胞生长、蛋白表达诱导、比色分析以及图像数据分析。
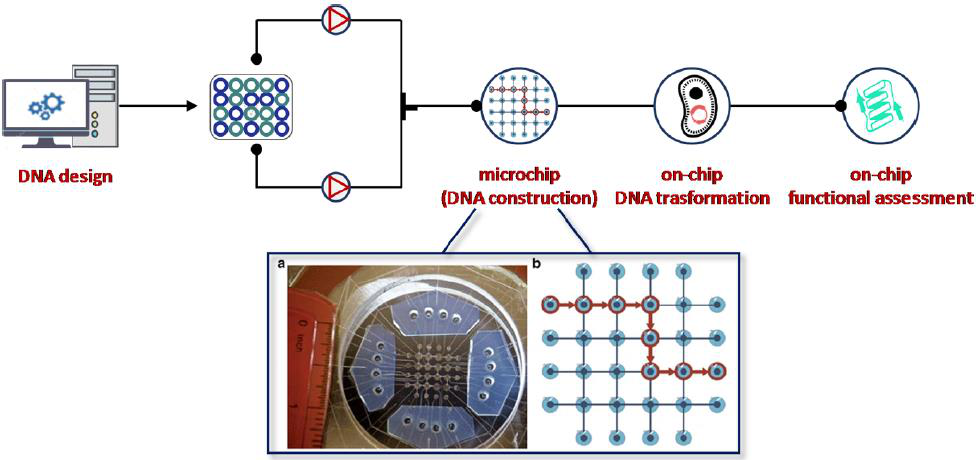
图23 合成生物学的第一个自动微流控平台示意图。
与上述工作类似,MacConnell及其同事描述了一种基于微流体的超高通量冲击序列反褶积装置(图24)。这个微型装置通过将库先导物分布到pL-级检测试剂滴中能够检测DNA-编码的先导化合物,可从先导物中进行化合物的光化学裂解,检测孵化,激光诱导荧光结合检测用于靶点鉴定,和采用荧光激活液滴分选和DNA条形码测序分离。因此,将具有阳性对照抑制剂抑肽素A的DNA-编码先导物(直径10 μm,1920个先导物,729个编码序列)与阴性对照先导物(58000个先导物,1728个编码序列)混合,通过生化酶活性测定筛选组织蛋白酶D抑制作用。总的来说,测定(18分钟孵育,240分钟分析)时间在4小时内,混合测定体积和0.05 mg的先导物的筛查只需要120次。值得注意的是,采用模板条形码策略,可以将错误发现率从目测的24%降低到2.6%。
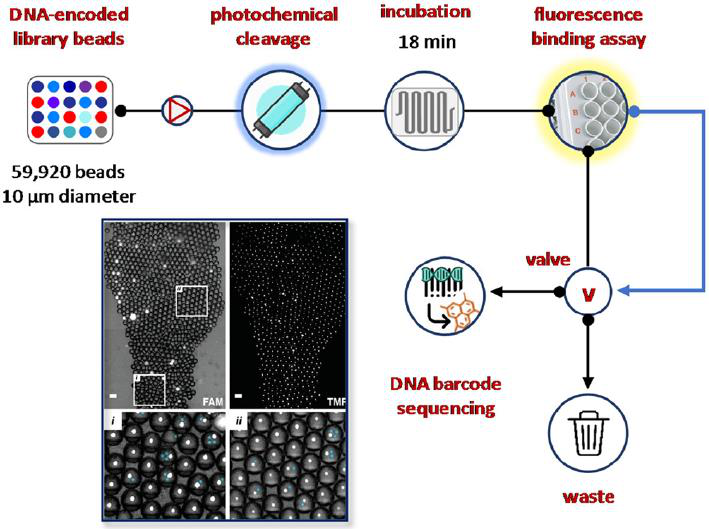
图24 基于DNA-编码先导化合物序列的超高通量靶点反褶积微流控平台。
最近,Guo及其同事报道了一个基于流合成和识别蛋白结合物的集成平台(图25)。特别是,通过使用一个快速的微尺度流合成加上凝胶排阻色谱(SEC)-MS技术,模块化平台解决了传统蛋白质-定向的动态组合化学的主要局限性(DCC),包括在低浓度下抑制剂的不良反应性,在长时间的平衡时间内,蛋白质活性的降低或抑制剂的分解,以及目前可用的分析检测方法的低吞吐量。本系统基于从醇和羧酸池中发现药物片段的原理,通过制备和测试动态组合库(DCLs),应用在了牛血清白蛋白竞争性抑制剂的鉴定。首先,在微流控和常规间歇条件下合成了四个成员的DCL。该装置包括所需的羧酸(10 mM)和醇(15 mM)在己烷中酯化。将得到的DLCs成员以61 μL min−1的流速泵送,并与以61 μL min−1的流速泵送含有H2SO4 (pH = 1, 1.5 mM)和BSA (10 mM)的蒸馏水中进行结合。在50℃使用GC检测器来监测达到平衡时,培养是在微反应器中进行(V = 7.32 mL, τ = 60 min)。值得注意的是,较高的表面积-体积比和增强的质量/传热微流体的分批模式导致减少了12倍的平衡时间。此外,研究者准备一个由528个成员组成的更大的DCL来评估这种方法的通用性。有趣的是,当HRMS分析批量制备的DCL时,发现棕榈酸乙酯42是作为BSA的唯一粘合剂,而微流控平台发现了十八酸乙酯43。通过荧光测定,确认了十八酸乙酯43的结合。结果观察到,十八酸乙酯43和棕榈酸乙酯42的结合常数KD分别为4.95和5.21×104 L mol-1时,BSA的固有荧光在浓度依赖性的猝灭(280 nm激发和348 nm荧光发射)。最后,用Stern Volmer动态猝灭法对不同温度下十八酸乙酯43与牛血清白蛋白的结合进行定量分析,结果证实只有一个结合位点参与了复杂的十八酸乙酯牛血清白蛋白的形成。
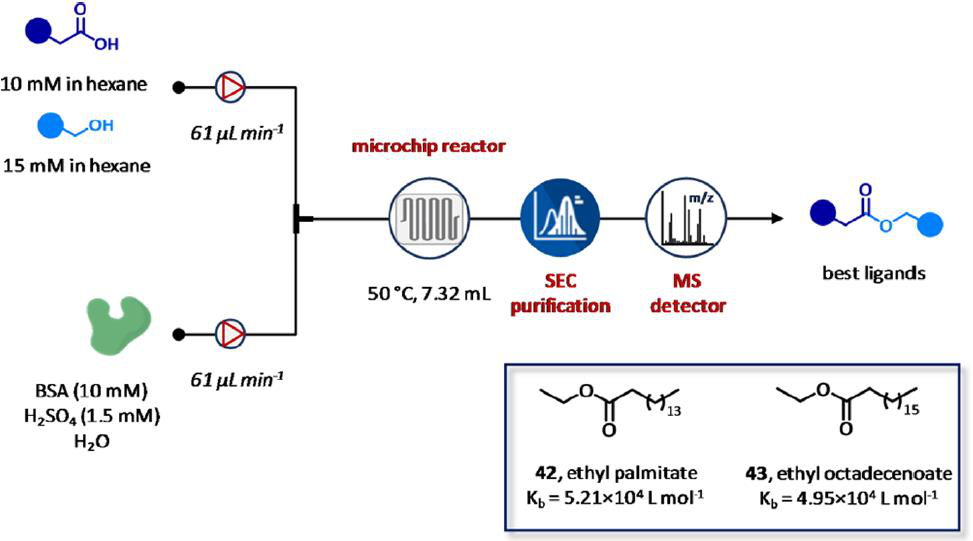
图25 用于蛋白质结合物的合成和鉴定的集成流平台。
展望与结论
科学和技术的进步,如合成机器、活性预测模型和自动化筛选设备,可以极大地革新药物发现,特别是在早期阶段,为学术界和制药公司验证创新方法及其转化潜力提供了肥沃的土壤。从手工化学到自动化合成器以及它们与分子设计的结合,PAT和在线测试引领了药物发现的一个全新时代,从而加速从靶点到上市药物的旅程。然而,重要的是不要重复过去高估技术潜力的错误,而是要批判性地分析当前最先进技术的优缺点。虽然化学库的自动生成以及通过适应学习周期对有前途的先导物进行系统优化在很大程度上可以被认为是既成事实,但实现用于化合物设计、合成、分析和数据分析的完整集成平台仍然具有挑战性,与实验室常规工作距离很远。
在这种不断演变的情况下,学术界必须重组教育和研究,以缩小基础科学、转化研究和药物开发之间的巨大差距,同时提高学术界和产业界之间的合作质量,最终必然推动创新。坚信,只有通过学术界和制药公司、金融机构和政府机构之间强强合作,才能应对未来的挑战,并对化学科学、药物发现研究、最终对人类健康产生深远影响。
参考文献:
Antimo Gioiello, Alessandro Piccinno, Anna Maria Lozza, and Bruno Cerra. The Medicinal Chemistry in the Era of Machines and Automation: Recent Advances in Continuous Flow Technology. J. Med. Chem. 2020 63(13), 6624-6647. DOI: 10.1021/acs.jmedchem.9b01956