
引言
2010年至2019年间,美国食品和药物管理局 (FDA) 共批准了378种新药和27种生物仿制药,本文根据批准编号、治疗领域、模式、给药途径、first-in-class、批准时间和快速审查等类别进行了评估。肿瘤仍然是最主要的治疗领域 (25%) ,其次是感染 (15%) 和中枢神经系统疾病 (11%) 。监管方面的激励措施是十分有效的,罕见病药物以及抗菌药物的增加就证明了这一点。可能是由于罕见病药物适应症的增加,所以临床研发时间在增加。小分子仍然主要遵循“类药5法则” (Ro5) 的参数,但随着反义寡核苷酸 (ASO) 、小干扰RNA (siRNAs) 和抗体药物偶联物 (adc) 的批准,新药的创新进展迅速。
2010−2019药物研发数目
从2010年到2019年,如图1,FDA共批准了289个NME、89个生物许可证申请 (BLA) 和27个生物仿制药 (Biosimilar) 。在过去十年中,每年NME和BLA批准的中位数为40个,2010年最低为21个,2018年最高为59个。从2000年到2009年的十年中,每年批准25种药物,2004年最高,为36种,2007年最低,为18种。过去十年中,BLA获批的比例没有变化,占所有新药平均批准的23% (不包括生物仿制药) 。2013年批准的BLA比例最低为8%,而2015年为32%。生物仿制药的批准数量稳步增加。
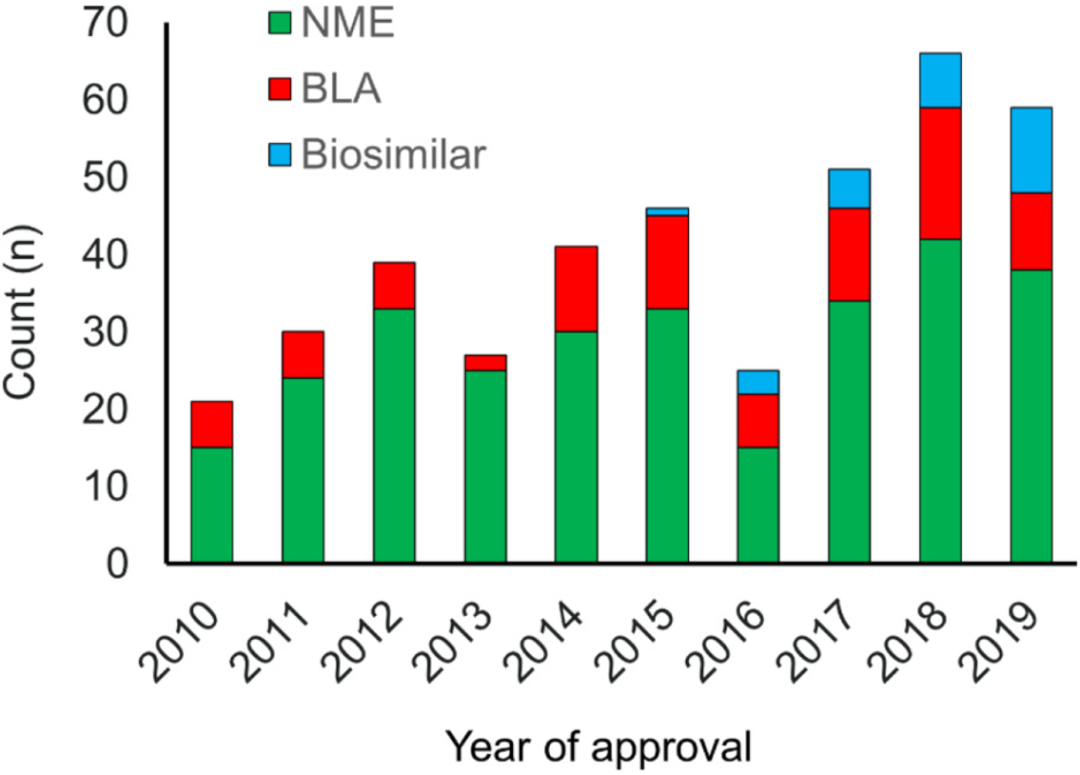
图1. 过去十年FDA批准的药物(2010-2019)
图片来源于JMC
药物市场
根据总销售额,对2017年和2018年548种最畅销药物进行了分析,销售额四舍五入至百万。图2显示了本次分析中生物制剂 (biologics) 与新分子实体药物 (NMEs) 的数量,显示了其总销售额,生物制剂的销售额比NMES的高。生物制剂的年平均销售额为18.4亿美元,而NMEs的年平均销售额为8.5亿美元。生物制品的销售主要是由10种产品推动的,这些产品总共创造了770亿美元的销售额,几乎占图2a所示生物制品销售总额的一半。在这10种产品中,有3种药物在2010-2019年的被批准 (aflibercept、nivolumab、ustekinumab) 。对2019年销量的预测显示,两种抗PD-1单克隆抗体药物pembrolizumab (2014年获批) 和nivolimumab (2014年获批) 可能进入销量的top 10中。
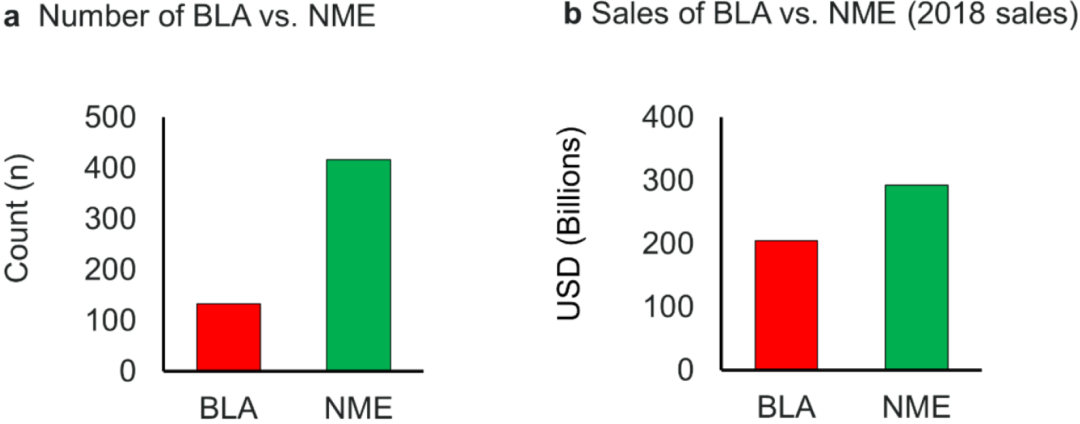
图2. 2017年和2018年最畅销的548种药物以及它们在2018年的销售额
图片来源于JMC
图3和表1是2018年间的销售额超过1700亿美元的药物。平均来说,30%的销售额来自罕见病药物。其中,2013年和2014年比较有代表性,这些年份批准的罕见药占2018年的销售额中的50%以上 (例如2013年批准伊布替尼用于肿瘤治疗,2018年销售额为62亿美元,2014年批准nivolumab用于肿瘤治疗,2018年销售额为75亿美元,2014年批准pembrolizumab用于肿瘤治疗,2018年销售额为71亿美元) 。
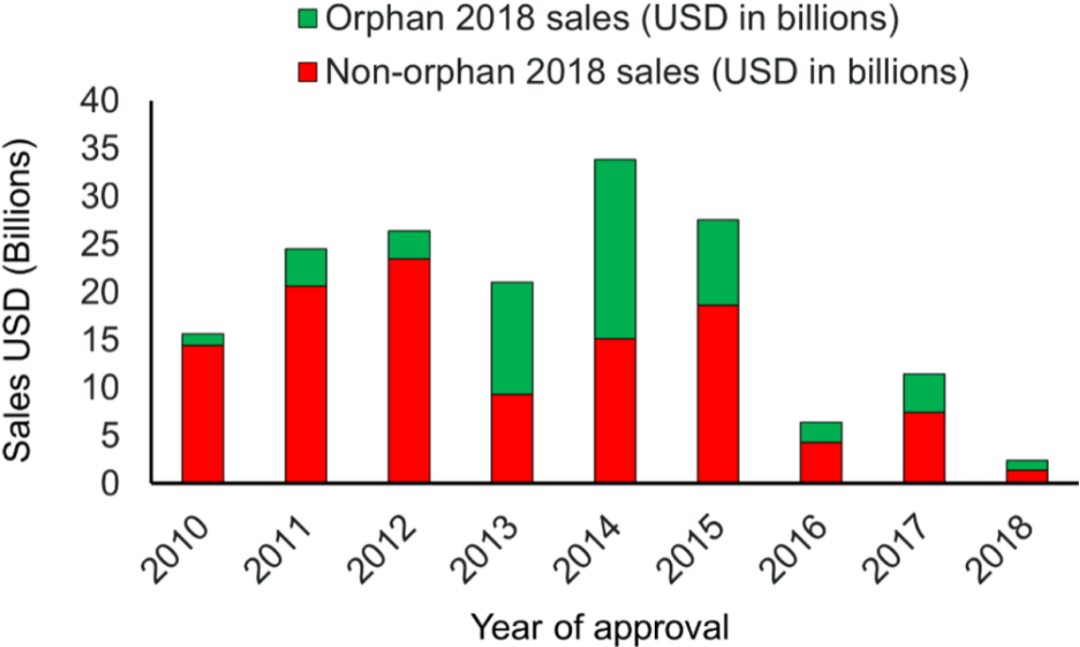
图3. 罕见药与非罕见药在2018年的销售额
图片来源于JMC
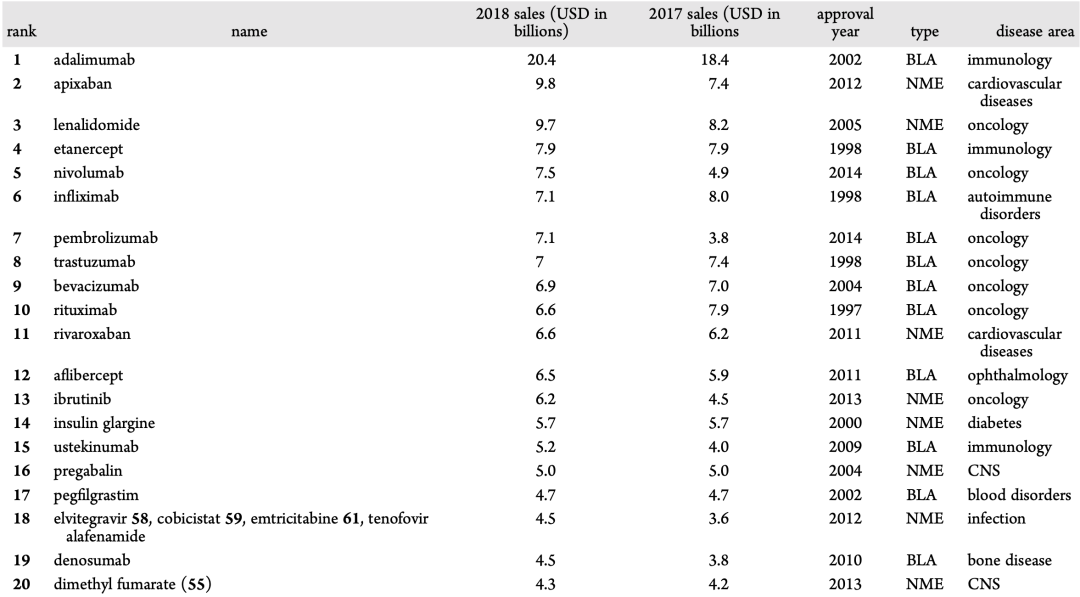
表1. 2018年最畅销的药物
表格来源于JMC
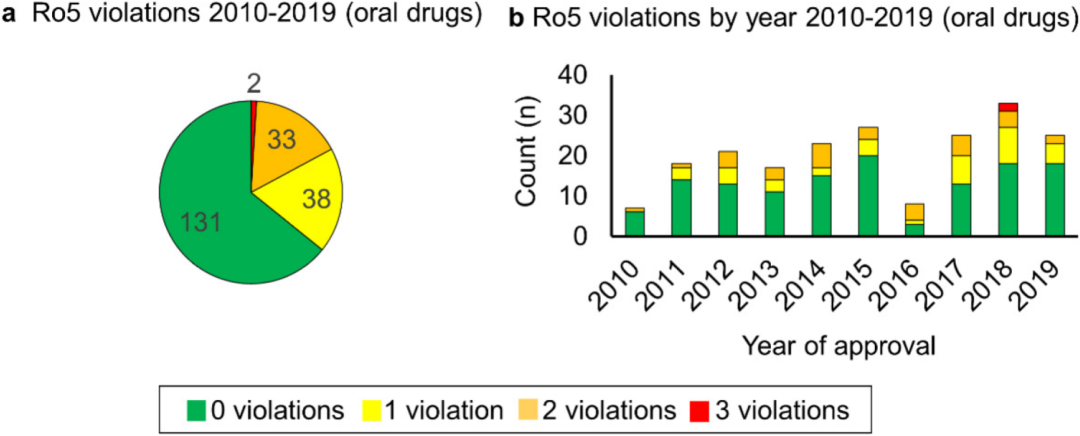
图4. 2010-2019年新批准的小分子药物的物理化学特征 (类药五原则)
图片来源于JMC
新批准的小分子药物
本文阐释了在2010-2019年新批准的小分子药物中的物理化学特征 (图4) ,特别是口服药物,根据类药五原则进行分析。五规则如下:(1) 分子中的氢键供体(HBD)不超过5个;(2) 分子中的氢键受体(HBA)不超过10个;(3) 分子量(MW)小于500;(4) cLogP < 5.1;(5) 可旋转键的数量不超过10个。如果口服药物仅仅违反这五个规则中的一个,则仍然称其符合五原则。本文检查了2010年至2019年批准的药物。在Lipinksi等人2001年发表的原始论文中,约90%的已知口服药物符合五原则的标准。共有204种小分子口服药物用于评估。分析中只有17% (35/204) 的药物违反了一项以上的指导原则,而83% (169/204) 的药物符合五原则或仅仅违反一项指导原则。此外,在2010年至2019年的十年间,违规超过1次的经批准口服药物的数量并未随时间发生显著变化。而在违反原则中,大多数 (62/73) 是MW,其次是clogP (18/73),然后是氢键受体 (13/73) 违规。这一数据与最近的一份出版物一致,该出版物指出,高分子量是一种可以容忍的物理性质,同时也可以看到过去十年中批准了许多高分子量口服药物。
总结
2018年获得批准的标志性年份以及FIC药物的稳步推出表明,预计将在本十年发生的创新和生产力危机并未实现。200相反,2010年至2019年NME和BLA批准的中位数比前十年增加了60%。制药行业的生产力增加可能与监管方面激励措施有关,如突破性治疗、快速通道,罕见病药物,以及GAIN法案,这些法案通过了很大一部分新药。此外,美国国立卫生研究院在基础神经科学研究方面增加的投资与中枢神经系统创业投资的增加有关。以FIC批准量作为衡量,2010年至2019年,创新药物占所有药品批准量的37%,高于2009年的17%。在未来十年的药物发现和开发中,该行业将面临新的挑战。临床试验设计可能会更加复杂,导致更长和更昂贵的药物研发时间。使用诊断来预测正确的患者群体对于减少昂贵或长期临床试验的费用来说将变得越来越重要。最后,新的药物和诊断必须是患者负担得起的,可以获得的。过去十年的成功给整个行业带来了希望,同时,整个行业也将应对这些挑战,继续为患者提供新药。
参考文献
Dean G. Brown and Heike J. Wobst, A Decade of FDA-Approved Drugs (2010-2019): Trends and Future Directions, J. Med. Chem., 2021, 64, 5, 2312-2338. DOI: 10.1021/acs.jmedchem.0c01516.