引言
瑞士罗氏创新中心Jitao David Zhang等人在Drug Discovery Today综述了基于分子、细胞、器官级别的多尺度建模在药物机制和安全性研究中的应用以及在临床前药物发现中的意义。

背景
通常,在药物对人体进行测试之前需要进行临床前的药物设计,以此保证对药物机理,作用机制等有明确的把握。药物临床设计不仅满足了对新型药物的好奇心,而且丰富了我们的生物学知识,此外在指导分子优化,实现了针对性的疗法药物组合和揭示了意外的疾病靶标中都有重要意义。对药物机制和安全性的研究不局限于目标识别和描述其作用机理,因此需要对药物机制进行系统,多尺度的研究,扩大目标和MOA鉴定的范围。药物安全性的理论研究至关重要。计算机模拟和数学建模的出现为药物机理和安全性的研究提供便捷。自1970年代以来,出现了计算方法,一方面进行了体外和体内测定,另一方面进行了计算机模拟和数学建模。根据研究规模。临床前药物发现的数学和计算模型可分为三个级别,各有优缺点,要了解分子的机理和安全性,任何单一水平的模型都不能满足要求。因此需要采用多尺度建模方法。
(i)分子水平建模,使用理化原理以及分子建模和模拟技术对分子结构和分子之间的相互作用进行建模;
(ii)细胞和组学水平的建模,它使用高通量技术以及生物信息学和统计分析来探测细胞中特定种类的所有分子,它们的空间组织以及细胞形态;
(iii)器官和系统级别的建模,该模型检查药物和身体如何相互作用以及随着时间的推移相互影响。
我们可以分两步实施多尺度建模。多尺度建模的结果在单个级别上以及在不同级别上的集成都具有影响力。多尺度建模需要知识和数据才能蓬勃发展,有助于临床前药物发现。
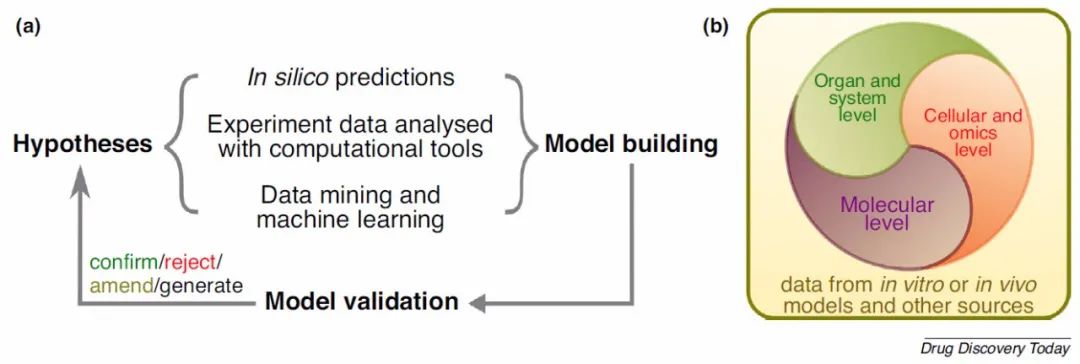
图1 多尺度建模步骤
图片来源 Drug Discovery Today
(a)可以将药物发现程序建模为以下假设的迭代过程:假设产生、模型构建、模型验证以及确认、拒绝或修改假设、产生新的假设以供进一步检验。计算方法可以单独进行预测,分析实验数据以及挖掘现有数据并确定模式以建立模型。
(b)在分子、细胞和组学以及器官和系统水平建立模型。不同规模的模型可以相互交流和受益。数据生成,管理,解释和集成对于通过多尺度建模表征药物机制和安全性同样重要。
在三个层面上对临床前药物机制和安全性进行建模
01
分子水平建模
药物通过与包括DNA,RNA,蛋白质等在内的分子靶标相互作用来发挥作用。因为蛋白质构成了大多数的功效靶标,尽管许多蛋白质的治疗潜力仍有待探索,但DNA和RNA(包括表观遗传修饰)(作为分子生物学的中心教条模型的其他两个组成部分)正越来越多的作为首选体系。我们以药物-蛋白质相互作用为例来说明分子水平建模的原理。当我们设计新药或改进现有药物时,我们需要定制分子以使其与所需靶蛋白具有强相互作用,而与任何不需要的靶蛋白具有最大弱相互作用。相互作用的强度在很大程度上取决于药物及其蛋白质结合位点的形状和静电互补性,这是著名的E. Fischer提出的锁钥原理。
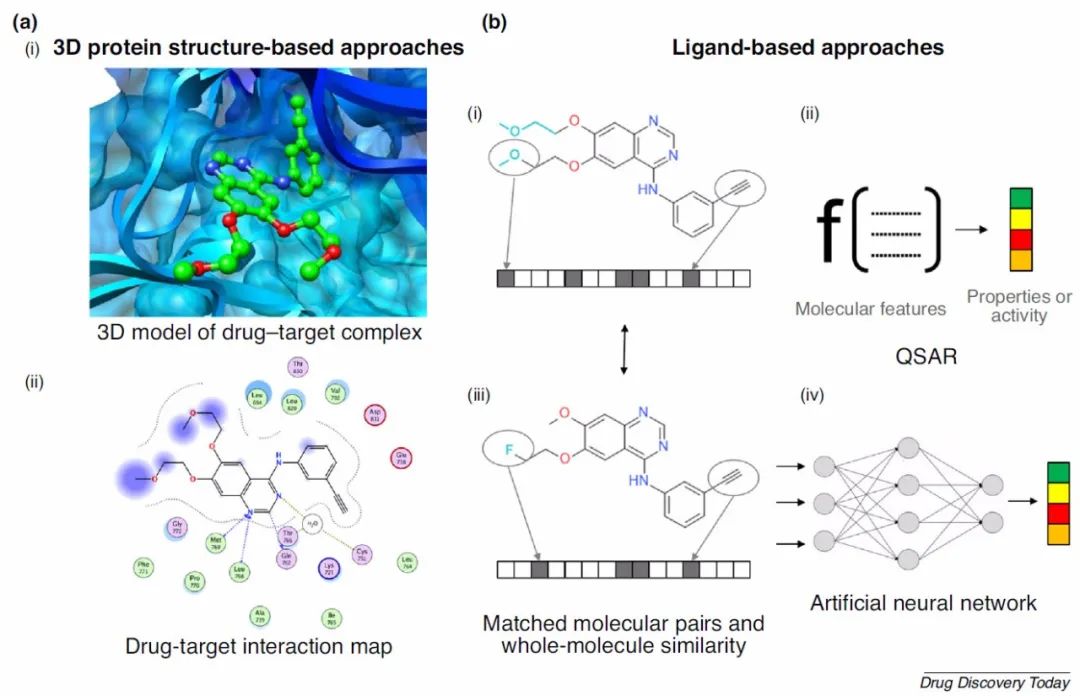
图2.分子建模技术
图片来源 Drug Discovery Today
基于结构的分子建模-3D同源建模
建立分子-靶标相互作用的模型需要一些结构信息。当前,X射线晶体学是3D蛋白质结构数据的主要实验来源,目前在蛋白质数据库(PDB)中可获得超过15万种蛋白质结构。在过去的几年中,冷冻电子显微镜已经成为一种替代技术,可以提供蛋白质的原子分辨率结构,尤其是较大的蛋白质聚集体和膜蛋白。G蛋白偶联受体(GPCR)和离子通道的许多结构已得到解决,为这些跨膜蛋白靶标提供了基于结构的药物设计的可能性。尽管仍然有几种未知的3D蛋白质结构的药物靶标,但这种差距正在缩小。在没有3D结构可用的情况下,如果已知相关蛋白质的结构,则可以采用同源模建,例如使用SWISS-MODEL之类的工具。如果不知道任何相关氨基酸序列的3D结构,则可以使用从头蛋白质结构预测方法。通过定期的蛋白质结构预测关键评估(CASP)评估,该领域正在稳步发展,并且已经取得了可喜的进展,例如基于神经网络的方法。利用可用于蛋白质靶标的3D模型,可以生成药物蛋白质复合物的模型。在小分子药物的情况下,可以使用自动对接程序或手动建模或其组合来完成。通过原子力场,相互作用频率统计或其他经验公式的对接得分来评估模型的质量。最近,引入了基于机器学习的评分功能,这一功能可能有一天会超过经典评分功能。建立模型通常需要一个过程,蛋白质靶标保持刚性,配体被松弛并适应结合位点,以节省计算资源。在进一步的改进步骤中,可以通过分子动力学或其他方法使候选模型的能量最小化,以实现更好的拟合。在实验中,蛋白质-配体的结合通常在室温下进行,蛋白质和配体都是灵活的。这可以在分子动力学模拟中进行模拟。分子动力学模拟还可以用于测试建模的蛋白质-配体复合物是否稳定。在过去的几年中,由于先进的原子力场简化了物理模型,模拟得到了极大的改进。对基础物理建模的进一步改进,包括更长的模拟时间范围,将会在药物设计中有更广泛的应用。3D蛋白质-配体相互作用模型用于了解使复合物稳定的原子相互作用,并估计化合物的结合能。此外还可以用于开发策略,以解决分子脱靶情况下修饰分子以优化相互作用或消除相互作用的问题。如果3D模型通过晶体结构验证,则可会有更广泛的应用,尤因为化合物结合会诱导构象变化,而这种变化在模型中是看不到的。验证的重要标准是:(i)3D模型是否可以解释先前观察到的实验结构-活性关系(SAR);(ii)它们是否至少能够富集一组化合物中已知与靶标结合的化合物。
基于配体的分子建模
药物设计中使用的另一类重要模型是基于配体的模型。是简单的匹配分子对模型,其中分子转化与分子性质的变化有关。在整个分子水平上,整个化学结构可以用二维或三维特征集或描述符来表示,然后根据“相似性”原理对所得表示进行分析,以推断出有利的分子特性。如今,机器学习算法的最新进展对传统的建模化合物之间的关系并将其性质与化学结构相关联的方式进行了补充,甚至部分地取代了传统方法。已经生成了复杂的QSAR或药效团模型,其中使用了大量的计算后分子特性来训练机器学习模型,深度神经网络或模型集合,将描述符与实验测量值相关联。与3D蛋白质-配体模型相比,用统计模型进行外推需要谨慎,因为感兴趣的分子及其特性可能无法在训练集中很好地表示出来。但是,与3D模型相比,它们具有多个优势,因为它们计算速度快,可以通过更多的实验训练数据进行系统地改进,并且会对其预测的可靠性进行统计估计。
分子水平模型在药物设计和发现中的应用
在实际的药物设计环境中,两种类型的模型都有不同的应用。3D模型用于优化化合物,以实现与靶标结合。它们主要用于潜在配体识别和潜在配体优化活动中已知结构的化学修饰。统计模型通常用于预测(虚拟)候选化合物的理化性质和吸收,分布,代谢和排泄(ADME)性质。许多理化性质预测的质量通常足以满足要求,因此仅偶尔需要对这些性质进行实验以抽查和改进特定化合物类的模型。ADME预测通常会跟进实验,但是这些模型也可以独立使用,以在其他有前途的合成化合物中确定优先顺序。在药物研发的早期阶段,当需要购买外部化合物并选择化合物类别以进行进一步开发时,因为无法获得实验数据或通常稀疏而无法对化合物类别进行排名,模型更为重要。一种特殊情况是脱靶预测。寻找导致特定毒性并最终产生不良影响的脱靶靶点可能是一项艰巨的任务。据报道,在一些案例中,统计QSAR类型模型有助于识别给定化合物类别的脱靶靶点。尽管对靶点的预测只是粗略的,但是这些预测足以确定许多潜在的脱靶靶点的优先次序,然后可以通过实验进行后续跟踪。还可以利用预测的脱靶的知识来进行药物再利用,其中配体与预测靶点之间的目前未知的相互作用被用于已知化合物的新型治疗用途。基于配体相似性的方法以及配体和3D蛋白质建模的组合已成功应用于预测无法预料的靶点并确定现有药物的再利用机会,但仍然具有挑战性。预测的药物-靶标相互作用的新兴应用是化学探针的选择和应用,以了解表型疾病模型中的分子机制。在分子MOA,脱靶谱和安全性方面具有良好特征的化合物可用于分析分子引起的表型的预期变化,并对其注释目标进行分析,并通过组学实验进行分析。系统的计算机网络分析技术用来推断可能是观察表型的原因的分子目标。这些目标假设可用于集中精力进行生化目标验证实验,这种方法可以帮助将表型药物发现项目转变为基于目标的药物发现项目,其好处是使分子水平的建模方法适用,从而加速药物发现计划。尽管较早的讨论集中在小分子上,但是分子建模对于其他方式也是必不可少的。没有对SAR的详细理解或没有新的MOA的创新设计,抗体的成功将难以想象。反义寡核苷酸(ASO)是分子建模的另一个受益者。鉴于ASO通过互补序列匹配介导的DNA / RNA相互作用发挥其功能,通过整合生物学序列分析,RNA结构和理化模型来模拟靶标结合亲和力和脱靶潜能是可行的。总而言之,分子建模具有重要作用,尤其是在潜在配体识别和优化过程中。该过程可能是耗时且繁琐的,成功需要很多年才能找到一个好的候选分子。计算模型可用于减少必须合成的化合物数量,从而使整个过程更省时,更具成本效益。
02
细胞和组学水平的建模
细胞是体现药物作用机理的最小生命单位。Omics技术对一个或多个细胞中的一种类型的所有分子(例如DNA、RNA、蛋白质或代谢产物)进行定量和表征。诸如高含量显微镜的成像技术可捕获微扰后细胞的形态变化,以及带有标记分子或替代标记(例如底物或生化反应产物)的选定基因的表达变化。作为这些技术的补充,功能基因组学工具以及其他方法包括化学诱变,RNA干扰(RNAi),过表达和CRISPR Cas9功能丧失和功能获得筛选,提供了操作thr活动和单个基因功能的方法。新型细胞模型用于疾病和安全性建模,包括诱导性多能干细胞和微生理系统,例如单片器官和类器官。总之,技术和生物学工具可提供大量数据,这些数据使计算工具能够表征细胞和组学水平上的药物机制和安全性。进行和分析比较实验是建立细胞和组学水平模型的关键。鉴于组学和成像数据的高维度,大容量和嘈杂的性质,有必要使用适当的统计模型来推断差异,并结合生物学系统的先验知识来推断分子的机理和安全性概况。
用组学数据建模
组学方法是现代药物发现必不可少的。他们将高通量生物物理和生化分析与统计建模,数据挖掘,网络分析和机器学习相结合,以全面了解药物候选者在基因,通路和网络水平上的调控。值得注意的是,组学数据和模型在分子水平的建模与器官系统水平和种群的建模之间建立了必不可少的联系。它们可以表征人群中的分子变异,例如单核苷酸多态性(SNP)和其他结构变异,表达水平和剪接同工型,这些信息可以告知药物靶标和可能影响PK/PD分布的其他基因的状态。基于RNA测序的基因表达谱分析是目前了解药物机理最广泛使用的组学技术,这是根据公共数据存储库中的统计数据判断的。我们对基因调控网络的知识,尤其是它们如何随细胞身份和环境而变化的知识很少。这些网络本质上是复杂的。从基因表达数据中明确地恢复直接结合靶标具有挑战性。然而,基因表达可以为化合物的机理和安全性提供有价值的见解,并且可以揭示相同表型的共同机制和不同机制。RNA测序(RNA-seq)提供了比基因表达更多的信息。尽管仍处于早期阶段,但是单细胞技术极大地扩展了我们了解药物扰动如何影响单个细胞及其之间通讯的能力。除转录水平外,蛋白质组学还表征了体外或体内蛋白质的表达或翻译后修饰。对于允许化学修饰的小分子,化学蛋白质组学使用“诱饵和猎物”原理确定修饰药物候选物的结合靶标。也可以使用无修饰的方法,例如基于抗体的细胞热位移分析(CETSA)和基于质谱的变体。与设备和软件解决方案都更加标准化的RNA-seq相比,蛋白质组学的数据生成和分析前景曾经是零散的。最近,一些社区举措已经标准化了统计分析策略并建立了最佳实践流程。
影像学
成像是组学的姊妹技术,用于研究候选药物的细胞效应。它使用光学系统和计算机视觉技术来分析细胞形态。新兴的无光学分子成像系统,例如NMR,正电子发射断层扫描(PET)和DNA显微镜,有望揭示感兴趣的生物分子的空间组织。计算方法对于成像是必不可少的,因为庞大的数据量无法进行人工分析,并且图像分析的设置和分析流程会相互影响。具有自动图像分析功能的病理学全幻灯片成像是链接细胞和器官水平信息的重要应用。细胞成像还可用于根据候选药物MOA对候选药物进行聚类。这与抗菌药物发现特别相关,因为形态的变化可以与杀死细菌的MOA相一致。据报道,对带有目标信息的化合物文库进行分析时,高内涵成像能够预测生物活性,即从表型向目标反向转化,如果可以推广的话,可用于鉴定表征较差的化合物的靶点谱。
细胞学组学及各种模型结合
将不同的细胞学和组学学科结合起来,并用各种模型(包括分子水平和器官水平以及系统水平的模型)进行补充,会使人们对生物学过程有科学的了解。人体数据是高维生物空间的投影。中心图说明了大肠杆菌中精氨酸生物合成的稳态。眼睛表明了组学研究的不同观点。高通量技术以1H核磁共振(NMR),质谱和RNA测序为例,如左图所示,可检查细胞系统中所有特定种类的分子。它们分别生成右侧所示的代谢组(所有代谢物),蛋白质组(所有蛋白质)和转录组(所有RNA)的数据。这些数据尽管具有高维性,但却是高维生物空间的低维投影。相同的原理也适用于细胞成像数据。其中中心图描述了大肠杆菌中精氨酸生物合成的稳态。精氨酸是鸟氨酸转氨甲酰酶(OTCase)催化的最终生物合成步骤,它与转录阻遏物结合,并变构触发其与OTCase和阻遏物基因中的启动子元件结合。当缺乏精氨酸时,阻遏作用得到缓解,OTCase可以产生新的精氨酸。阻遏物基因的低水平组成型表达可确保一旦阻遏物的水平超过一定阈值,阻遏物可再次与精氨酸结合。围绕图3中中心图的三个投影分别表示系统的代谢组学,蛋白质组学和转录组学视图。如图所示,它们是通过高通量技术生成的,即NMR,质谱和RNA-seq。
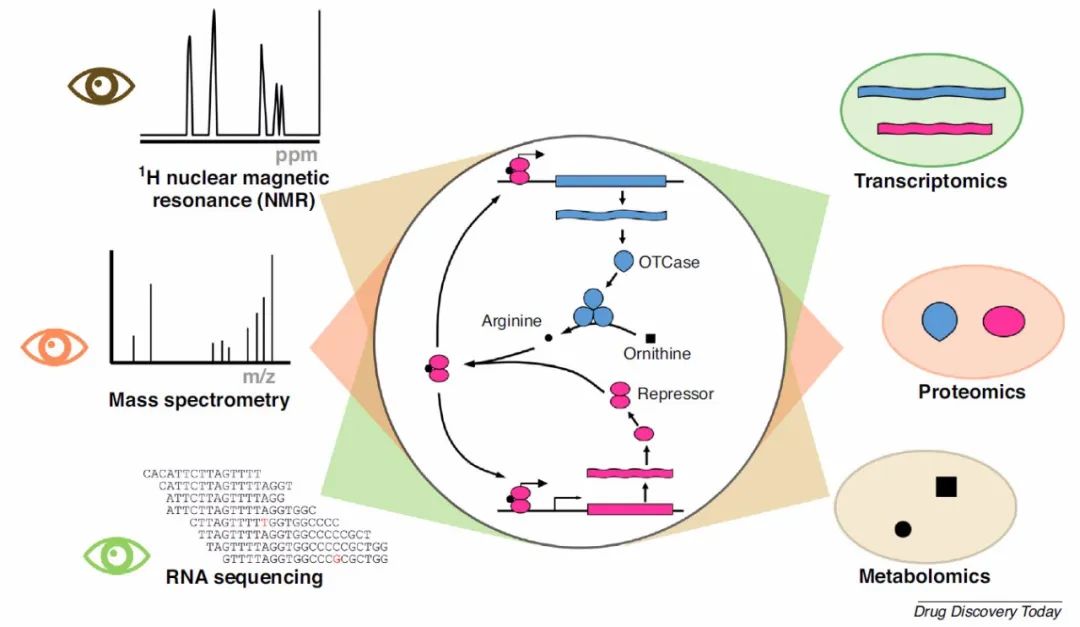
图3 模型结合观点
图片来源 Drug Discovery Today
基于在各种条件下对系统的重复测量,对于三种组学学科中的任何一种,在分析物数量上都可以建立正相关(鸟氨酸和精氨酸)和负相关(阻遏物和OTCase)。但是,仅凭它们中的任何一个都不可能对这种简单的网络有全面的了解。因此,基于这个例子和其他观察结果,我们呼吁在使用无模型方法研究药物机理和安全性时要谨慎。因此,要真正地理解网络,下一步就是建立一个机械模型,例如图3中的简单模型,并使用它来分析其反馈回路,稳态和参数空间。这样的分析不仅可以确定稳定状态或稳态环,而且可以预测突变体的作用,例如对精氨酸的亲和力降低的阻遏物突变体,或缺乏阻遏物结合位点的启动子突变体。最后便是生物过程的动力学参数,使用微分方程描述系统,并模拟所有相关组件的完全集成的动力学模型。这样的模型的可用性将为在计算机模拟实验中进行真正的运行以及计算预测实验中从未观察到的扰动的影响提供可能性。与原核生物相比,人类和真核生物的复杂性不断提高,使得使用组学数据进行网络推断成为一项艰巨的任务。结合分子,细胞和组学数据的疾病生物学和药物安全性的预测模型将大大提高我们确定目标优先级以及了解药物机制和安全性的能力,可以将此类模型集成到较大的器官和系统级别的模型中。
03
器官和系统级建模
药代动力学(PK)以及药效学(PD),药物的生化和生理作用共同决定了药物的功效和安全性。机械或半机械数学模型是量化候选药物的PK和PD分布的重要工具。这种模型在器官和全身水平上整合信息,以建立剂量,暴露(在血浆中,在靶位和离靶位测量)和反应(包括功效和不良反应)之间的关系。PK和PK/PD建模在药物发现中的应用包括:(i)对治疗窗口进行定量评估,从而告知“可以通过”的决定;(ii)整合和翻译临床前数据,以告知首批人为剂量;(iii)告知临床研究设计和药物标签;(iv)表征患者之间的差异,并告知亚人群的最佳剂量;(iv)外推到特殊的子群体,例如儿科人口。尽管经验模型已在PK和PK / PD建模中广泛且频繁地使用,但在此我们重点关注基于生理或机制的详细模型,其中将人体生理学和病理生理学描述为化合物与之相互作用的基础系统。这些模型本质上是多尺度的。在分子水平上,他们可以描述亚细胞过程,例如酶反应,离子通道动力学,转运蛋白活性和亚细胞信号传导过程。在细胞水平上,他们可以模拟增殖和凋亡以及细胞间相互作用等过程。在上一级,他们可以对器官和系统级过程,实例,全心电生理活动和ADME涉及的过程进行建模。最后,基于生理或机制的详细模型可以表征人群中的个体变异性。生理和或病理生理系统的建模是基于我们对基础生物学的理解。通过机械数据(例如细胞增殖率,受体表达水平或离子通道电生理学)对模型进行参数化。在生物学尚未很好理解且数据稀缺的地区,需要经验或半力学方法。否则,如果对生物学进行了充分研究,并且可以从人类和临床前物种获得数据,则这些模型可以定量捕获种间差异,并可以作为在临床前发现与临床开发之间转化的强大工具。如果观察数据证实了模型预测,将验证对药物的假设。否则,如果数据与模型预测相矛盾,将修改模型,从而获得新的见解。为了模拟药物对系统的作用,这些模型整合了特定于化合物的机制数据,例如ADME特性以及目标或靶外相互作用数据,以预测不同剂量方案下的PK,安全终点或功效生物标志物。可以对相同或相似的模型结构进行参数设置,以研究不同生理系统(例如临床前物种,健康成年人以及儿科或患者亚人群)中的相同过程或机制。从数学上讲,这些模型通常是常微分方程(ODE)系统,用于描述随时间变化的变量,例如,时程中的药物浓度或每个时间点的肿瘤细胞数量。也偶尔使用偏微分方程(PDE),随机微分方程和基于主体的模型。为了突出这些模型如何帮助药物机理和安全性理解,我们在这里集中在两个方面:基于生理的PK(PBPK)模型和用于安全性的系统模型,以心脏安全模型为例。
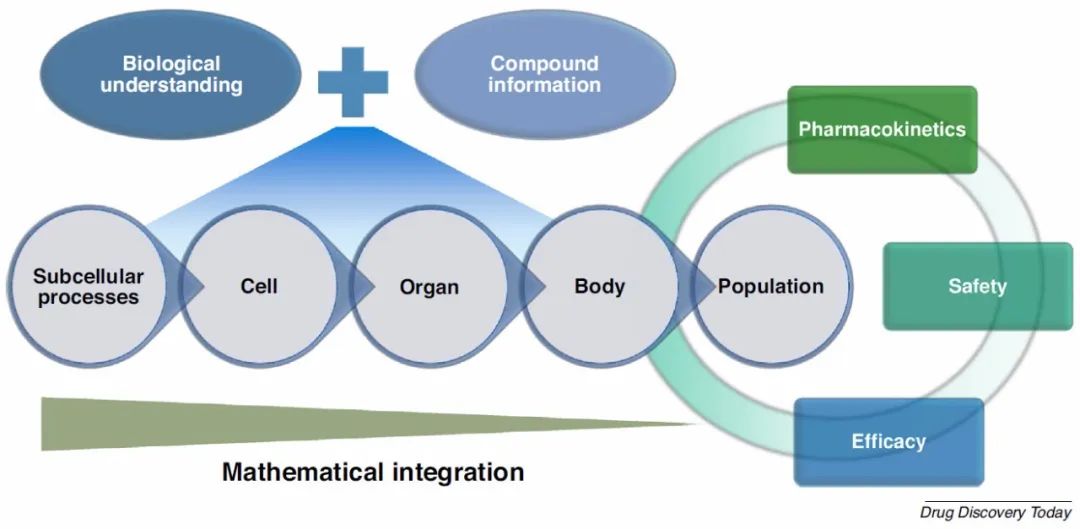
图4.生理系统模型示意图
图片来源 Drug Discovery Today
PBPK模型
药物的PK曲线由具有一阶动力学的区室模型建模。这种模型中的隔室不一定具有生理意义。PBPK模型包括代表器官或组织(例如,肝,心脏,脑等)的隔室,并且这些隔室通过血液或淋巴流连接。该模型通常是耦合的ODE的系统,包含生理参数,例如肠液量,肠pH,血液流速,器官/组织量以及转运蛋白和代谢酶表达水平。可以调整这些系统参数以反映不同的生理状况。例如,可以调整人口统计参数和代谢酶丰度参数以建立具有特定种族和遗传背景的虚拟患者队列。该模型使用药物特有的参数,例如溶解度,通透性,血浆蛋白结合,组织与血浆的分配系数,酶动力学和内在清除率,其中大部分由临床前机制研究确定。PBPK,尤其是小分子PBPK,是最成熟的系统模型之一,在制药行业产生了包括监管在内的重大影响。在2008年至2017年之间,FDA的临床药理学办公室收到了130项包含PBPK建模的新药(IND)申请和94项新药申请(NDA)的调查,不包括从头进行的PBPK分析,该分析为30项呈件提供了监管决定。截至2015年底,欧洲药品管理局(EMA)总共收到了67份PBPK模型提交文件,其中20份是监管机构建议的。在2014年至2016年期间,日本制药和医疗器械局(PMDA)收到了17份NDA中的PBPK分析报告。PBPK监管应用的主要领域包括但不限于预测由P450酶或转运蛋白介导的药物相互作用(DDI),预测小儿暴露以指导给药方案,预测器官患者的暴露损害和对食物影响的预测。
安全系统模型
系统模型提供了一种综合的方法,将机械化的临床前安全性数据与PK和患者特定特征相结合。他们可以定量评估不同人群中不同剂量方案下的安全责任,并确定责任背后的机制,这可能为复合优化提供见解。心脏安全模型是一些最先进的系统安全模型,这些模型在数学上从多个层面描述了心脏电生理。在细胞水平上,对心脏离子通道的打开,关闭和失活,离子泵和交换器的活动,细胞内钙离子的处理以及循环跨膜电位的变化进行了建模。在组织和或器官水平,对心肌细胞之间的电耦合和通过心脏传播的电信号都进行了建模。在全身水平上,对传播到躯干表面的电信号进行建模,从而对心电图信号进行建模。细胞电生理学建模为耦合ODE,器官和/或躯干模型由双域模型,PDE模型和细胞ODE模型控制。与PBPK模型类似,心脏安全模型还需要一组系统参数,例如离子通道动力学(例如,不同状态之间的过渡速率),与其丰度相关的离子通道电导以及心脏和躯干解剖结构。这些模型整合了有关药物与不同离子通道相互作用的信息,例如可以从膜片钳实验的体外离子通道抑制数据中推断出这些信息,以预测对细胞动作电位,全心电信号或心电图(ECG)。这种预测的一个典型目的是评估候选药物的潜在节律性。心脏模型的安全性评估的发展和使用已在其他地方进行了综述。最近,由FDA领导的综合体外心律失常(CiPA)计划发表了一系列有关训练和验证模型的论文,该模型可预测尖端扭转性心律失常(一种罕见但可能致命的心律失常)的风险,证明了建立预测性心律失常的可行性心脏安全模型。除了指导化合物和剂量选择以最大程度降低心律失常风险外,这些模型还为临床心电图监测和药物标记(包括禁止的伴随用药)提供了强度。2018年11月,国际人用药品技术要求统一理事会(ICH)发布了概念文件。它表明,遵循PBPK模型的路径,心脏安全模型将很快成为监管环境中的另一种系统模型。此外,正在出现其他系统安全模型,例如那些预测药物性肝损伤的模型。尽管我们已经将重点放在安全应用系统模型上,但系统建模也已广泛用于定量描述疾病生物学。例如,由Clausznitzer等人构建的模型。描述了阿尔茨海默氏病(AD)患者大脑中的脂质失调。该模型预测,鞘氨醇-1-磷酸受体5(S1PR5)的激活可以逆转AD中的脂质失调,因此,S1PR5可以作为有希望的靶标。除了建立对目标的信心并揭示潜在的新目标外,这些模型还用于优化给药方案并将患者分为反应者和非反应者。
结论和展望
1.多尺度建模的概念已在许多不同领域提出。药物发现中,我们提出多尺度建模,作为在各个级别上建立数学模型(最好是机械模型)并将其集成的过程。我们相信,多尺度建模不仅会提高生产率并降低损耗率,而且还会对疾病生物学的研究及新疗法的发展提供更深刻和新颖的见解。尽管多尺度建模的短期目标是丰富分子知识,以获取信心或尽早停止,但关键的长期目标在于在疾病分子,疾病和药物学领域积累有关疾病生物学,药理学和毒理学的知识。
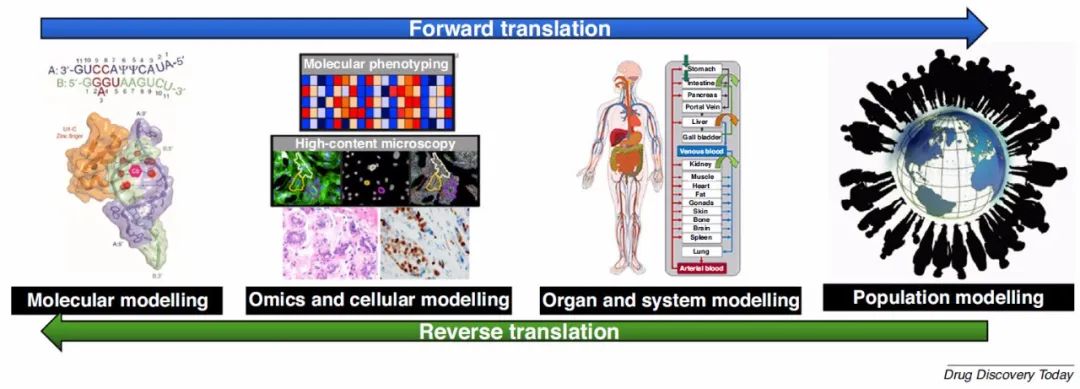
图5.多尺度建模具有服务于正向和反向平移的潜力
图片来源 Drug Discovery Today
2.多尺度建模作为计算引擎可在药物发现中进行正向和反向翻译。现代药物的发现既依赖于正向翻译,即将分子发现转化为药物的过程,也依赖于反向翻译,即将真实世界的证据和数据转化为催化未来疗法的知识的过程。多尺度建模通过对不同级别的生物系统进行建模并集成不同尺度的模型来支持这两个过程。逆向翻译是一种从临床试验以及其他现实世界证据中提取模式和构建模型以指导临床前发现项目的实践,是将人群模型和患者相关数据馈入多尺度建模方案的可行选择。
3.要了解药品的机制和安全性,是需要付出艰苦的努和创造性的工作,而且需要很长时间。 以乙酰水杨酸(Aspirin1)为例。它是在1897年至1899年之间首次合成和生产的。直到2019年,才报道了一种新机理,其中乙酰水杨酸直接乙酰化环状GMP-AMP合酶(cGAS)以防止DNA诱导的自身免疫。药物发现与机理与安全性了解之间的时间跨度可能长达数年甚至数十年,远远超出了临床前药物发现计划的通常时限。
4.在制药行业的多个层次和业务生命周期中,对药物机理和安全性进行机械理解所需的时间和精力之间的差异意味着需要新的研究方法。与之前提到的建立和应用多尺度建模的学科相反,药物发现和开发中的多尺度建模仍处于起步阶段。它的范围需要完善,其方法必须建立,其影响也需要仔细研究。超出此评论范围的关键开放式问题将作为答案。尽管存在许多问题和不确定性,但实施多尺度建模将导致对疾病生物学的深入了解,进而将其转化为有效且安全的方法药物。
参考文献
Multiscale modelling of drug mechanism and safety. Jitao David Zhang, Lisa Sach-Peltason, Christian Kramer, Ken Wang and Martin Ebeling. 2020. Drug Discovery Today Volume 25, Number 3. DOI: 10.1016/j.drudis.2019.12.009