摘要
伴随越来越多的双特异性抗体甚至是多特异性抗体进入临床,免疫原性日益成为双抗研发中必须解决的“阿克琉斯之踵”。本文系统总结了关于双抗(BsAb)的肿瘤免疫治疗的免疫原性风险评估(IGRA),此外,还总结了针对作为抗癌药物开发的特定BsAbs的抗药抗体(ADA)的临床相关性,以及在免疫原性预测、监控和缓解工具和方法上的进展。
01
前言
双抗赛道正蓬勃发展,被誉为“下一代抗体药物”。尽管有大量的双抗产品正在进入临床评估,但目前获批的双抗产品仅有四种(截至2022.3)。
与具有针对同一表位的两个结合区域的单特异性IgG不同,双抗由两个不同的结合域组成,能够与两个不同的抗原或同一抗原上的两个不同表位结合。与其他多靶点疗法不同(如联合疗法)双抗将不同的药理优化功能域结合成一种药物。
然而,将不同的功能结构域连接到一种药物中可以创造出与经典IgG不同的,具有高度工程化序列的新型支架。但这些形式可能会暴露隐蔽的表位或产生新的抗原,从而触发免疫原性。
此外双抗MOA多种机制的参与,也会促进产生免疫原性,如协同免疫调节机制(MOA),可能会破坏外周耐受性,导致药物产生非必要的免疫反应。
近期研究数据表明,免疫原性正是双抗开发中面临的关键挑战之一。
02
抗双抗药物抗体(ADA)肿瘤学临床意义
目前已在大量患者中对批准的单抗进行了免疫原性评估,但双抗相关却非常有限。
T细胞结合器(BITEs)是肿瘤治疗领域最常用的双抗。尽管B细胞耗尽剂(如CD19导向的双特异性T细胞结合子(BITE®))、CD20导向的T细胞结合分子Glofitamab、BCMA导向的T细胞结合子Elranatamab和Teclistamab) 显示出的ADA形成效应是有限的,这很可能是与产生抗体的B细胞消除有关。
但T细胞结合子靶向非B细胞肿瘤靶点时,还是能观察到显著的ADA效应。表1列出了肿瘤学中已批准的和正在研究的双抗的ADA发生率。
表1 双抗ADA发生率
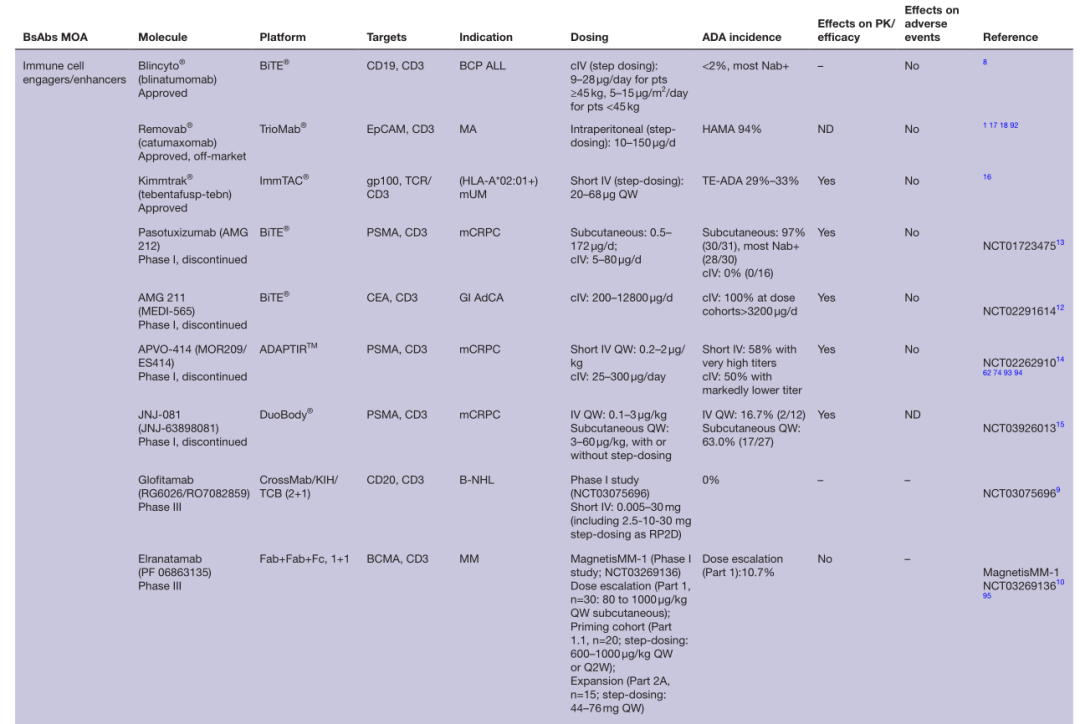
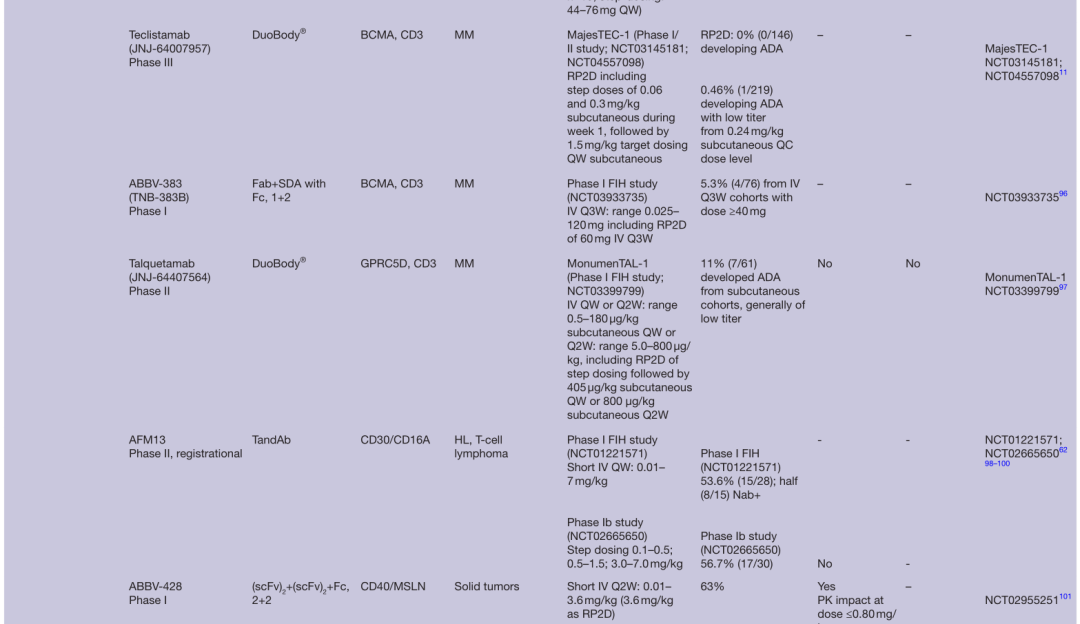
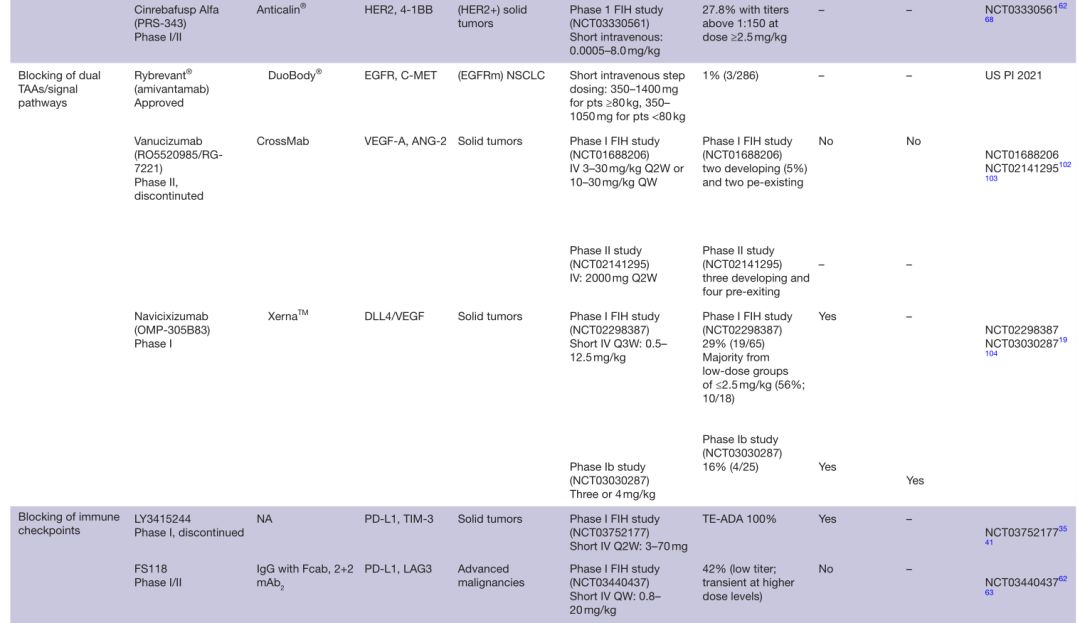
ADA发生率高低并不与临床效应完全对等,比如高免疫原性的Removab,ADA发生率可达94%,但仍有一定的治疗益处。而Navicixizumab是人源化的BsAb,虽然在Ib期研究(NCT03030287)中,25名患者中只有4名(16%)ADA阳性,但有3名患者的药物清除率和相关的输液反应增加。
多样的临床ADA结果进一步证明了BsAbs的临床免疫原性的不可预测性,因此,全面的免疫原性风险评估(IGRA)是所有进入临床双抗的当务之急。
03
双抗免疫原性风险评估需要考虑的因素
/// 产品相关因素
1.基于序列的风险和T细胞表位
双抗通常具有新的结构形式和序列。这可能会产生新的抗原或暴露隐蔽的表位,这些表位可能成为抗原或引发免疫反应。
如果分子包括与其内源性对应物具有序列或结构相似性的非mAb功能结构域(例如,细胞因子、激素) ,将有可能产生中和抗体(NAB),进而与内源性蛋白发生交叉反应,致使该蛋白质出现功能缺陷,影响临床效果。
目前,计算机算法和体外T细胞检测是评估序列、治疗蛋白分子在临床前发展过程中T细胞依赖的免疫原性风险的主要工具。
在计算机算法可以评估治疗蛋白的初级氨基酸序列与主要组织相容性复合体(MHC)II类结合的能力。评估完全基于分子的主要氨基酸序列,而没有考虑结构表位和可能引起免疫原性的多种其他因素,所以这种方法得到的结果和临床免疫原性并不对等。
基于T细胞的体外试验通过评估T细胞对治疗性蛋白的反应率和大小来评估基于序列的风险,其他体外工具包括DC内化分析、基于MHC相关的多肽蛋白质组学(MAPPS)分析等。体外试验的挑战源于难以概括ADA反应的全部广度,而ADA反应本身涉及体内的多种细胞类型。
一些新兴技术,如淋巴结系统和人源化小鼠模型,它们考虑了更广泛的免疫系统成分,因此可能更适合于免疫原性评估。但这些工具往往昂贵、耗时。
2. 预先存在的反应性
目前还未全面了解预先存在的反应性,其发生可能是由于存在可溶性靶点、基质效应或预先存在的抗体。据报道,针对基因治疗载体(例如腺相关病毒)、聚乙二醇化蛋白、糖链表位、选定的生物疗法(例如,重组细胞因子、生长因子),以及类风湿性关节炎(RA)和其他自身免疫性疾病的患者中预先存在的抗体的发生率很高。
预先存在的抗体的大小和表位特异性可能会影响临床上药物的治疗应急型ADA(TE-ADA)、药代动力学(PK)、药效学(PD)、有效性或安全性。因此应该考虑在双抗药物开发的临床前阶段实施预先存在的反应性筛选和表征。
3. 基于协同免疫调节机制的风险
基于药物MOA或基于药理学的风险正逐渐变成一个重要的免疫原性风险因素。在肿瘤学中,许多双抗经设计,可以通过有效地刺激免疫系统来诱导强烈的抗肿瘤反应,但同时可能会发生ADA反应。
此外,免疫治疗已经进入一线,并成为特定肿瘤类型的标准治疗手段之一;目前正在研究双抗对已经接受,或将要接受免疫检查点治疗的患者的疗效。我们讨论了以下可能的机制:
(1)ADA介导的非特异性免疫激活;
(2)免疫复合体结构;
(3)协同免疫激活,这可能会促进抗癌双抗的免疫原性提升;
(1)ADA介导的细胞表面受体双抗非特异性免疫激活作用
一些细胞表面受体需要二聚化或更高级交联来激活,这为避免双抗发生无意识的免疫激活提供了思路。
例如,Rybrevant®使用其间充质-上皮转化酪氨酸激酶受体(C-MET)靶点的单价结合来避免C-MET二聚化诱导的增殖信号。然而,当ADA通过ADA-药物-靶点相互作用使ADA交联时,旨在激活细胞表面受体的激动剂产品有可能充当‘超级激动剂’,导致ADA介导的免疫激活。
同样,对于旨在抑制细胞表面受体激活的拮抗产品,ADAs使药物受体复合体交联也可能导致受体激活和细胞因子释放。图1A是双抗激动剂药物的一个例子(Ig G-scFv格式)
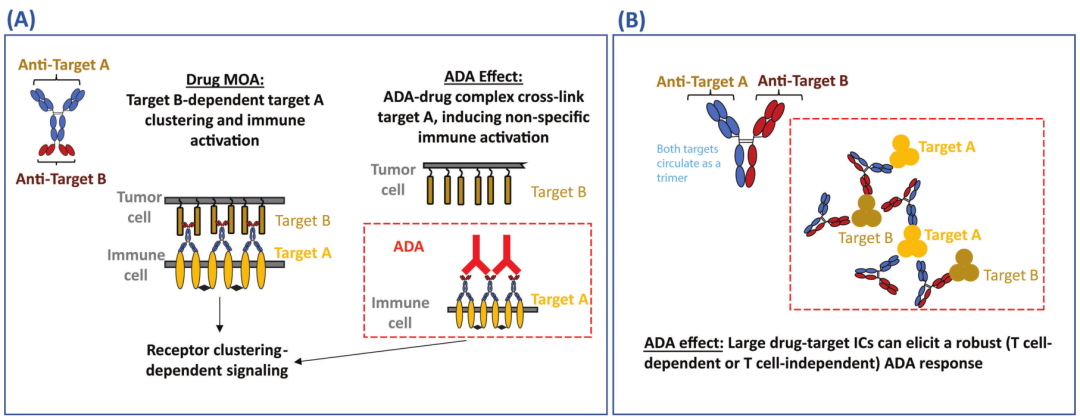
图1 基于MOA的药物免疫原性风险。(A)ADA介导的具有桥联激动剂活性的BsAb的非特异性激活图(B)双可溶靶点和协同MOA的设想的BsAb与多聚体可溶靶点之间的免疫复合物形成图。
(2)双抗与可溶靶点间的免疫复合体
图1B展示了靶向两个可溶细胞因子或配体的双抗药物。该药物可能形成同时具有三聚体靶点A和靶点B的大型免疫复合物,这可能会引起强大的T细胞依赖或T细胞非依赖的ADA反应,有许多例子表明免疫复合物的形成和抗炎药物的免疫原性之间存在关联。
由于药物与靶点的化学计量比会影响IC的形成和ADA的发展,所以在设计针对可能以可溶多聚体存在的配体的双抗分子时,可以使用尺寸排除层析等标准方法来评估复合体的形成情况。
(3)协同免疫刺激药MOA的免疫原性风险
1.免疫检查点抑制剂
与已知免疫抑制MOA的药物相比,具有免疫刺激活性的药物诱导免疫原性的可能性更大。尽管有这种可能性,但多种免疫检查点抑制剂的单一疗法(例如,抗PD-1单抗和抗CTLA-4单抗)的ADA发生率较低。最近开发了多种具有协同免疫刺激活性的双抗。这种协同免疫激活可能导致免疫原性风险增加。虽然许多双抗目前仍处于早期开发阶段,报道的ADA数据有限,但从部分与免疫检查点抑制剂的联合治疗中可以明显观察到免疫原性增加。最值得注意的是,当nivolumab (抗PD-1单抗)与ipilimumab(抗CTLA-4单抗)联合使用时,抗nivolumab抗体的发生率从11.2%-12.7%增加到23.8%-37.8%。
2.T细胞结合
带有B细胞耗尽的MOA的T细胞结合物免疫原性通常更低。BLINCETO®是全球首个在肿瘤学领域被批准用于治疗B细胞前体急性淋巴细胞白血病的双抗就是一个最好的例子。该药物是第一代BITE®分子,由两种亲本不同的鼠单抗与恶性B细胞上表达的CD19和T细胞上表达的CD3结合而成。尽管Blincyto®中的小鼠序列具有潜在的免疫原性风险,但在III期试验中,数百名接受治疗的患者中,只有不到2%的患者结合ADA呈阳性。Blincyto®的MOA有效地去除了所有表达CD19的B细胞,从而限制了ADA的形成。相反,如果药物中存在T细胞表位,非B细胞耗竭的T细胞活跃者诱导临床免疫原性的风险可能更高
3.4-1BB T细胞增强剂
现有的数据表明,4-1BB激动剂无论是单独治疗,还是与其他免疫肿瘤学(IO)药物联合治疗,都会诱发相对较高的ADA发生率,这表明含有4-1BB靶向功能结构域的BsAb可能会遇到类似的免疫原性风险。因此,基于MOA的免疫原性风险也应该在多种其他风险因素的背景下进行评估,这可能需要针对药物MOA的额外分析来进行风险评估
///与患者相关的因素
(1)患者既往治疗情况
BsAbs和肿瘤学中的多特异性治疗蛋白产品通常针对常见的TAA、免疫检查点抑制剂或免疫细胞受体。对以前的产品产生的Adas可能与相关产品发生交叉反应,导致在基线上存在针对新药的抗体
(2)剂量和给药方案
给药剂量、给药方案和给药途径也可能影响免疫原性。
04
临床STAG中正在进行的IGRA和IGRA驱动的免疫原性监测策略
大多数临床前IGRA考虑治疗相关和患者相关因素造成的免疫原性风险,但药物MOA风险未得到重视,需要在临床开发之前给予更多关注。
IGRA是一个持续的过程,必须随着临床数据的获得而重新评估。FDA最近的指导建议IGRA与样本收集和免疫原性测试计划保持一致,以纳入最初的研究新药应用。
05
免疫原性管理
制定可靠的IGRA,指导候选药物和剂型选择,并采取积极主动的方法或在临床前开发期间降低候选分子的风险,对于降低临床上的潜在风险至关重要。
然而,如果在临床阶段确实发生了抗体反应,缓解ADA的有效途径包括通过重组识别和去除生物中的违规B细胞和T细胞表位。
除了ADA监测、领域表征和ADA影响分析外,在临床开发过程中还可以考虑临床记忆测试和HLAII亚型。
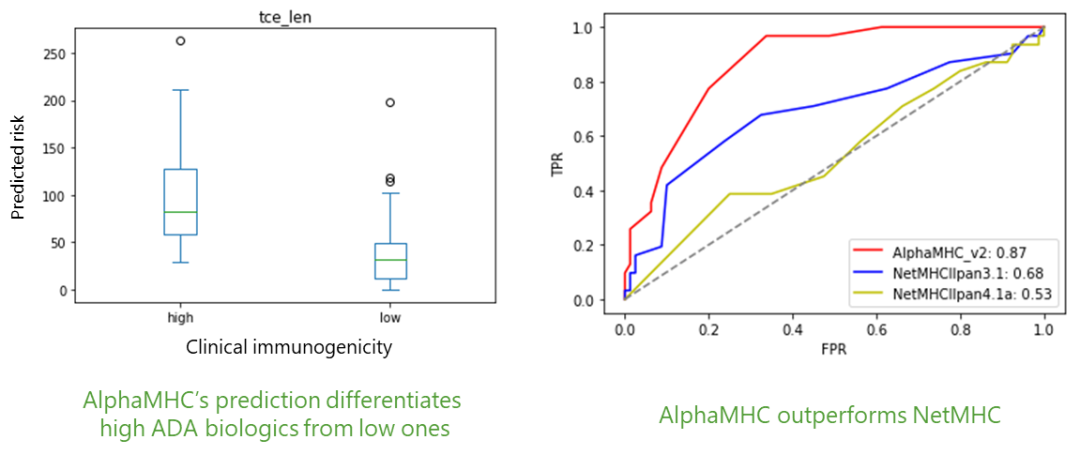
本文描述了在双抗药物开发过程中对免疫原性风险进行彻底的临床前评估的重要性。基于对免疫原性预测研究的多年积累,唯信计算(Wecomput)开发的AlphaMHC算法采用流行的NLP自然语言处理技术,全新的多模融合深度神经网络架构,整合了近10亿条公开及私有的与免疫原性相关的湿实验数据(包括亲和力数据、NGS数据、质谱数据等)进行训练,成功实现了从序列到临床免疫原性风险的端到端的预测,并通过上百条来自FDA、EMA的临床真实免疫原性数据(包括单/多特异性抗体和重组蛋白等)进行验证,AlphaMHC能够准确区分免疫原性的高低,ROC-AUC达0.87,准确性超过80%(部分测试集高达91%),表现出比现有方法显著更优的预测性能,是已知唯一一个可以得到临床数据验证的算法。