引言
蛋白降解靶向联合体(Proteolysis Targeting Chimera, PROTAC)是当前药化领域热门技术。通过连接体将靶蛋白配体与E3连接酶配体连接,招募E3至靶蛋白表面,引发多聚泛素化过程诱导蛋白降解,为小分子药物的研发开辟了新的路径。但是目前linker都是链状分子,通过大环化作用限制分子的生物活性构象是合理设计功能性化学探针有吸引力的策略。作者首次提出大环PROTAC策略,基于VHL:MZ1: BRD4复合物晶体结构和分子动力学(MD)模拟辅助下,设计合成了一系列大环PROTAC,并通过晶体解析验证了设计的合理性和MD模拟结果的可靠性。

先睹为快
单位与作者
英国邓迪大学生物化学家Alessio Ciulli
蛋白靶点
PROTAC分子MZ1与靶蛋白BRD4、E3泛素连接酶VHL的三元复合物晶体(PDB ID:5T35)
计算方法
二面角分析,分子动力学模拟
计算软件
Jaguar 9.7 (Schrödinger),Glide Ligand Designer (Schrödinger),Desmond (Schrödinger)
计算流程
首先使用模型化合物N-乙基乙酰胺来计算JQ1酰胺中A和B位置烷基化引入的势能变化,表明从B处衍生更合适;接下里确定连接区的长度,基于VHL:MZ1:BRD4的三元复合物晶体结构,作者Schrödinger软件构建了大环的MZ1衍生物,建模表明,包含3个PEG单元(化合物1)的连接体可以很好地容纳在蛋白质之间形成的空腔中。最后,通过Desmond模块对大环PROTAC分子VHL:1:Brd4BD2的复合物进行200ns的行分子动力学(MD)模拟,以研究三元体系在溶液中的行为,并取最后的50 ns用于数据收集和分析。
大环PROTAC的构建和MD模拟
作者研究了PROTAC分子MZ1与靶点BRD4、E3泛素连接酶VHL的三元复合物晶体结构,发现MZ1的两个配体部分(VHL配体,VH032和BET抑制剂,JQ1)在三元复合物中呈马蹄形(图1A)。因此,作者设想可以在MZ1的两个配体部分之间添加第二个连接片段形成环状化合物来设计大环PROTAC,将PROTAC分子构象锁定在结合状态来减少能量损失。
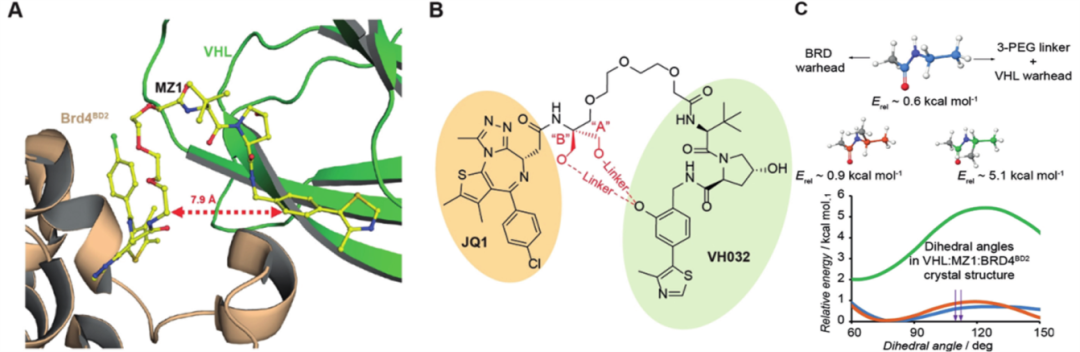
图1. 基于结构设计大环PROTAC分子
图片来源:Angew. Chem. Int. Ed.
将VHL配体上的酚羟基连接到MZ1连接体的第一个PEG单元,有两个插入位置A和B(图1B)。为了确定连接的位置,作者通过Jaguar 9.7 (Schrödinger)软件,使用密度泛函理论(DFT)对模型化合物N-乙基乙酰胺的烷基乙酰胺键进行了二面角扭转扫描分析(图1C)。结果显示在A处烷基化的能量损失约为5 kcal /mol,并且这种修饰会阻止MZ1连接体采用晶体学构象,从而破坏结合模式,因此,从B处衍生更合适。
接下来,作者用Schrödinger软件构建了分别由3个和2个PEG单元组成的连接片段的大环衍生物1和2。建模表明,化合物2的连接片段太短,无法覆盖两个连接点之间的距离,相反,包含3个PEG单元(化合物1)的连接片段可以很好地容纳在蛋白质之间形成的空腔中。最后,通过Desmond模块对VHL:1:Brd4BD2的复合物进行200ns的行分子动力学(MD)模拟,以研究三元体系在溶液中的行为,并取最后的50 ns用于数据收集和分析。
MD模拟的结果分析
最后的50 ns用于数据收集和分析,每隔10 ns抽取一帧来观察蛋白质-蛋白质和蛋白质-配体相互作用,并将抽取的结构进行叠加,时间间隔从蓝色变为深红色,网络中的水分子在界面的特定位置形成团簇,表明它们在模拟过程中参与稳定与周围环境的相互作用(图2A)。在整个模拟过程中,三元复合物保持稳定,保留了晶体结构VHL:MZ1:BRD4中MZ1的结合模式及蛋白-蛋白和蛋白-PROTAC的相互作用(图2B)。至关重要的是,模拟结果表明大环化反应与新连接体两端的关键极性相互作用相容,包括JQ1的酰胺与BRD4- N433的水介导相互作用、MZ1中第一个PEG单元的氧原子与BRD4- H437的氢键和VHL-Y98图2C)。
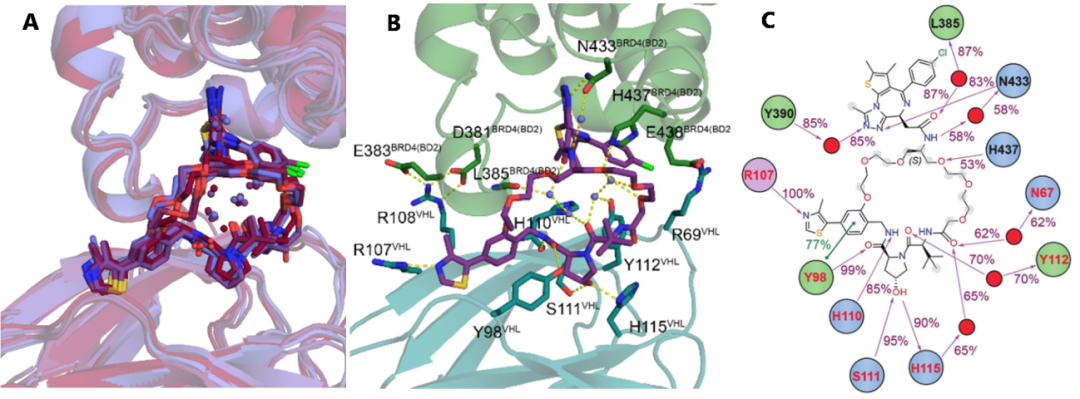
图2.大环PROTAC分子MD模拟结果
图片来源:Angew. Chem. Int. Ed.
为了验证结合模式,作者接下来共同结晶了VHL:macroPROTAC-1:BRD4,并以3.5Å的分辨率得到了三元复合物的结构。解析的晶体结构和MD模拟得到的复合物结构可以很好地叠合在一起(RMSD=0.6Å)。大环PROTAC分子1的MZ1部分以相同的S型构象与未环化的PROTAC结合,保留BRD4-His437与PEG-3连接体上的氧原子之间的氢键。连接区的环化部分最佳地填充了BRD4的ZA-loop附近两个蛋白质的界面产生的额外空腔(图3A)。研究发现环化连接片段与ZA-loop有潜在冲突,这也可以解释与BRD蛋白结合亲和力的损失(表1)。在ZA-loop内,Leu387的侧链以及Gly386和Leu385的羰基氧基均小于3.5Å(图3B)。与BD2相比,BD1和BD2之间的差异可能归因于BD1的ZA-loop的差异,BD1中有额外的脯氨酸(Pro397),这可能限制了BD1适应大环PROTAC分子1。
尽管大环PROTAC分子1对BD2的亲和力弱12倍,但其具有与MZ1非常相似的细胞活性,并且与MZ1相比,大环PROTAC能更好地区分高度同源的BET家族蛋白。综上所述,环化PROTAC的设计策略有助于提高降解效能和同源靶点之间的选择性。
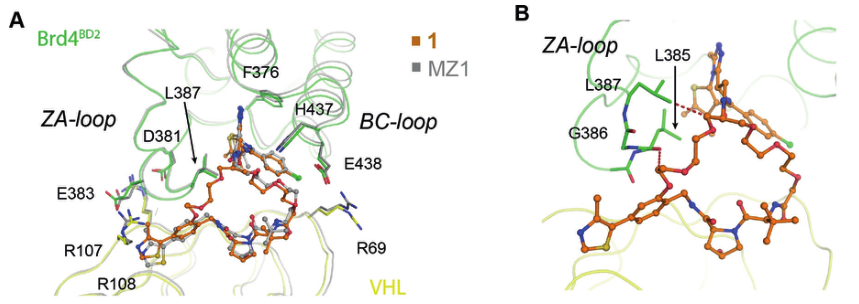
图3. VHL:1:BRD4三元复合物的晶体结构
图片来源:Angew. Chem. Int. Ed.
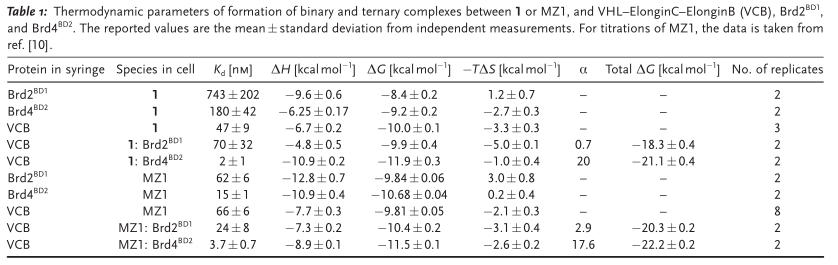
表1. 大环PROTAC与MZ1的热力学参数对比
图片来源:Angew. Chem. Int. Ed.
参考文献
Testa, A., Hughes, S. J., Lucas, X., Wright, J. E., & Ciulli, A.Structure-Based Design of a Macrocyclic PROTAC.Angew. Chem. Int. Ed. 2020,59(4),1727-1734.