背景
人体免疫系统的一个关键特征是能够在不靶向健康细胞或组织的情况下保护免受病原体侵害。免疫反应的趋化性运输由20 种G白偶联受体(GPCR)和超过40种趋化因子协调,这些趋化因子在正确的时间引导免疫细胞巡逻到正确的位置。炎性趋化因子及其受体在炎症刺激下被诱导,而稳态趋化因子被表达并产生“细胞高速公路”,其不断地将细胞导向特定器官。重要的趋化因子配体是CCL19和CCL21,其结合CC趋化因子受体7(CCR7)以引导B细胞,T细胞和抗原呈递树突细胞到整个身体的淋巴结。但是狡猾的癌细胞可以利用CCR7满足自己的扩张需求。信号蛋白引导它们离开原来的肿瘤,进入淋巴系统,在体内扩散,最终到其他组织中形成转移瘤。因此设计用于抑制CCR7的小分子配体具有解决淋巴结转移的巨大潜力,淋巴结转移是癌症相关死亡的主要原因。目前市场上靶向趋化因子受体的小分子药物屈指可数,相关药物的临床试验往往因为有效性、选择性欠佳而失败。
晶体结构解析
瑞士保罗谢尔研究所(Paul Scherrer Institute,简称PSI)和罗氏制药的科学家首先通过结构生物学方法解析出CCR7与小分子Cmp2105的复合物晶体结构。复合物晶体结构发现Cmp2105不是结合在传统的正构位点,而是在TM1,TM2,TM3和TM6的末端与TM7和H8之间的环之间与CCR7的细胞内部分的别构位点,这与CCR2中CCR2-RA-[R],CCR9中的Vercirnon和β2-肾上腺素能受体中的Cmpd-15PA类似。
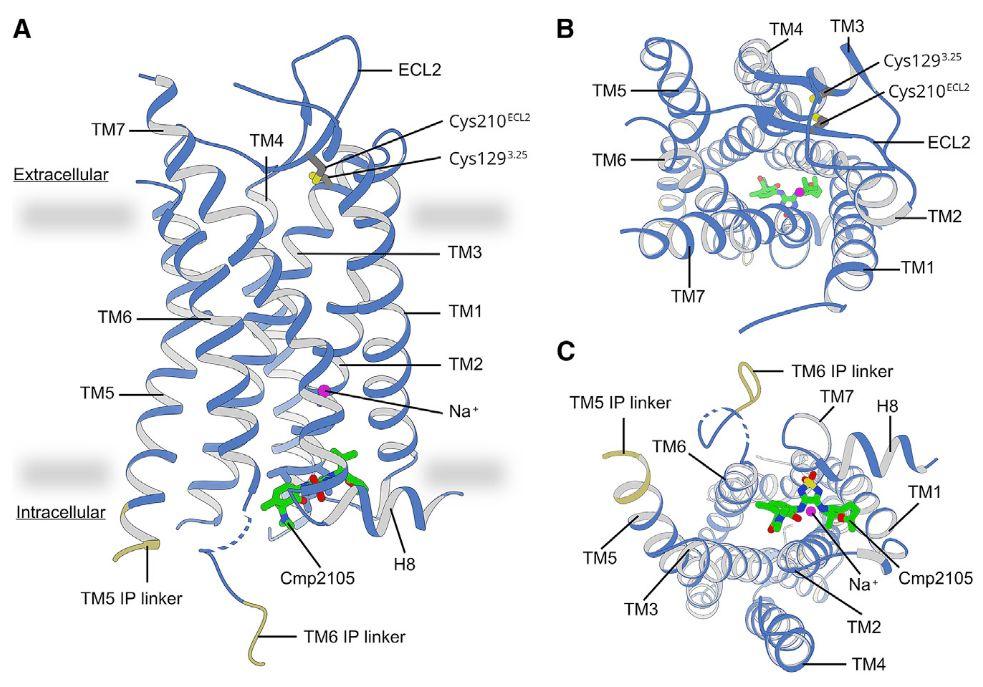
图1. CCR7-Cmp2105复合物晶体结构
图片来源Cell
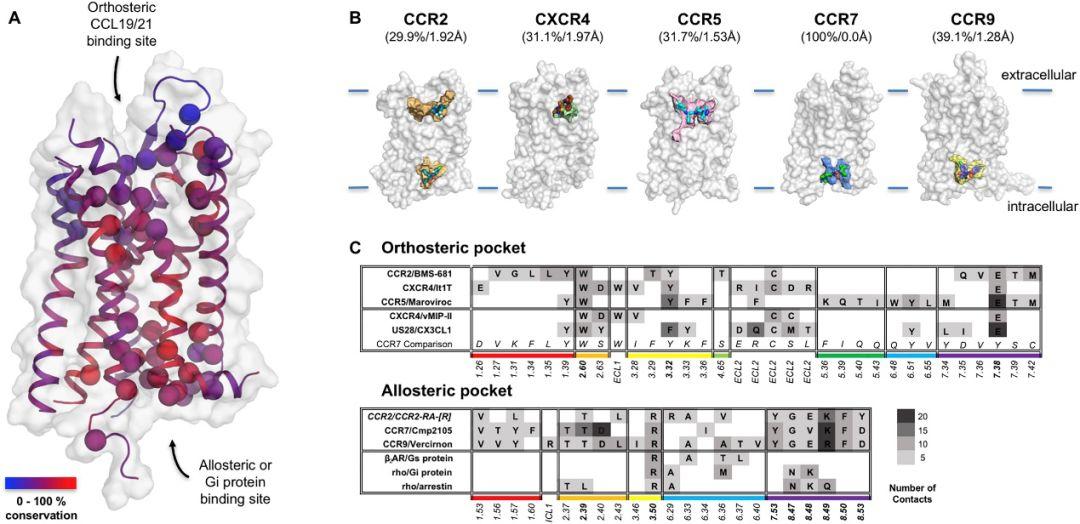
图2. 正构位点与别构位点分析
图片来源Cell
虚拟筛选
利用Cmp2105作为查询分子,对罗氏制药小分子库中的230万个化合物中进行基于三维形状相似性的筛选,筛选出具有不同拓扑结构但具有类似3D药效团的配体。选择293种类似物进行热稳定性测定,从中选择最强的2个分子进行进一步研究。分子CS-1含有特征性的环砜,缺乏Cmp2105中的仲胺。利用分子对接方法将其置于变构结合口袋中,磺酰基面向TM7-H8,没有氢键可与Asp94相互作用。这解释了该配体2.4℃的较小稳定作用,但也证明了TM7-H8是小分子与CCR7结合的关键区域。尤其值得注意的是化合物Navarixin(或SCH-527123或MK-7123),一种对CXCR1和CXCR2有效和生物可利用的拮抗剂。Navarixin已经作为潜在的抗转移药物进入2期临床试验,用于结直肠癌和其他一些侵袭性癌症。过去人们以为它是与另一种受体结合,抑制癌细胞的其他功能。这一结果则表明,这是一种多靶点拮抗剂。
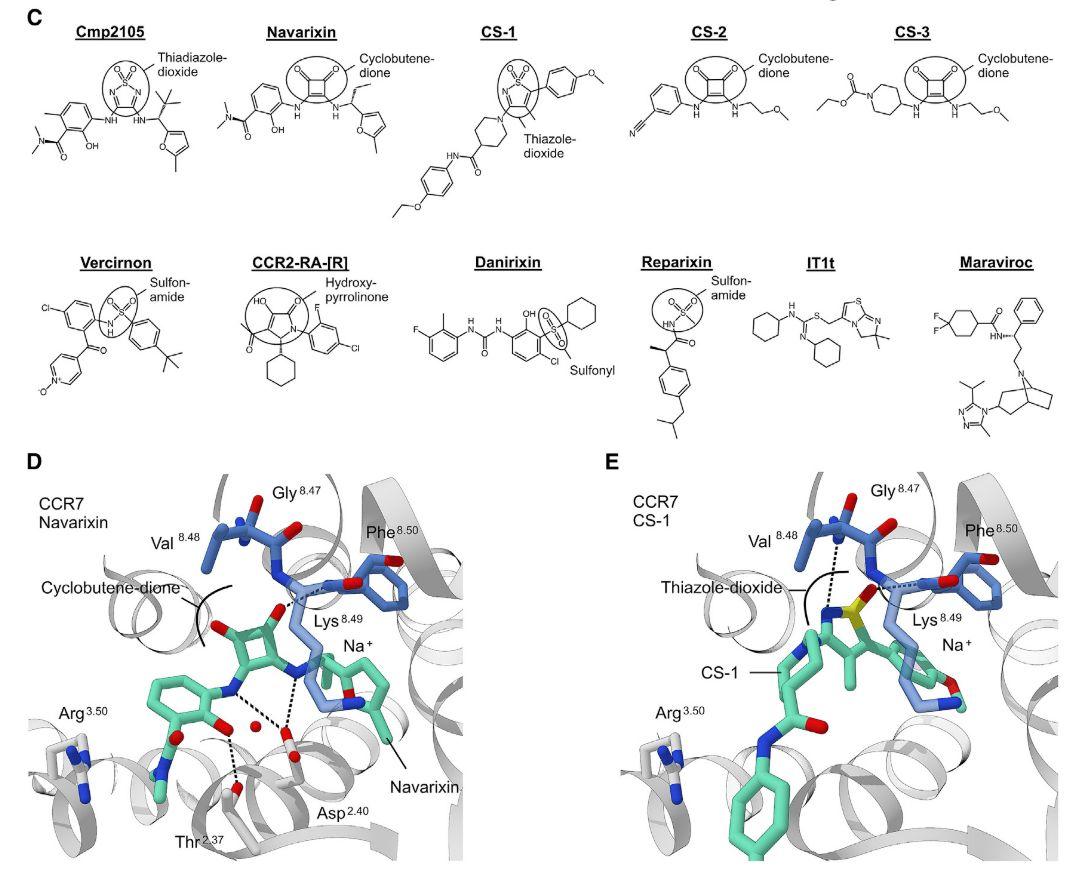
图3. 三维相似度虚拟筛选得到化合物及其活性最好的2个化合物分子对接后结合模式
图片来源Cell
计算部分总结
靶点:
趋化因子受体-7(简称CCR7)
筛选化合物库:
罗氏制药内部的230万化合物库
计算方法:
二维/三维相似度筛选(Similarity Search),分子对接(Docking)
计算软件:
二维相似度:Pipeline Pilot
三维相似度:FastROCS
分子对接:GOLD
总结
本文利用结构生物学手段,针对GPCR家族的CCR7解析出复合物晶体结构,并发现其为结合在别构位点的别构抑制剂,并利用计算机辅助药物设计的手段,对230万化合物库进行虚拟筛选,发现一些新的别构抑制剂,并通过分子对接确认TM7-H8是别构抑制剂结合的重要位点,其中一个别构抑制剂Navarixin正在临床阶段,揭示该药物是一种多靶点拮抗剂,对癌症治疗具有重要意义。
参考文献
Jaeger, K.,Bruenle, S.,Weinert, T.,et al. Structural Basis for Allosteric Ligand Recognition in the Human CC Chemokine Receptor 7. Cell 2019, 178(5):1222. doi.org/10.1016/j.cell.2019.07.028
