详解Fc工程通过调节抗体功能来赋予药物更强肿瘤杀伤能力和免疫激活能力的四种方式
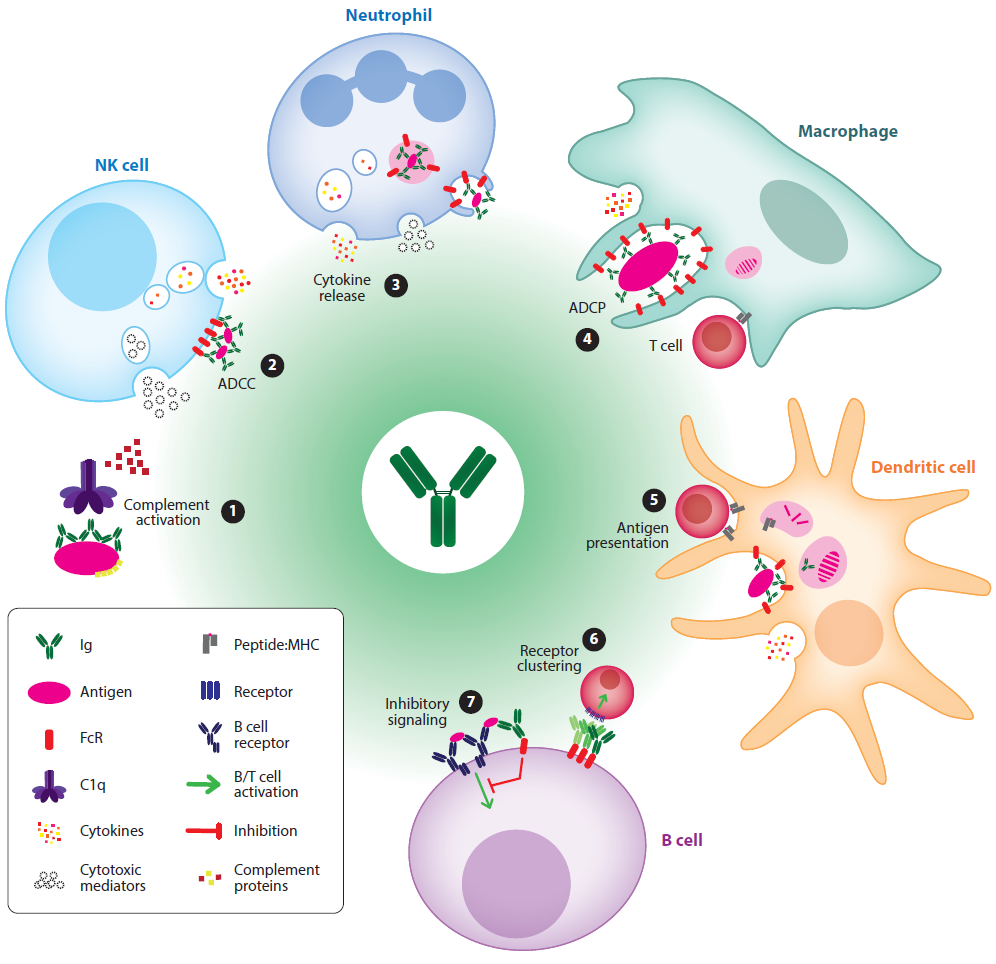
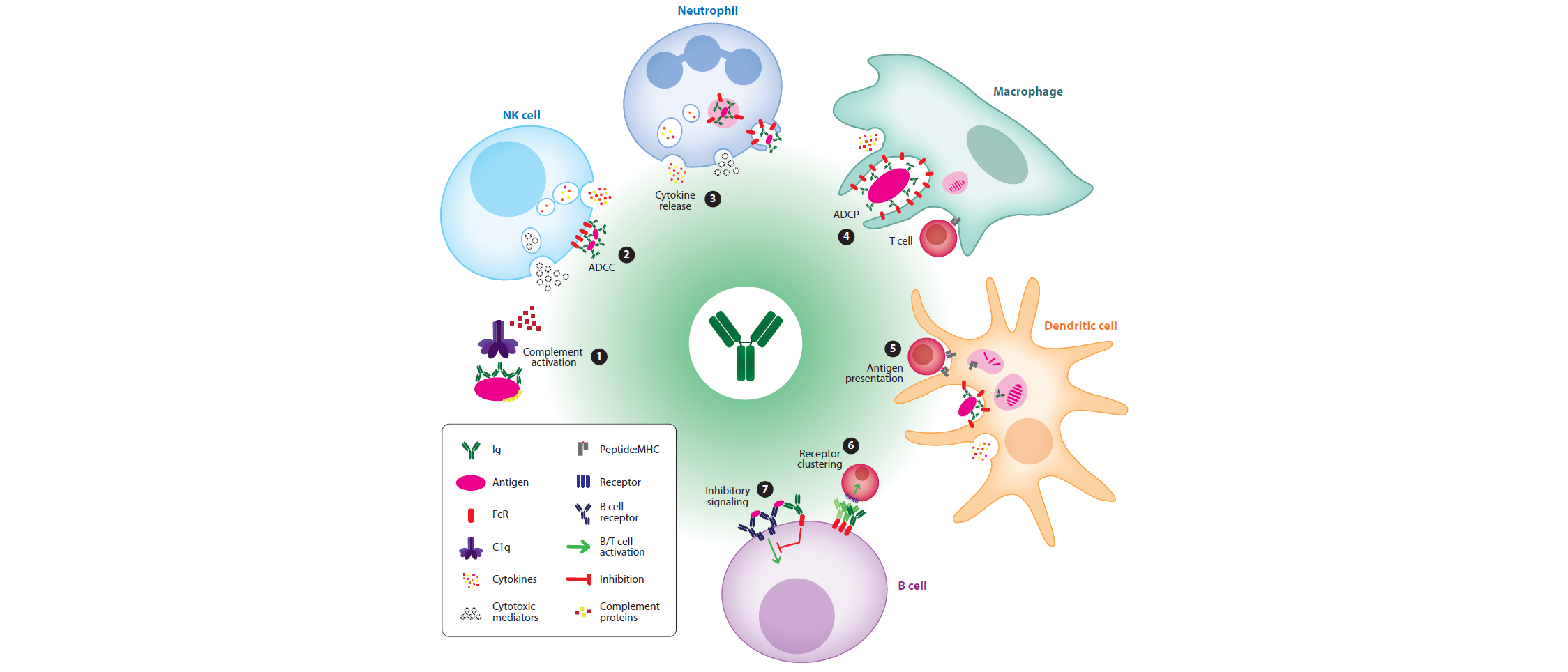
抗体的可结晶片段(Fc)结构域与大量的细胞Fc受体(FcRs)或可溶性蛋白之间的相互作用形成了体液免疫和先天免疫之间的关键联系。尤其免疫球蛋白G Fc结构域对于通过以下方式来清除靶细胞的过程至关重要,(a)细胞毒性、吞噬或补体溶解;(b)调节炎症;(c)抗原呈递;(d)抗体介导的受体聚集;(e)细胞因子的释放。超过30个旨在调节这些过程以获得最佳治疗效果的抗体正在临床评估中或已经获得批准。
得克萨斯大学奥斯汀分校的George Georgiou课题组于今年4月发表在国际顶级期刊Annual Review of Biomedical Engineering(该期刊在生物医学工程科学领域中77种刊物中排名第1,每年仅出版一期,5年影响因子14.615)的综述用四个章节详细介绍了Fc相关的进展。
前两章介绍了经典Fc受体(FcR)的种类,并分述各类Fc受体表达结合情况及其功能等。随后对FcR的信号特异性、相关信号通路以及功能的研究进行了介绍。一般来说,与Fc受体相关的效应功能有以下几个:
1. 抗体依赖的细胞介导的细胞毒性(ADCC)(FcγR介导) 或补体依赖的细胞介导的细胞毒性(CDCC)(补体介导),该过程涉及到自然杀伤(NK)细胞和中性粒细胞;
2. 靶点吞噬和内溶酶体破坏,包括抗体依赖的细胞介导的吞噬(ADCP)和补体依赖的细胞介导的吞噬(CDCP);
3. 补体依赖的细胞毒性(CDC)。由病毒靶细胞表面的膜攻击复合(MAC)的形成介导,导致其裂解;
5. 激动性的Fc介导的细胞表面受体聚集触发激活或凋亡信号;
6. 适应性免疫反应,通过抗原呈递、B细胞活化和诱导耐受性来调节。
图1 抗体效应功能总结。图片来源:Annu. Rev. Biomed. Eng.
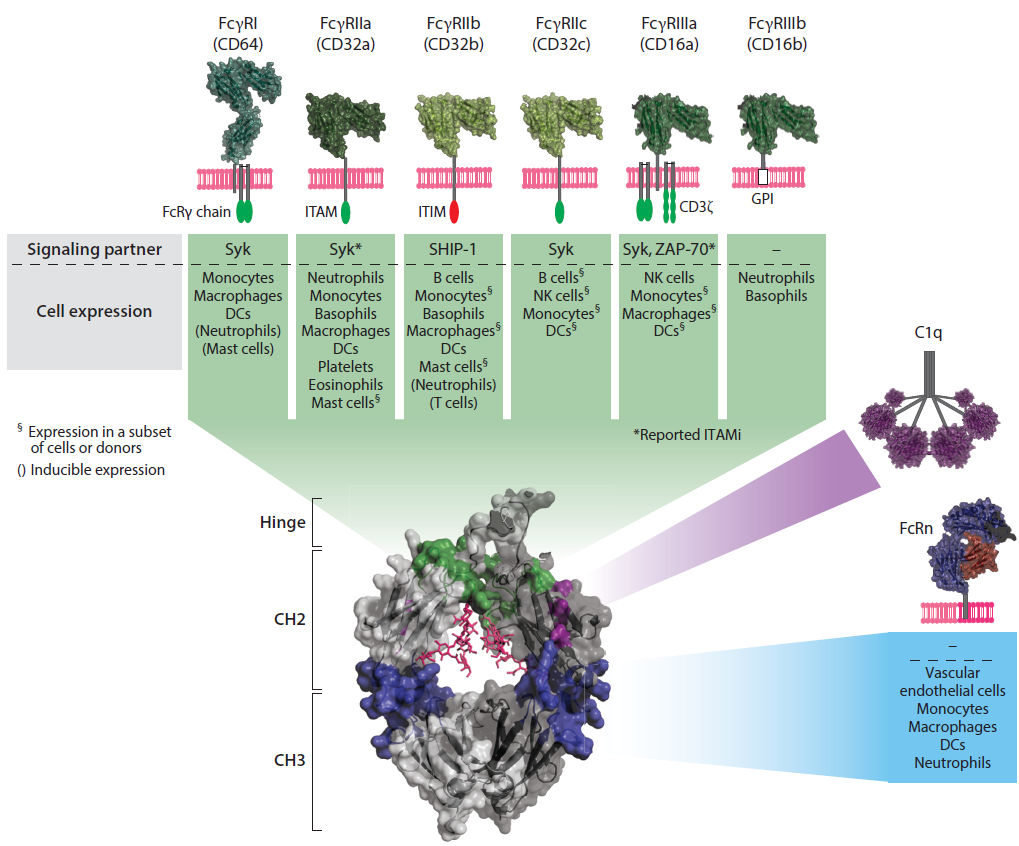
第三章对Fc结构域的分子结构以及其在FcR结合中的作用进行分享。最后一章介绍了如何通过Fc工程来调节抗体功能。本文将对如何通过Fc工程这项赋予抗体药物更强的肿瘤杀伤能力和免疫激活能力的技术来调节抗体功能的部分进行详细的介绍。
图2 IgG1 Fc和Fc结合受体的结构。图片来源:Annu. Rev. Biomed. Eng.
早期研究中,Fc:FcγR相互作用的结构信息是被用来参与激活FcγRs结合增强的突变体的。最近,研究者们开始对抗体的Fc部分进行改造,通过突变某些氨基酸残基来改变Fc的亲和力,以生成药效更好、毒性更小的抗体,这也是目前最为常用的Fc改造方式。文章将代表性的Fc改造案例进行了详细的描述,并将案例的关键性突变总结于表1。
表1 改变治疗抗体Fc结构域以调节效应FcR功能的例子。来源:Annu.Rev. Biomed. Eng. 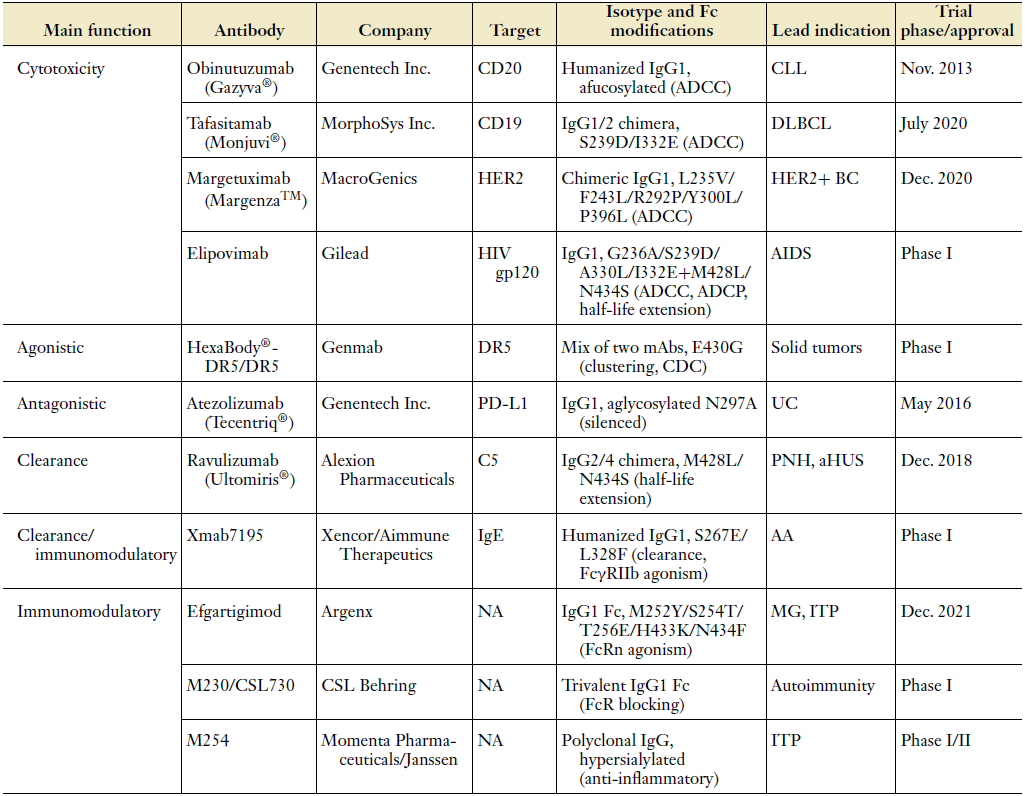 补体是抗体对病原体和病毒发挥细胞毒性的另一个主要途径。补体级联(complement cascade)在肿瘤清除中的作用因肿瘤类型而异,补体抑制剂的存在、抗原密度甚至抗原表位都是调节补体依赖性细胞杀伤的关键因素。补体通路与FcγR效应通路在肿瘤根除中的相对贡献尚不清楚。文中总结,在CH2较低结构域引入K322A突变可大大降低与C1q和CDC的结合,而对FcγR的结合仅略有影响;补体激活足以介导FcγR-/-小鼠(缺乏所有激活受体)中CD20+白血病细胞的消耗,C3b沉积有助于细胞介导的杀伤(CDCC和/或CDCP);使用不与FcγRs结合的工程去糖基化Fc,C1q单独结合可诱导补体驱动的细胞毒性和吞噬作用,并抑制裸鼠CD20+细胞的肿瘤生长。除了六聚化突变外,通过突变Fc (S267E、H268F和S324T)增加对C1q的亲和力会导致细胞毒性和补体效应因子增加。重要的是,这些突变可以与FcγR增强的修饰结合,以最大限度地提高细胞毒性。
增加单克隆抗体在体内循环中的持久性可降低剂量需求并增提高药物的生物利用度。增加对FcRn亲和力的Fc突变不一定会增加循环中抗体半衰期。相反,保留与FcRn的pH敏感结合对于更有效的内吞体循环,和延长抗体的半衰期至关重要。许多具有增强药代动力学的Fc变异已被发现,突变体M252Y/S254T/T256E和M428L/N434S(Xtend®;见表1中ravulizumab)被证明可以使人类抗体半衰期增加两倍以上。
静脉注射免疫球蛋白(IVIg)被用于治疗大量的自身免疫性和过度炎症综合征。高剂量的IVIg(通常>1 g/kg)与内源性IgG竞争FcRn介导的再循环,从而显著降低血清中自身抗体的持久性。设计的在pH 6.0和7.4时增强FcRn亲和力的Fc结构域已被证明能干扰IgG抗体的再循环,从而显著降低循环中致病性自身抗体水平,并在多种自身免疫性疾病(包括重症肌无力、血小板减少等)中显示出治疗效果(见表1)。
IVIg可以发挥独立于FcRn的直接抗炎作用。据报道,唾液酸化IVIg在较低剂量下更有效。虽然末端唾液酸化对FcγRs的亲和力有轻微影响,但唾液酸的作用主要归因于与II型FcRs的结合。尽管这些受体介导抗炎作用的确切机制仍存在争议,目前正进行II期临床试验,用于ITP和慢性炎性脱髓鞘性多性神经病变(见表1中的M254)。
可溶性的、多聚的Fcs能够阻断FcγR驱动的炎症反应。Ortiz等人研究指出,Fc三聚体能阻断FcγR参与而不导致其激活,并且在临床前关节炎和ITP小鼠模型中优于IVIg(见表1中CSL730)。
增强与FcγRIIb结合的Fc设计方法也被用作自身免疫或过敏干预。在抗CD19或抗IgE Fab中进行S267E/L328F双突变,可使得FcγRIIb(和FcγRIIaR131)的亲和力增加430倍,阻断Ca2+流动,促进B细胞凋亡。但FcγRIIb亲和力增强的抗体可被表达高水平FcγRIIb的LSECs迅速从循环中清除,因此该方法常被用来构建可快速清除循环中的靶分子的清除抗体。清除抗体GYM329可以抑制并介导肌肉生长抑制素的清除,正处于临床开发阶段。
Fc工程已成功地用于与典型的FcγRs、FcRn和C1q之外的受体结合。在最近一项研究中,Kariolis等人报道了IgG CH3结构域侧表面转铁蛋白受体结合位点的设计,且不影响pH依赖的FcRn结合。在食蟹猴模型中,转铁蛋白受体结合导致可通过血脑屏障的抗体显著增加。另外,通过融合IgG和IgA Fc结构域,Kelton等人也创建了一种交叉同型抗体(称为IgGA),能与人激活的FcγRs和C1q以及FcαRI结合。
在过去的30年里,随着对FcRs生物学的理解的进步,利用结构突变、随机突变,筛选等方法进行IgG Fc结构域的蛋白工程以筛选达到与治疗相关受体之间的理想结合谱,以及使用人源化小鼠模型和其他新工具来评估Fc效应功能,为设计一系列重要的抗体治疗药物开辟了道路。Fc设计被证明对于更好地理解髓系细胞上表达的每个效应FcRs所介导的细微差异和表型效应非常有用。
当结合不同的突变组时,需要仔细设计,因为尽管在Fc上的Fcγ和FcRn结合位点之间存在距离,但这两个结构域之间有可能存在变构调控。这种效应已在携带 FcRn 增强突变的 Fc 的 FcγR 结合减少中得到证实。将Fc工程与效应功能的高通量监测相结合,可以阐明这种微妙的影响,并可能有助于揭示新的疗法。
Fc工程涉及到抗体序列和结构,这些特征也是抗体文库构建、体外亲和力成熟等其他抗体工程学改造的基础,而正确对Fc的氨基酸位点进行编号,是分析已有的Fc工程技术以及设计Fc工程化突变的前提,但很多抗体从业人员也不知道如何对Fc进行Eu编号。
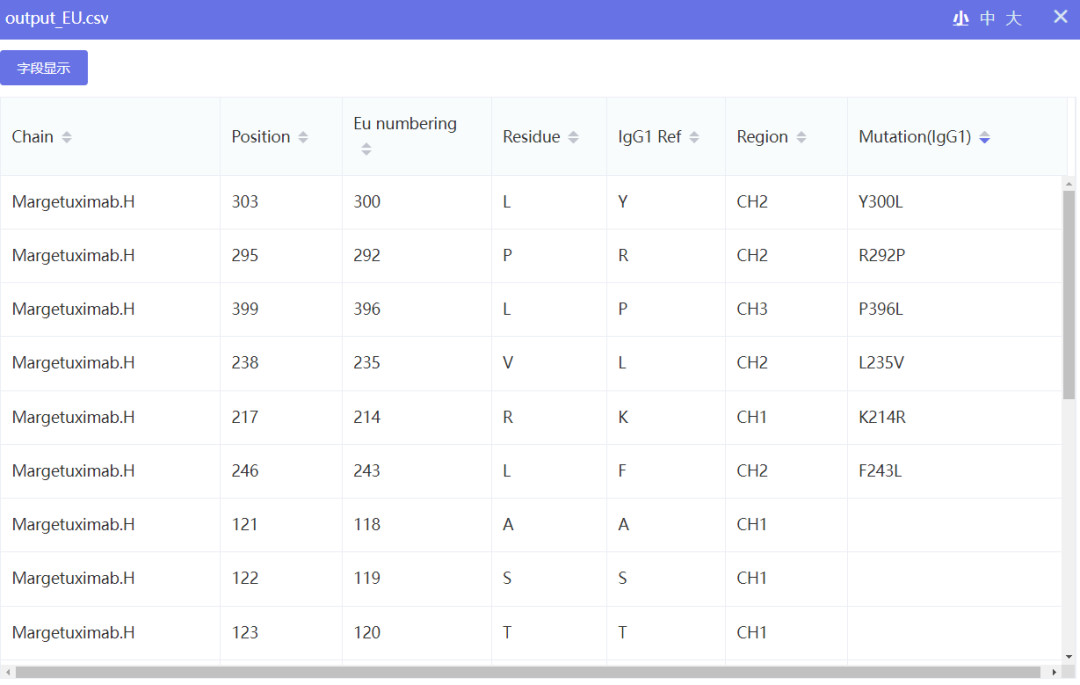
WeSeq支持几乎所有主流的编号规则, 例如:可变区广泛使用的Kabat、Chothia 和 IMGT,以及恒定区主要使用的Eu规则。以Margetuximab为例,在WeSeq中选择菜单中的Numbering->EU,即可对Fc进行编号。导入IgG1序列进行比对,align之后利用toggle功能将Margetuximab的保守残基用“*”号显示,发现WeSeq成功识别了前文表1中的五个突变位点:L235V、F243L、R292P、Y300L、P396L。
橘色线条为EU系统标注的Fc域,色块则为Kabat系统标示的CDR区,红框为突变位点
补体是抗体对病原体和病毒发挥细胞毒性的另一个主要途径。补体级联(complement cascade)在肿瘤清除中的作用因肿瘤类型而异,补体抑制剂的存在、抗原密度甚至抗原表位都是调节补体依赖性细胞杀伤的关键因素。补体通路与FcγR效应通路在肿瘤根除中的相对贡献尚不清楚。文中总结,在CH2较低结构域引入K322A突变可大大降低与C1q和CDC的结合,而对FcγR的结合仅略有影响;补体激活足以介导FcγR-/-小鼠(缺乏所有激活受体)中CD20+白血病细胞的消耗,C3b沉积有助于细胞介导的杀伤(CDCC和/或CDCP);使用不与FcγRs结合的工程去糖基化Fc,C1q单独结合可诱导补体驱动的细胞毒性和吞噬作用,并抑制裸鼠CD20+细胞的肿瘤生长。除了六聚化突变外,通过突变Fc (S267E、H268F和S324T)增加对C1q的亲和力会导致细胞毒性和补体效应因子增加。重要的是,这些突变可以与FcγR增强的修饰结合,以最大限度地提高细胞毒性。
增加单克隆抗体在体内循环中的持久性可降低剂量需求并增提高药物的生物利用度。增加对FcRn亲和力的Fc突变不一定会增加循环中抗体半衰期。相反,保留与FcRn的pH敏感结合对于更有效的内吞体循环,和延长抗体的半衰期至关重要。许多具有增强药代动力学的Fc变异已被发现,突变体M252Y/S254T/T256E和M428L/N434S(Xtend®;见表1中ravulizumab)被证明可以使人类抗体半衰期增加两倍以上。
静脉注射免疫球蛋白(IVIg)被用于治疗大量的自身免疫性和过度炎症综合征。高剂量的IVIg(通常>1 g/kg)与内源性IgG竞争FcRn介导的再循环,从而显著降低血清中自身抗体的持久性。设计的在pH 6.0和7.4时增强FcRn亲和力的Fc结构域已被证明能干扰IgG抗体的再循环,从而显著降低循环中致病性自身抗体水平,并在多种自身免疫性疾病(包括重症肌无力、血小板减少等)中显示出治疗效果(见表1)。
IVIg可以发挥独立于FcRn的直接抗炎作用。据报道,唾液酸化IVIg在较低剂量下更有效。虽然末端唾液酸化对FcγRs的亲和力有轻微影响,但唾液酸的作用主要归因于与II型FcRs的结合。尽管这些受体介导抗炎作用的确切机制仍存在争议,目前正进行II期临床试验,用于ITP和慢性炎性脱髓鞘性多性神经病变(见表1中的M254)。
可溶性的、多聚的Fcs能够阻断FcγR驱动的炎症反应。Ortiz等人研究指出,Fc三聚体能阻断FcγR参与而不导致其激活,并且在临床前关节炎和ITP小鼠模型中优于IVIg(见表1中CSL730)。
增强与FcγRIIb结合的Fc设计方法也被用作自身免疫或过敏干预。在抗CD19或抗IgE Fab中进行S267E/L328F双突变,可使得FcγRIIb(和FcγRIIaR131)的亲和力增加430倍,阻断Ca2+流动,促进B细胞凋亡。但FcγRIIb亲和力增强的抗体可被表达高水平FcγRIIb的LSECs迅速从循环中清除,因此该方法常被用来构建可快速清除循环中的靶分子的清除抗体。清除抗体GYM329可以抑制并介导肌肉生长抑制素的清除,正处于临床开发阶段。
Fc工程已成功地用于与典型的FcγRs、FcRn和C1q之外的受体结合。在最近一项研究中,Kariolis等人报道了IgG CH3结构域侧表面转铁蛋白受体结合位点的设计,且不影响pH依赖的FcRn结合。在食蟹猴模型中,转铁蛋白受体结合导致可通过血脑屏障的抗体显著增加。另外,通过融合IgG和IgA Fc结构域,Kelton等人也创建了一种交叉同型抗体(称为IgGA),能与人激活的FcγRs和C1q以及FcαRI结合。
在过去的30年里,随着对FcRs生物学的理解的进步,利用结构突变、随机突变,筛选等方法进行IgG Fc结构域的蛋白工程以筛选达到与治疗相关受体之间的理想结合谱,以及使用人源化小鼠模型和其他新工具来评估Fc效应功能,为设计一系列重要的抗体治疗药物开辟了道路。Fc设计被证明对于更好地理解髓系细胞上表达的每个效应FcRs所介导的细微差异和表型效应非常有用。
当结合不同的突变组时,需要仔细设计,因为尽管在Fc上的Fcγ和FcRn结合位点之间存在距离,但这两个结构域之间有可能存在变构调控。这种效应已在携带 FcRn 增强突变的 Fc 的 FcγR 结合减少中得到证实。将Fc工程与效应功能的高通量监测相结合,可以阐明这种微妙的影响,并可能有助于揭示新的疗法。
Fc工程涉及到抗体序列和结构,这些特征也是抗体文库构建、体外亲和力成熟等其他抗体工程学改造的基础,而正确对Fc的氨基酸位点进行编号,是分析已有的Fc工程技术以及设计Fc工程化突变的前提,但很多抗体从业人员也不知道如何对Fc进行Eu编号。
WeSeq支持几乎所有主流的编号规则, 例如:可变区广泛使用的Kabat、Chothia 和 IMGT,以及恒定区主要使用的Eu规则。以Margetuximab为例,在WeSeq中选择菜单中的Numbering->EU,即可对Fc进行编号。导入IgG1序列进行比对,align之后利用toggle功能将Margetuximab的保守残基用“*”号显示,发现WeSeq成功识别了前文表1中的五个突变位点:L235V、F243L、R292P、Y300L、P396L。
橘色线条为EU系统标注的Fc域,色块则为Kabat系统标示的CDR区,红框为突变位点
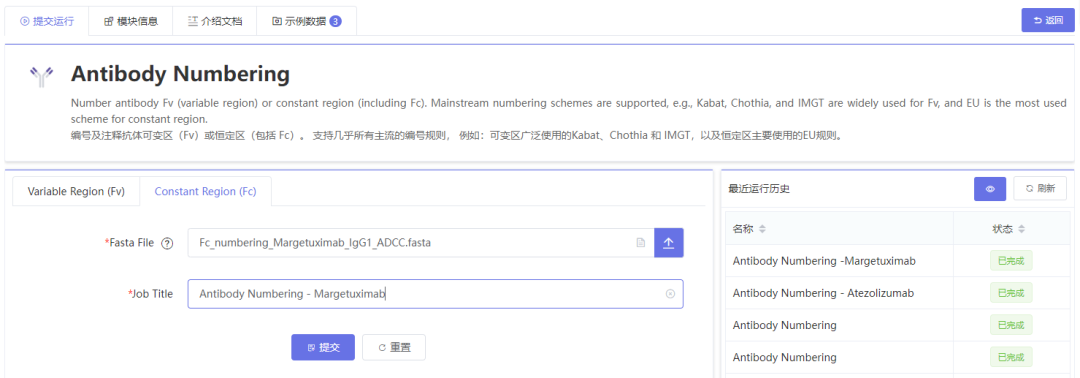
除了WeSeq,WeMol还有一个专有的计算模块Antibody Numbering也可满足抗体Fc编号的需求,同样的以Margetuximab为例,在Antibody Numbering模块界面,切换到Constant Region (Fc)面板,上传带Fc的抗体序列(Fasta格式),点击提交:
计算模块提交任务界面
Fasta格式的Margetuximab序列如下。两条链的名字可以是任意的,WeMol会自动识别可变区和轻重链。
>Margetuximab.H
QVQLQQSGPELVKPGASLKLSCTASGFNIKDTYIHWVKQRPEQGLEWIGRIYPTNGYTRYDPKFQDKATITADTSSNTAYLQVSRLTSEDTAVYYCSRWGGDGFYAMDYWGQGASVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELVGGPSVFLLPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPPEEQYNSTLRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPLVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
>Margetuximab.L
DIVMTQSHKFMSTSVGDRVSITCKASQDVNTAVAWYQQKPGHSPKLLIYSASFRYTGVPDRFTGSRSGTDFTFTISSVQAEDLAVYYCQQHYTTPPTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
结果文件会显示Fc部分每个残基的位置编号和Eu编号,以及所属结构域(CH1/Hinge/CH2/CH3)。
想要了解更多精彩内容,欢迎扫描下方二维码关注我们的官方微信视频号及B站号:
Delidakis G, Kim JE, George K, Georgiou G. Improving Antibody Therapeutics byManipulating the Fc Domain: Immunological and Structural Considerations. Annu Rev Biomed Eng. 2022 Jun 6;24:249-274.
doi: 10.1146/annurev-bioeng-082721-024500. Epub 2022 Apr 1. PMID: 35363537.