
背景
冠状病毒是一类形似日冕状的RNA病毒,是已知RNA病毒中具有最大基因组的病毒。自1965年首次分离出人类致病的冠状病毒以来,已有7种冠状病毒被发现可以导致人类产生疾病。其中,有4种冠状病毒HCoV-229E、HCoV-NL63、HCoV-HKU1、HCoV-OC43可以导致人类出现轻度呼吸系统疾病,这些疾病在临床上占呼吸道感染疾病的10%-30%。其余的三种冠状病毒SARS-CoV、MERS-CoV和SARS-CoV-2(新型冠状病毒)作为高致病性冠状病毒,其致死率高达10%-30%。特别是新型冠状病毒引起的新冠肺炎(COVID-19),以极快的速度席卷全球,已成为全球范围内的公共卫生突发事件。
针对新冠肺炎尚无临床特效药物用以治疗,通过研究冠状病毒关键性蛋白的通用机制,对研发抗病毒药物就变得极为重要。在冠状病毒的生命活动中,其主蛋白酶(3CLPro)能够有效地剪切病毒的蛋白前体,进而产生病毒的功能性蛋白,这对冠状病毒的复制等生命活动极为重要。因此,主蛋白酶是抗冠状病毒药物研究的重要靶点。
先睹为快
单位与作者
南开大学药学院(李冬梅教授&尚鲁庆教授)
计算方法与模型
SARS-CoV 3CLPro (PDB ID: 1UJ1)
SARS-CoV主蛋白酶与醛类抑制剂M7的共晶结构(PDB ID: 6LNQ)
SARS-CoV主蛋白酶与醛M15的共晶体结构(PDB ID: 6LNY)
计算软件
分子动力学模拟:Amber 18
模拟轨迹分析 :CPPTRAJ模块
口袋体积计算 :POVME
预反应态分析:Prereaction State (PRS) Analysis.
平均力势计算:Potential of Mean Force (PMF)
从头计算:Gaussian 09
计算亮点
团队结合结构生物学、蛋白突变、酶促反应动力学、分子动力学模拟、量化计算等手段,以MERS-CoV和SARS-CoV的主蛋白酶为对象,对其识别阶段和酶切阶段的催化机制进行了深入研究。在识别阶段,该团队解释了蛋白酶的S1口袋识别底物高度保守的Gln的原因;在催化阶段,该团队研究底物是如何被蛋白酶所固定的。为了更好地理解这两个蛋白酶个体的特性,该团队利用小分子抑制剂探针,结合结构生物学,酶学等手段探究了MERS-CoV和SARS-CoV主蛋白酶的催化区别,并提出基于机制的药物设计策略。
两种新冠病毒主蛋白酶的底物结合与催化
研究人员报道了MERS-CoV 3CLPro和SARS-CoV 3CLPro的全面分子催化机制(结合和催化)。对于底物结合,蛋白酶采用残基对(Glu-His)和由保守的His和底物Gln形成的稳定氢键,以识别底物P1位置的保守Gln。对于催化,鉴定了保守的GSGCS基序,并显示出其稳定了底物的活性位点并保持了催化半胱氨酸侧链的迁移性。此外,由保守的水分子介导的远程相互作用证明,由Arg-Tyr-Asp形成的部分负电荷簇(PNCC)对于催化至关重要。从SARS和MERS的蛋白酶之间的区别探讨了其催化效率。此外,进行了突变研究以提高酶活性(8倍),MERS-CoV 3CL Pro的抑制剂通过在抑制剂和MERS-CoV 3CLPro的关键Q195之间引入强大的氢键相互作用,确定了潜在的变构抑制位点。
由Gln锚定的保守水介导了PNCC和Dyad
之间的相互作用
在冠状病3CLPro中,PNCC的位置离催化二联体约6-7Å,这使得很难假定二联体与PNCC之间有强大的相互作用。但是,仔细研究两种蛋白酶的结构发现确定了一种保守的水分子,该水分子可能介导了这两种基本成分之间的远程相互作用(图1 A)。同时,注意与保守水产生相互作用的关键残基(MERS-CoV 3CL Pro中的 Q167和SARS-CoV 3CL Pro中的 H164 ),作者将Q167突变成脂肪族残基(图1C)。通过生化实验和计算催化口袋的体积发现,Q167和位于口袋的亲水性残基H41,M168和D190对蛋白酶的催化活性起到关键作用(图1D)。为进一步探索PNCC和保守水相互作用的影响,作者进行了预反应态(Prereaction state)分析发现,MERS-CoV 3CLPro催化反应的第一步是半胱氨酸受到亲核进攻,在His41催化帮助下,所得的硫酯将迅速水解(图1E)。
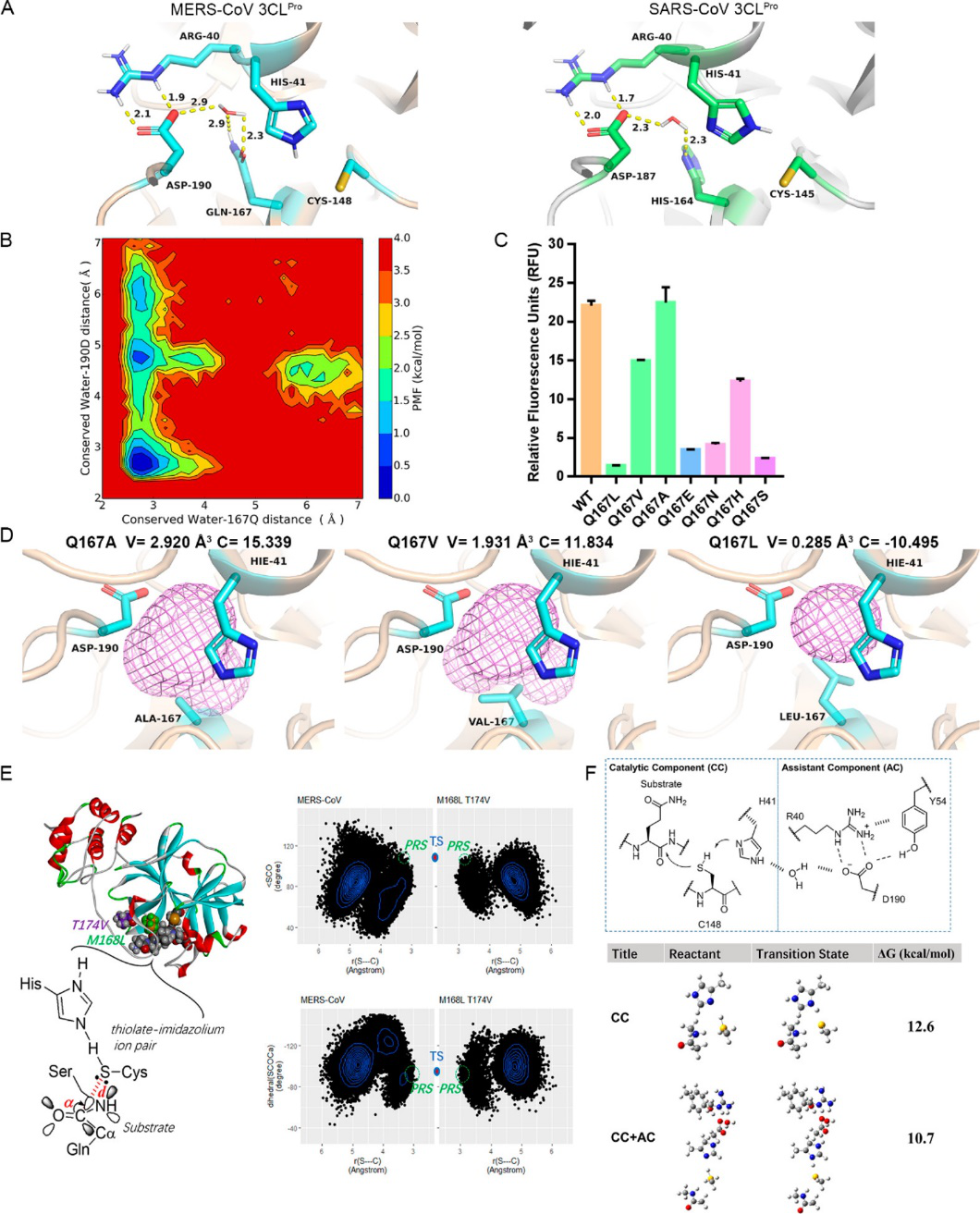
图1. 催化过程中保守水对介导远程相互作用发挥了关键作用
图片来源 ACS Catalysis
MERS-CoV与SARS-CoV主蛋白酶
在催化过程中的区别
在催化过程中,SARS-CoV 主蛋白酶的H164取代了MERS-CoV主蛋白酶中的相应的Q167 。但是,MERS-CoV主蛋白酶的Q167H实验结果表明突变体会降低酶活性(图2 A)。作者认为认为,MERS-CoV主蛋白酶的Q167和SARS-CoV主蛋白酶的H164周围的微环境可能会影响选择性,并进一步影响酶活(图2B)。作者随后对MERS-CoV主蛋白酶Q167周围的T88和S178进行突变。酶促实验结果表明,单点突变导致蛋白酶活性降低,但双突变S178T-T88C几乎保留了催化活性(图2 C)。同时,分子动力学(MD)模拟结果表明突变体S178A和T88A中出现了Q167的剧烈摆动,而突变体S178T-T88C中Q167的结构保持稳定。这些结果表明MERS-CoV 主蛋白酶的Q167和SARS-CoV 主蛋白酶的H164具有相似的环境,并锚定保守水的关键残基差异导致了MERS-CoV较SARS-CoV表现出更好的催化能力。因此,在消除环境影响的基础上,构建了MERS-CoV 主蛋白酶的多突变株(T88C-Q167H-S178T)。与野生型 MERS-CoV主蛋白酶相比,突变株水解能力降低且kcat值显著降低,这表明在酶切催化阶段锚定保守水的残基,两种蛋白酶的催化能力产生了差异(图2 D)。
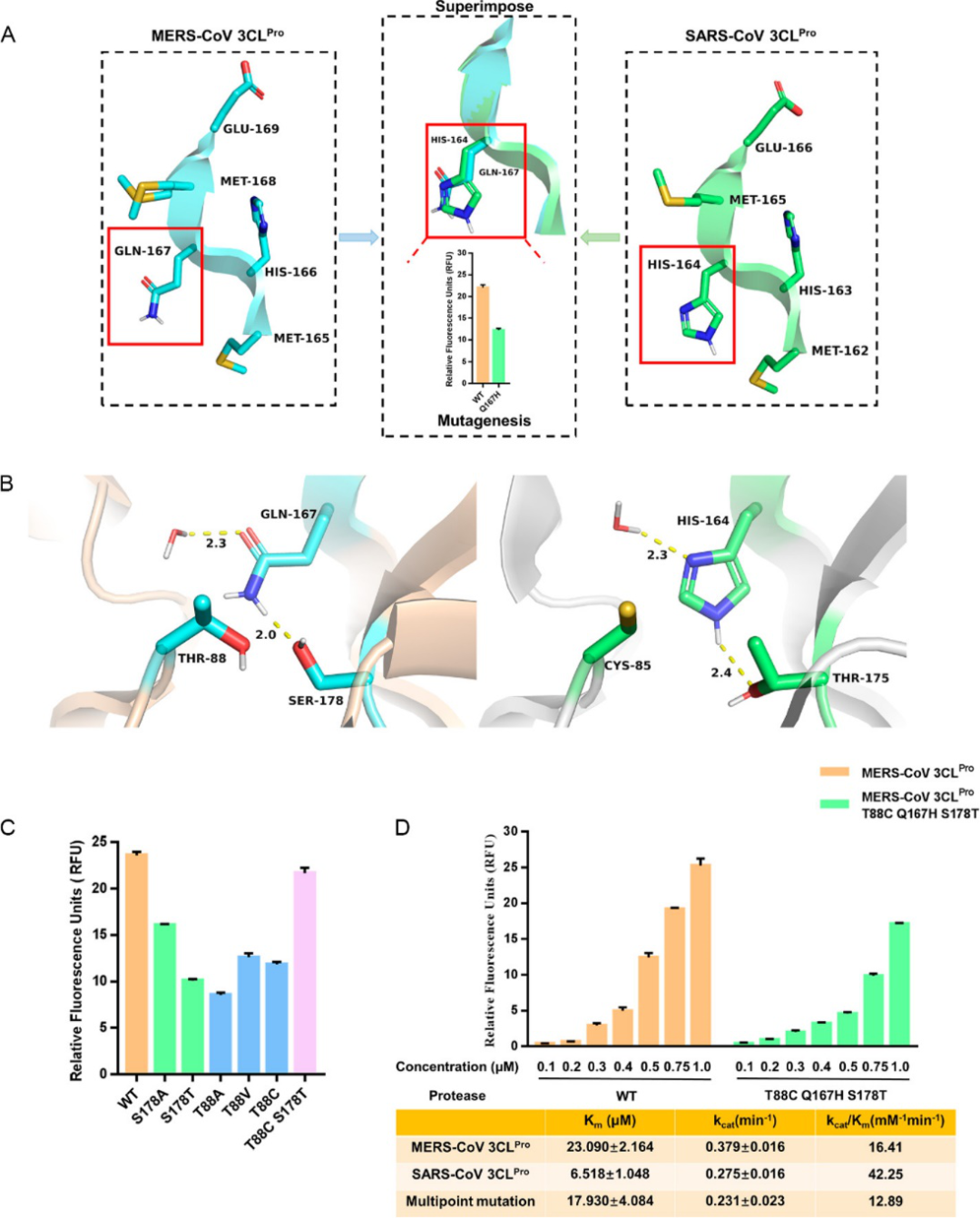
图2. 催化阶段MERS-CoV 3CLPro与SARS-CoV 3CLPro的区别
图片来源 ACS Catalysis
基于催化机理的酶改造和药物设计策略
主蛋白酶的高特异性为提高细胞内调控中工程酶(如烟草蚀刻病毒蛋白酶,TEV-P)和序列分析中胰蛋白酶的催化效率提供了启示。对于MERS-CoV 主蛋白酶,由于保守水位于由H41、Q167、M168和D190残基组成的区域中,来介导远程的交相互作用,因此限制保守水的运动可能有助于维持PNCC和 dyad之间的远程交互作用。催化过程的MD模拟中,捕获了M168靠近保守水的典型构象(图11A)。因此,将M168突变成疏水性残基Leu,阻止保守水靠近L168并维持PNCC和质子化的组氨酸之间密相互作用。通过抑制关键水分子的运动,从而显著地提升了蛋白酶的催化能力,为该蛋白酶的化学生物学应用打下了基础。一方面于抑制剂的P4位引入氢键受体基团以建立抑制剂P4位与关键的氨基酸残基Q195之间的相互作用,从而显著的提升抑制剂的活性多达4倍,为抑制剂的发展提供有力支撑。因此,对催化机理的深入研究有助于扩大酶应用的范围的酶设计和抗病毒药物的设计。
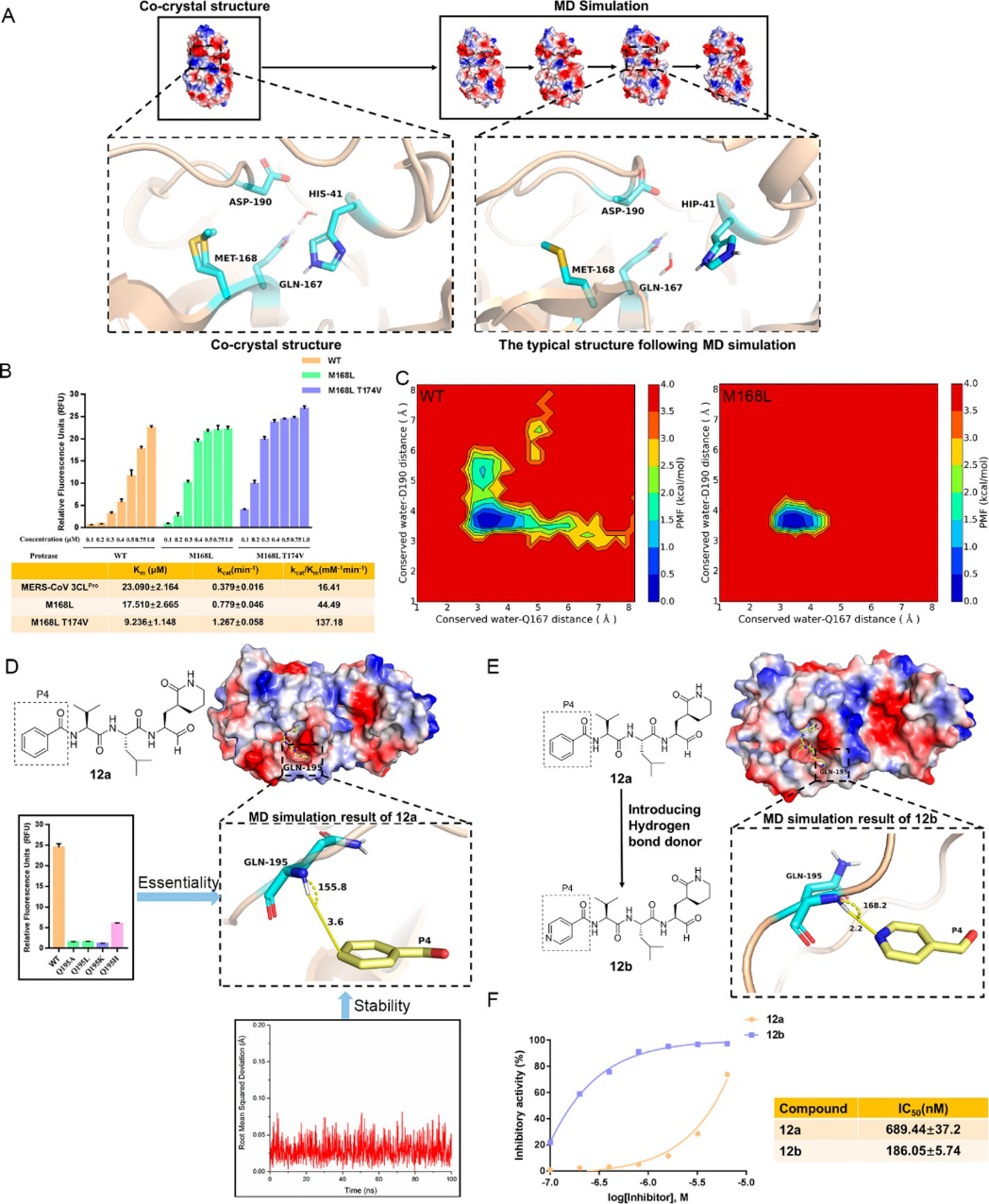
图3. 根据催化机理的酶改造和药物设计策略
图片来源 ACS Catalysis
参考文献
Comprehensive Insights into the Catalytic Mechanism of Middle East Respiratory Syndrome 3C-Like Protease and Severe Acute Respiratory Syndrome 3C-Like Protease Hao Wang, Shuai He, Weilong Deng, Ying Zhang, Guobang Li, Jixue Sun, Wei Zhao, Yu Guo, Zheng Yin, Dongmei Li,* and Luqing Shang *. ACS Catal. 2020, 10, 5871−5890. DOI: 10.1021/acscatal.0c00110