

通过分子对接、虚拟筛选、MD结合生物活性实验,中科院上药所柳红团队获得了GLP-1R的亚微摩尔级别的正变构调节剂,为设计B类GPCR的小分子药物开辟了新的途径。
背景介绍
胰高血糖素样肽-1受体(GLP-1R)是分泌素样B类G蛋白偶联受体(GPCR)的一员,是治疗II型糖尿病的主要靶点。GLP-1R被肠促胰岛素肽GLP-1激活后表现出广泛的生理效应,包括葡萄糖依赖的胰岛素分泌和生物合成、抑制胰高血糖素释放、胰腺β细胞存活、改善胰岛素敏感性和延迟胃排空。
目前发现的作为GLP-1R激动剂的小分子,包括Boc5、RGT1383、TTP273(vTv Therapeutics/华东医药)、PF-06882961(辉瑞)和LY3502970(Chugai/Eli Lily),其中TTP273、PF-06882961和LY3502970已经进入了临床阶段。虽然最近在GLP-1R结构生物学上取得了突破,但已经揭示了一些临床候选分子的结合位点及其相近的类似物都在螺旋束中占据相似的结合位点,部分与GLP-1的原位点重叠。RGT1383作为GLP-1R的全激动剂,几乎与GLP-1的10−20残基占据的位置完全重叠。
除激动剂的开发外,GLP-1R正变构调节剂(PAMs)的发现可以增强天然肽的亲和力和功效,这是一种很有前景的策略,变构调节剂能够提供更好的受体亚型选择性和药物安全性。在没有正构配体的情况下,PAMs不发挥任何药理作用,并显示出配体依赖的信号偏倚,可以精细控制受体功能和减少副作用。最近报道的几种GLP-1R变构调节剂大多存在未知的结合位点和不利的物理化学性质,如效力弱、固有亲电性和高分子量,这些都阻碍了这些先导化合物的进一步开发。
在本研究中,通过靶向假定的隐变构位点,作者发现了GLP-1R新的PAMs,如L7(1)。通过进一步优化得到了PAM L7-028(2),其通过亚微摩尔级的生物活性增强了GLP-1的结合亲和力和cAMP信号通路。分子动力学模拟和定点突变解释了L7-028诱导正变构的机制。针对GLP-1R模拟模型的变构位点,作者发现了具有不同化学型的新的PAMs C5(3)和C16(4)。并进一步研究了这些PAMs引起的GLP-1R的下游信号谱,这可能为针对B类GPCRs的治疗提供有价值的信息。
GLP-1R PAMs的发现
GLP-1R PAMs的发现是通过高通量筛选得到的。作者基于CRF1R的结构(PDB:4K5Y) 构建了具有深跨膜口袋的人GLP-1R同源模型(图1a),并对该口袋利用分子对接筛选了Specs数据库中的20多万种商业化合物。最终选择了24种结构多样的类药化合物进行生物测定。
作者发现化合物L7(1)(图1B)能够增加高浓度下GLP-1的结合亲和力和cAMP的积累,并对L7的两个结构域进行了SAR分析,以确定可能提高GLP-1R活性的结构变化。随后作者设计并合成了一系列新的苯并酰胺作为化合物L7的类似物。通过结构优化发现了L7-028。该化合物增加了与I-GLP-1的结合亲和力,EC50为11.01±2.73μM,并将竞争性放射性配体结合试验中与GLP-1的结合亲和力从7.6nM提高到2.9nM(图1C),还增强了GLP-1诱导的cAMP信号通路(图1D)。L7-028并没有促进配体诱导的CRF1R的激活,这表明其对GLP-1R具有选择性。
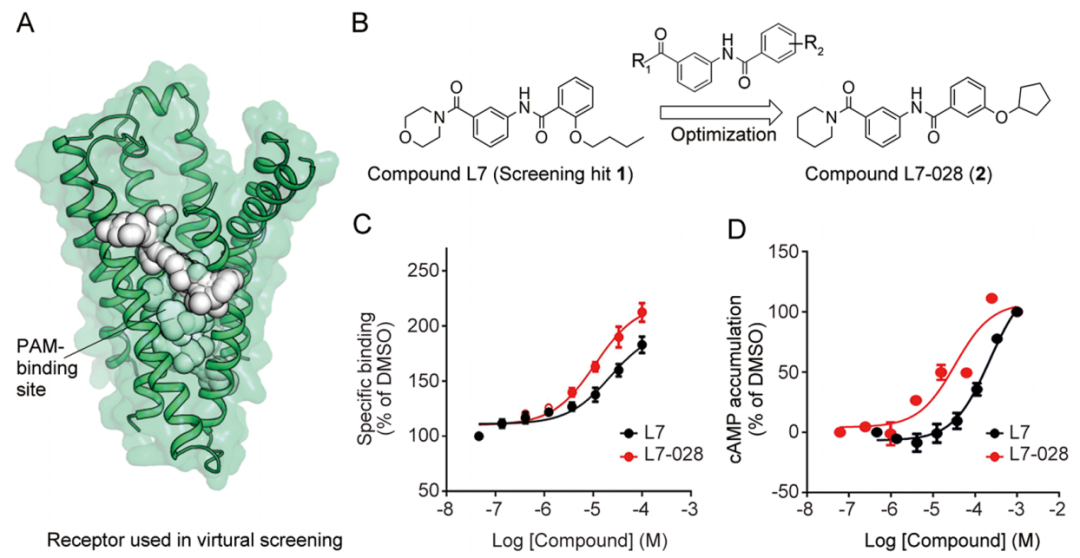
图1. GLP-1R PAMs 的Hit-to-lead优化。 图片来源:ACS Chem. Bio.
PAM结合口袋的表征
在虚拟筛选模型中,PAM结合口袋由跨膜螺旋TM3、TM5和TM6的一半组成,包含6个疏水残基和2个极性残基(图2A)。对接研究中,L7-028的对接打分为–10.3 kcal mol−1,表明其具有较高的结合亲和力。为识别关键残基,作者采用基于残基的能量分析来分解对接模型的配体结合能。结果表明,5个受体残基(Tyr2413.44b、Ile3175.47b、Phe3245.54b、Ile3576.46b和Leu3606.49b)表现出较低的范德尔能量分数(rosetta能量单位小于−2.0),表明它们可能是L7-028结合的主要贡献者,结合模式见图2B−D。
为了验证对接模型,作者将以上5个关键残基分别突变为丙氨酸,并在放射性配体结合试验中与野生型(WT)受体进行了比较(图2E)。Y241A、I317A和F324A的单点突变将L7-028对GLP-1的增强效应向右偏移。L357A和L360A突变体消除了PAM增强GLP-1结合的能力。实验结果与对接模型一致。
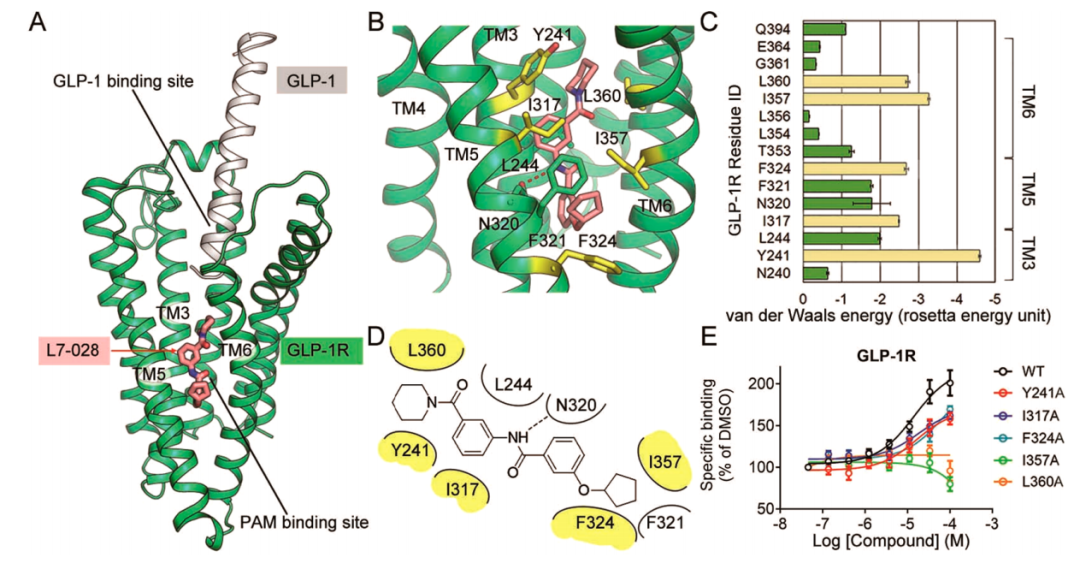
图2. L7-028在GLP-1R结合口袋上的特性。图片来源:ACS Chem. Bio.
MD揭示变构体作用的机理
在分子对接研究的基础上,作者建立了GLP-1R和L7-028的复合物模型。将该模型置于显式膜环境中建立复合物模拟系统。为了评估PAM的影响,作者又从复合物模型中移除L7-028,构建了apo GLP-1R系统。除此之外,作者还建立了一个GLP-1R/GLP-1/L7-028复合物模拟系统。每个系统都被独立重复模拟三次。
在GLP-1R/L7-028模拟中,与起始构象相比,L7-028向GLP-1结合袋的底部移动,并与跨膜螺旋TM7相互作用。除了对接模型中显示的配体结合残基外,MD模拟显示TM7残基Gln3947.49b与L7-028在72.2%的模拟轨迹中相互作用(图3A,B)。因为Gln3947.49b位于GLP-1结合口袋正下方,作者假设该残基在PAM增强的GLP-1结合中发挥了重要作用。随后作者设计了Q394A单点突变以证明假设。在放射性配体结合试验中,与WT相比,L7-028对突变体受体的正调节作用显著降低(图3C),与MD模拟结果一致。虽然在模拟中,L7-028向GLP-1结合袋移动,但在GLP-1R/GLP-1/L7-028系统中,PAM和GLP-1之间的平均最小距离为8.8±1.3Å,表明L7-028可能通过变构调节而不是与肽的直接相互作用来增强GLP与GLP-1R的结合。
在apo GLP-1R模拟中,TM3残基Tyr2413.44b与TM6残基Leu3606.49b之间的平均最小距离为4.0±0.6Å,表明这两个残基之间有稳定的相互作用(图3D)。此外,也可以观察到TM5残基Phe3215.51b和TM6残基Ile3576.46b之间的疏水相互作用,平均最小距离为4.0±0.4Å(图3D)。然而,这些相互作用因为L7-028的插入被破坏(图3E)。在GLP-1R/L7-028系统中,GLP-1结合位点与TM6之间的平均Cα原子距离为12.6±0.5Å,比apo系统长约2.5Å(10.1±0.5Å)(图3E)。在GLP-1R/L7-028系统中,TM3和TM5之间的平均距离大约比apo系统长3.0Å。L7-028使TM6螺旋远离GLP-1结合位点附近的跨膜螺旋TM3和TM5。GLP-1R/L7-028系统的螺旋间距离增加,GLP-1结合口袋增大 (图3G),GLP-1R/L7-028系统中GLP-1结合袋的平均溶剂可及表面积也大于apo系统。
MD模拟表明,L7-028可能会增加TM6螺旋与其他跨膜螺旋之间的距离,从而打开GLP-1结合袋以促进配体识别。为了验证这一假设,作者设计了G361F突变来模拟PAM的作用,该突变可能会破坏TM6螺旋与其他螺旋,包括TM3和TM5之间的密切相互作用,从而打开GLP-1结合袋。在放射性配体结合实验中,G361F突变体对GLP-1的亲和力(IC50=2.13±0.62nM)高于WT(IC50=14.38±3.75nM),支持了作者的假设(图3F)。
PAM结合位点由跨膜残基Tyr2413.44b、Ile3175.47b、Phe3245.54b、Ile3576.46b、Leu3606.49b和Gln3947.49b组成。分泌素样B类GPCRs中TM3−TM6界面的保守疏水残基Tyr2413.44b(或Phe3.44b)和Leu3606.49b(或Phe6.49b)可以与Ile3175.47b、Phe3245.54b和Ile3576.46b产生稳定的疏水相互作用,从而产生靠近GLP-1结合位点的TM3、TM5和TM6的紧密构象。同样,用一个大的侧链残基(苯丙氨酸)取代Gly3616.50b能够模拟PAM结合的效果,这有效地增加了GLP-1的亲和力。这一结果也与之前的研究一致,即I317C和G361C之间的二硫键限制了TM3、TM5和TM6的运动,从而锁定受体的非活性构象并消除配体结合。
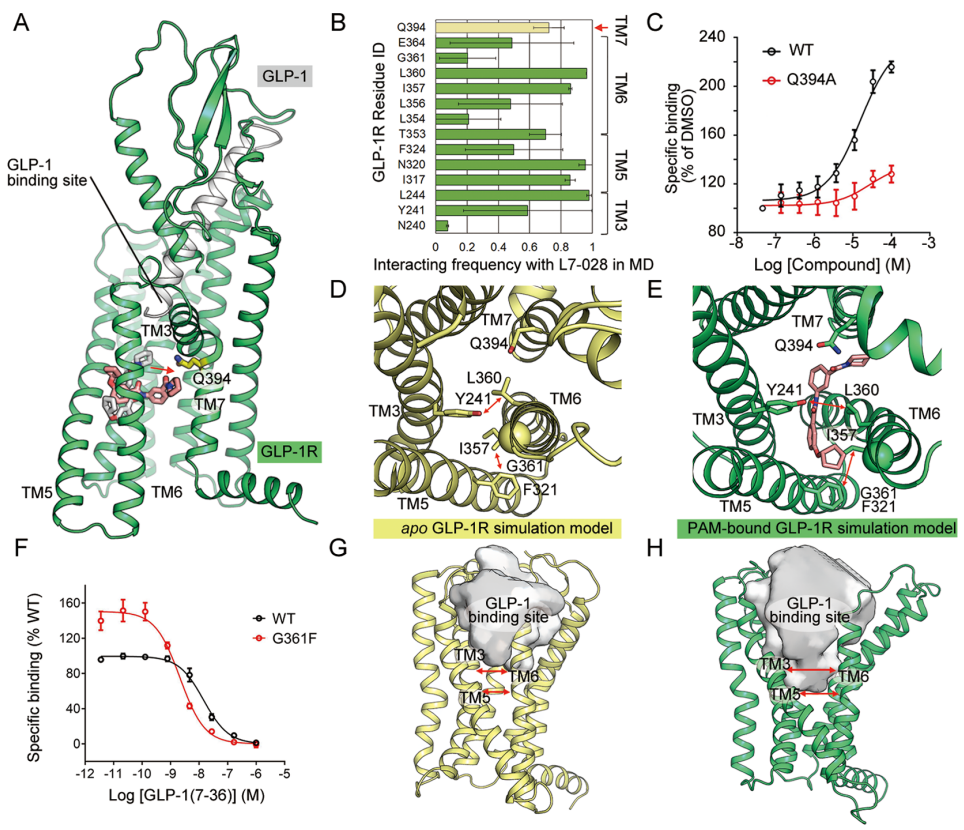
图3. MD模拟显示L7-028对GLP-1结合的正变构效应。图片来源:ACS Chem. Bio.
MD指导下的新PAMs的发现
根据上述分子机制,作者进一步利用MD模型来发现新的先导化合物。对从Specs数据库中筛选出的商业化合物与模拟的跨膜口袋进行了筛选(图4A)。作者只选择了与Y2413.44b、I3175.47b、F3245.54b、I3576.46b、L3606.49b和Q3947.49b相互作用的化合物,按此标准最终选择了20种结构多样的类药化合物来进行生物测定。研究发现,化合物C5和C16(图4B)显著提高了GLP-1的结合亲和力(图4C)。C5的EC50值为1.59±0.53μM,C16的值为8.43±3.82μM,均优于L7-028(EC50=11.01±2.73μM)。模拟配体结合袋中残基的替代减少或消除了C5和C16的正调节作用(图4D,E),表明它们与模拟跨膜袋结合。
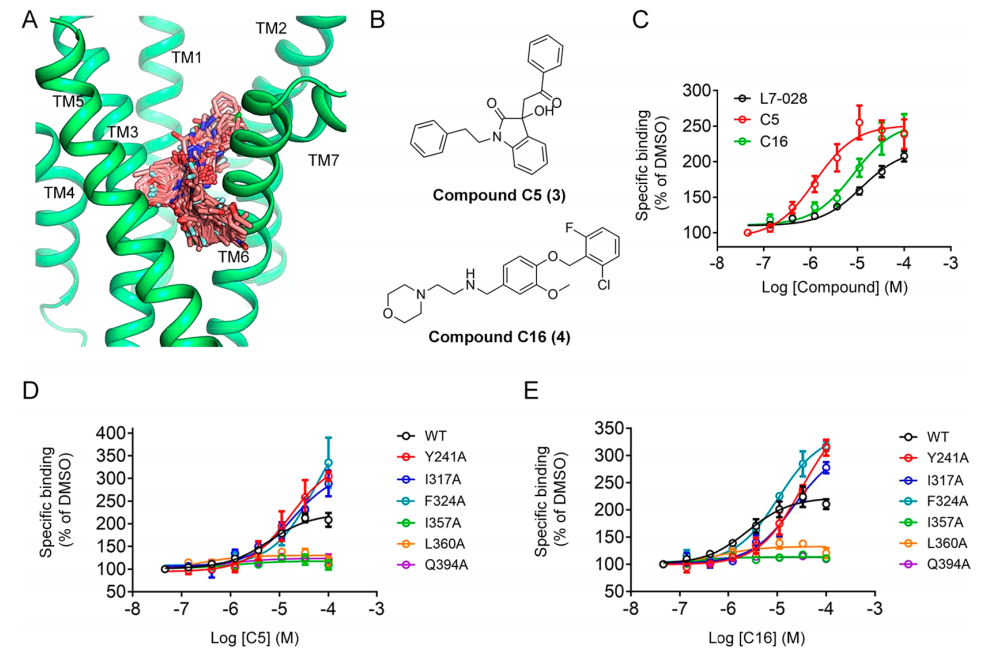
图 4. 基于MD模型的新PAMs的发现。图片来源:ACS Chem. Bio.
PAMs的信号
作者表征了L7-028、C5和C16在不同配体存在下的信号传导谱,包括多个临床使用的多肽。在cAMP积累试验中,三种化合物的GLP-1响应曲线左移程度相似(图5A和表1)。当阿必鲁肽存在时,C5比L7-028和C16增强其反应效果更好(图5B和表1)。然而,这三种PAMs对其他肽激动剂诱导的cAMP反应没有显著影响,表明存在探针选择性变构作用。
另一方面,L7-028、C5和C16对GLP-1诱导的β抑制素1/2招募有显著影响(图5C)。特别是,C5显著增强了GLP-1在该参数上的效价。这些结果表明,这三种PAM表现出不同的信号分布。C5增强的GLP-1刺激的β-抑制素1/2的招募要比增强的cAMP的积累更多。在其他肽激动剂中也观察到类似的信号调节。
针对所提出的PAM结合位点,作者发现了基于不同化学型的不同通路谱的小分子配体。它们的特性提供了新的骨架信息和一个可以合理设计具有GLP-1R信号偏倚的PAM框架。在一些T2DM患者中发现了低GLP-1水平,对治疗的响应有所降低,且β-抑制素1/2与GLP-1R介导的胰岛素分泌有关。因此,这里发现的PAMs可能为这种致命疾病提供一种新的治疗策略。
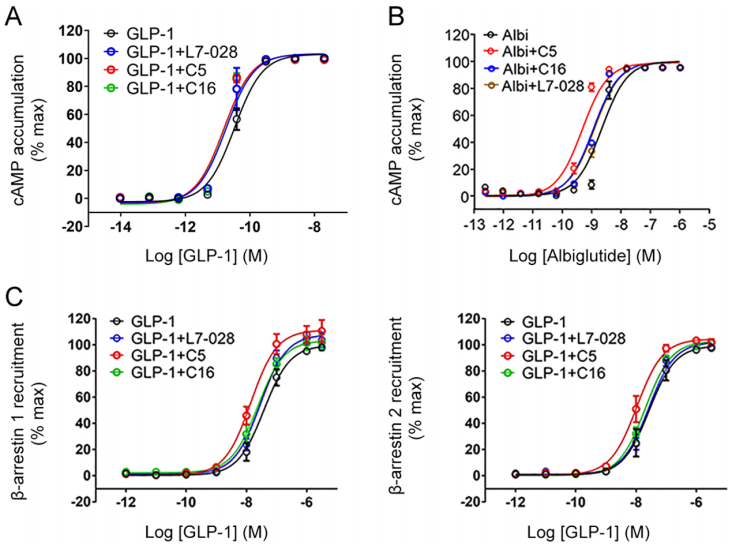
图5. L7-028, C5和C16的信号。图片来源:ACS Chem. Bio.
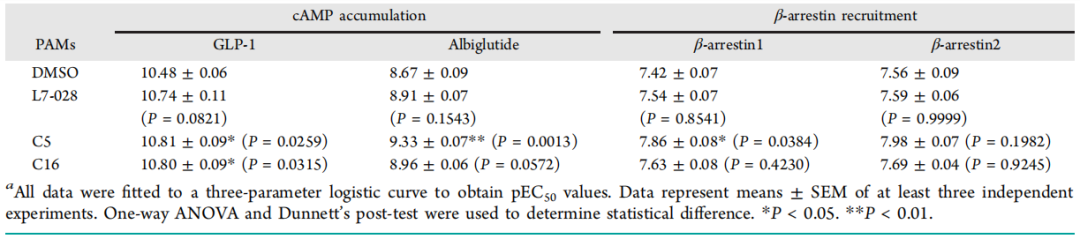
表1 PAMs对cAMP积累和β-抑制素招募的影响。表格来源:ACS Chem. Bio.
结论
作者通过虚拟筛选,MD和生物实验鉴定了多个具有不同化学骨架的GLP-1R PAMs,它们能够结合到一个隐蔽的变构位点。虽然作者的研究尚未得到具有较强活性的PAMs,但大量的优化和对具有更大化学多样性化合物的虚拟筛选将有助于提高靶向该位点的分子效力和药代动力学特性。化合物C5为GLP-1R新调节剂的开发提供了有用的信息。
参考文献
Wang J, Yang D, Cheng X, Yang L, Wang Z, Dai A, Cai X, Zhang C, Yuliantie E, Liu Q, Jiang H, Liu H, Wang MW, Yang H. Allosteric Modulators Enhancing GLP-1 Binding to GLP-1R via a Transmembrane Site. ACS Chem Biol. 2021 Nov 19;16(11):2444-2452. doi: 10.1021/acschembio.1c00552. Epub 2021 Sep 27. PMID: 34570476.