研究背景
纳米抗体(VHHs),以其分子量小、高稳定性、出色亲和力和易生成性,在生物医学领域备受关注。但要将这些骆驼源VHHs转化为医学治疗工具,人源化及序列优化是关键步骤。Merck公司和Scripps研究所领导的研究团队系统地人源化了两个骆驼源VHHs,针对自然细胞毒性受体NKp30,深入探究了影响其功能性的关键结构。

研究内容
1. 人源化及亲和力评价
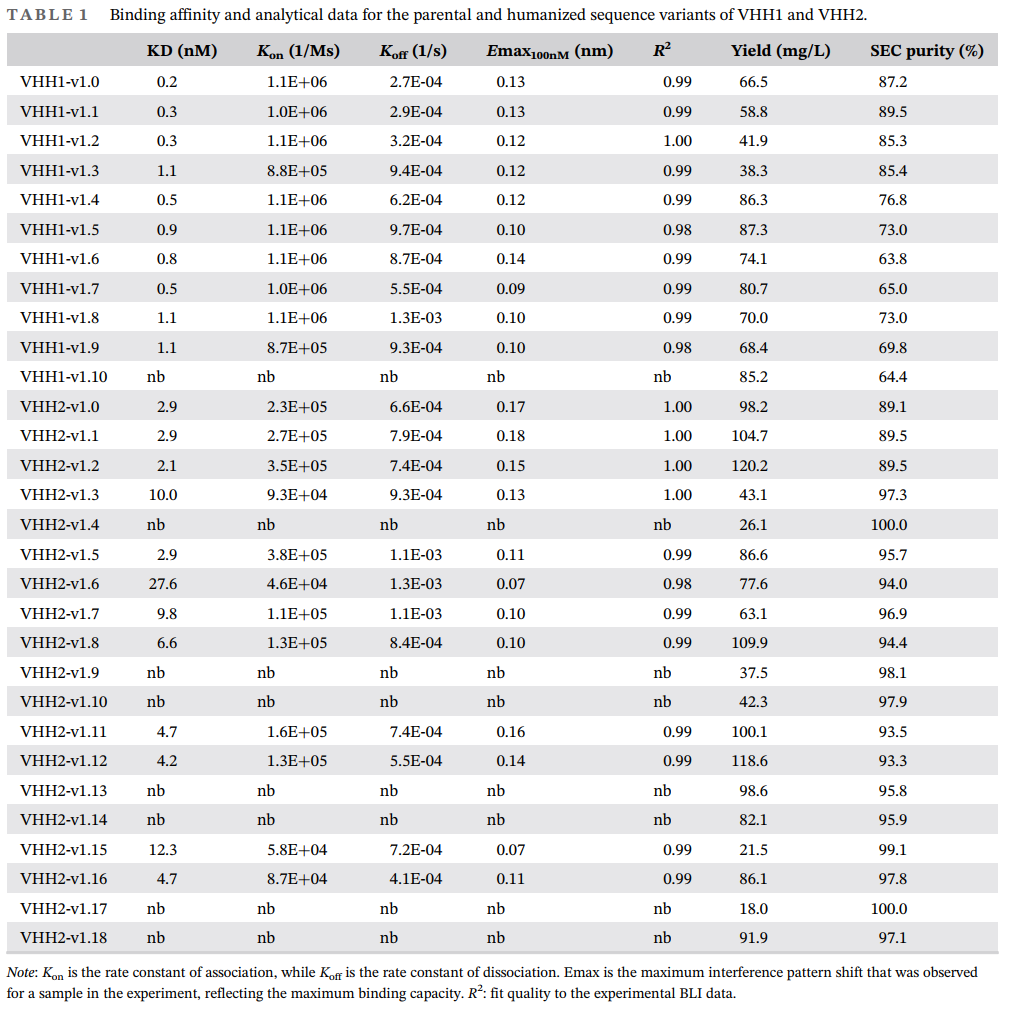
研究人员选择了骆驼源VHH1和VHH2作为研究对象,它们的抗原是自然细胞毒性受体NKp30。首先对VHH1和VHH2进行了人源化,将野生序列的CDR1-3区域移植到与其同源性最高的人源序列上,并对Vernier或Hallmark区域的关键残基进行突变获得突变体,总共设计获得了VHH1-v1.1- VHH1-v1.10的10个突变体和VHH2-v1.1- VHH2-v1.18的18个突变体。之后对人源化突变体的结合亲和力、产量和纯度进行了表征。

(1)VHH1变体的结合亲和力分析
除了VHH1-v1.10变体外,VHH1系列的所有变体均展现出强大的结合亲和力。特别是,VHH1对Vernier区的关键残基V87L的人源化表现出良好的耐受性。此外,VHH1的Hallmark残基VEHG在位置49(E49G)和50(H50L)的人源化对结合亲和力影响不大,但G52W突变则不被耐受。
(2)VHH2变体的结合亲和力分析
VHH2的人源化对其结合亲和力产生了显著影响。例如,VHH2-v1.3变体的结合亲和力显著下降,而VHH2-v1.16变体则保持了较低的亲和力损失。Vernier和Hallmark区域的残基替换对VHH2的功能特性至关重要,尤其是Hallmark残基F42V的突变,显著降低了结合亲和力,凸显了这些残基在维持VHH2功能中的核心作用。
(3)非典型二硫键的功能多样性
在VHH1中,非典型二硫键的存在对其功能至关重要,而在VHH2中则未观察到此类二硫键。这一发现表明,非典型二硫键在不同VHHs序列中可能扮演着不同的角色,对VHHs的结构和功能多样性有着重要影响。
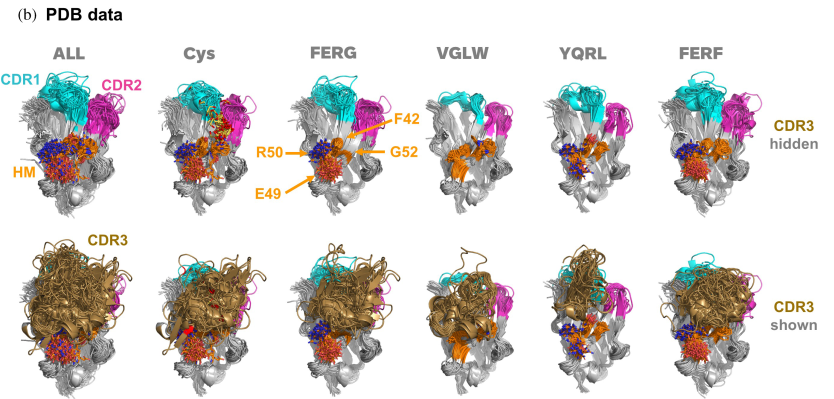
2. 结构分析
研究人员尝试对与人类NKp30胞外域复合的两个亲本VHH结构进行晶体化。成功获得了NKp30-VHH2复合物的结构(PDB ID: 9FWW),以及单独VHH1的高分辨率结构(PDB ID: 9FXF)。进一步利用AlphaFold2预测了NKp30-VHH1复合物的结构,发现预测结果与实验晶体结构高度一致,验证了预测结构的准确性,为深入分析提供了坚实基础。
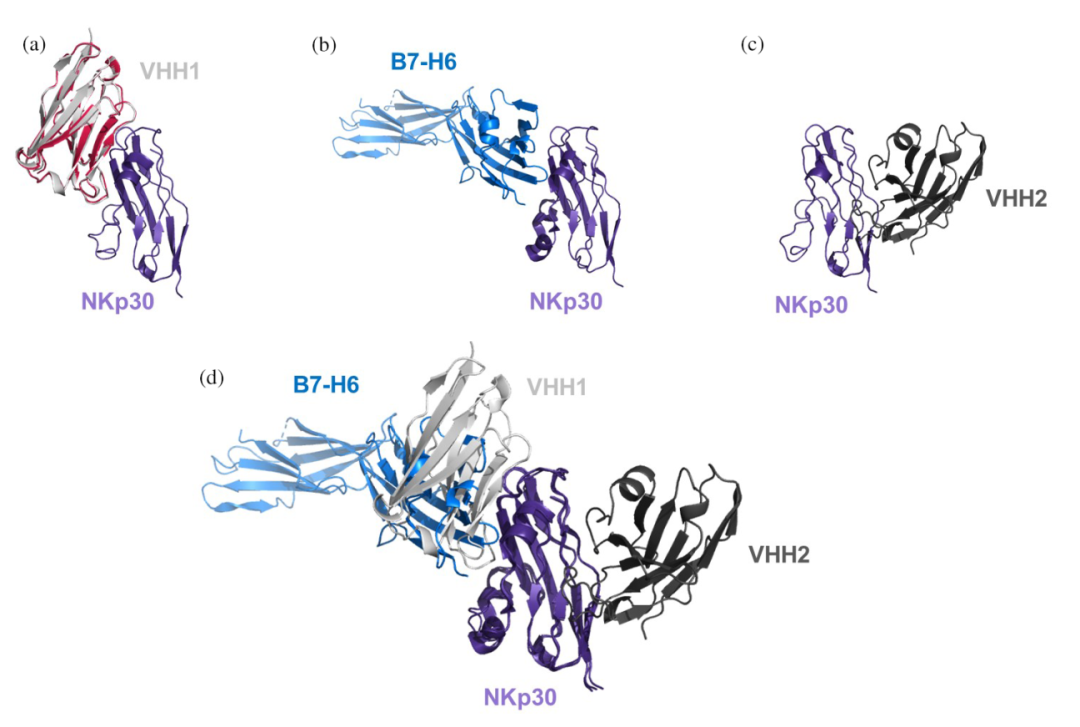
(1)结构活性关系(SAR)分析揭示关键作用机制
研究人员对两组抗原-抗体复合物进行结构活性关系(SAR)分析,发现VHH1中的非典型二硫键对于维持CDR3环的生物活性构象至关重要,而VHH2中的Hallmark残基在维持CDR3环的稳定性和抗原结合中发挥了关键作用。
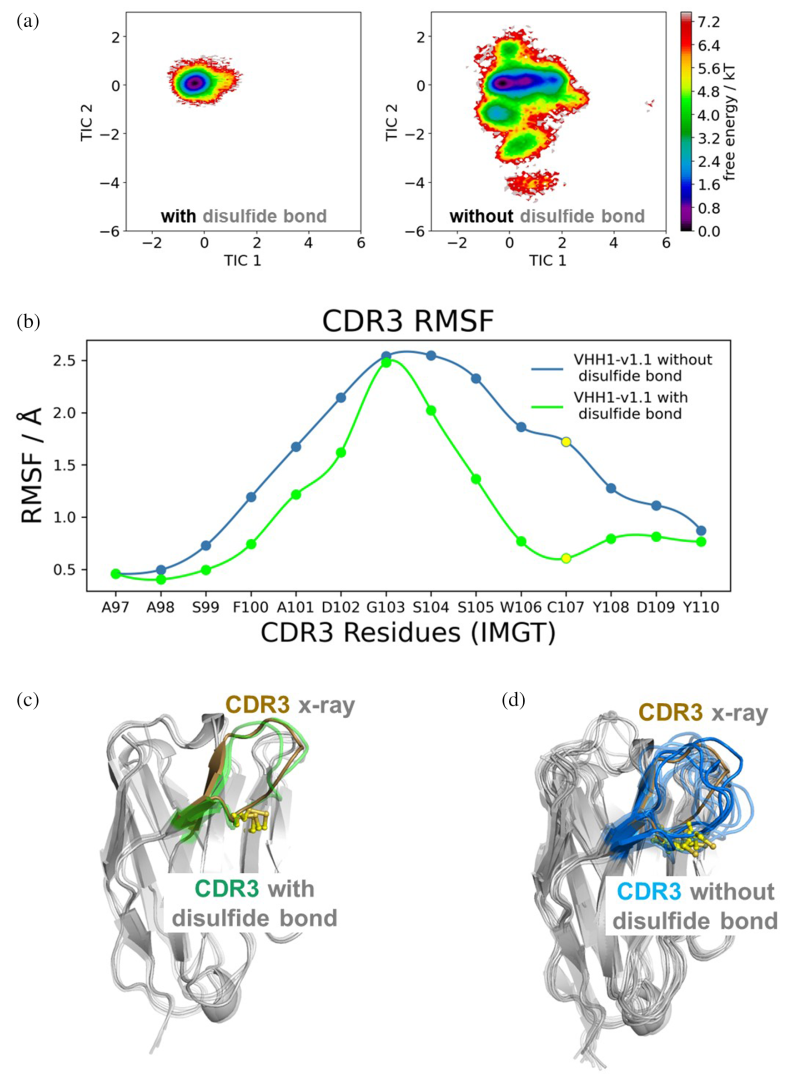
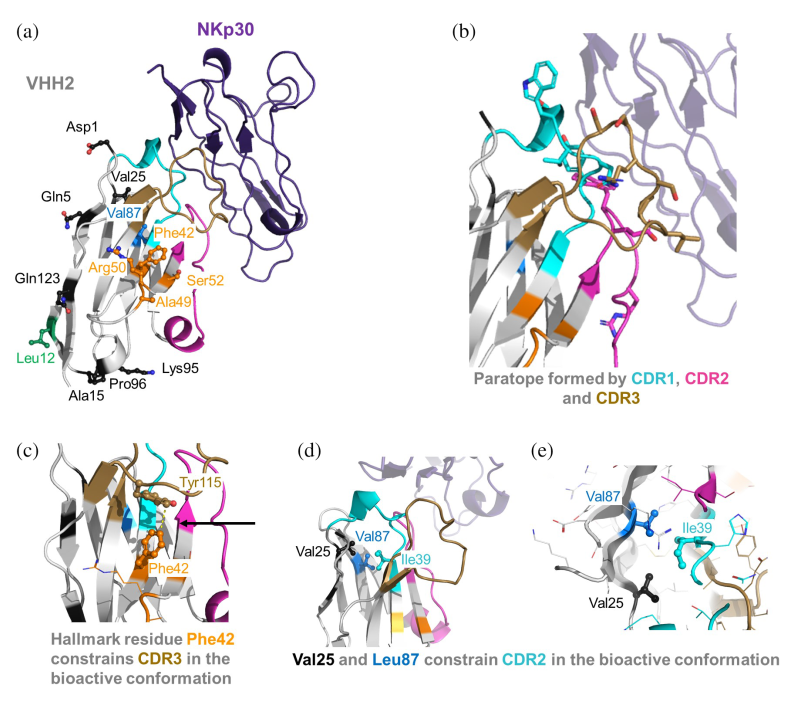
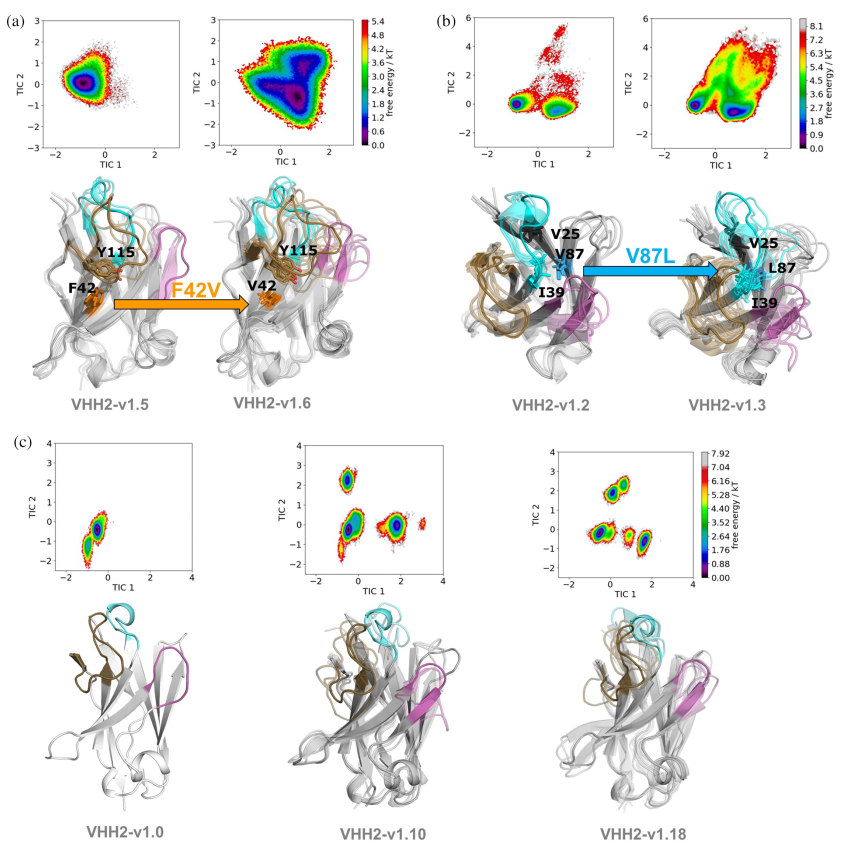
(2)分子动力学模拟揭示人源化影响
同时研究人员还对VHH1和VHH2的变体进行了分子动力学模拟,以评估特定Hallmark残基突变对构象多样性和结合亲和力的影响,模拟结果表明,人源化过程可能通过增加VHHs的构象多样性来影响其结合亲和力,这一发现对于指导VHHs的优化和人源化具有重要价值。
3. 数据挖掘
根据上述结构分析结果,研究人员对现有VHH NGS数据集和642个PDB结构数据进行了系统分析。
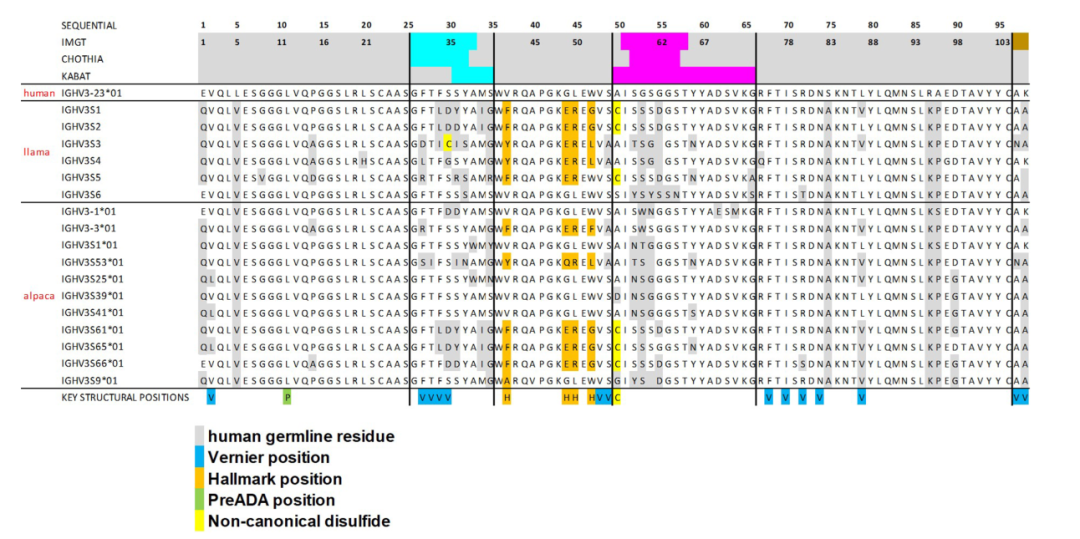
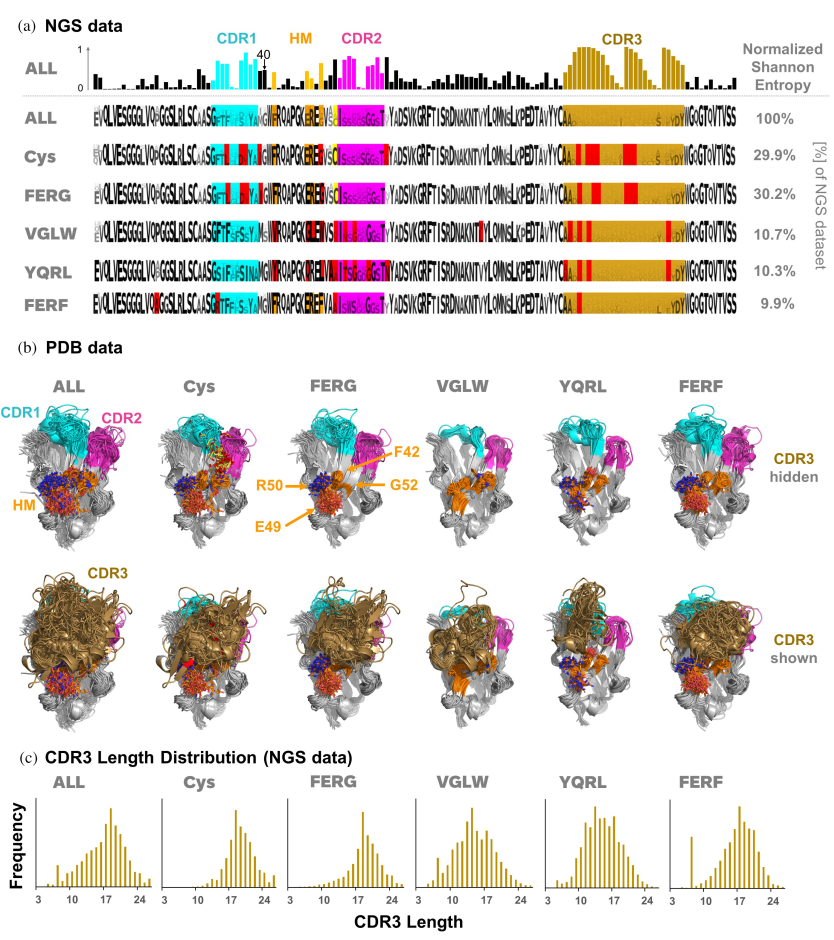
通过计算VHH序列中Hallmark区域的氨基酸位置间的标准互信息(Normalized Mutual Information,简写NMI,是一种用于评估两个数据分区之间相似性的指标,它基于信息论中的互信息,并对其进行标准化,使得结果在不同的分区规模下具有可比性)和结构关联分析,揭示这些位置间的相互依赖性和结构上的相关性。发现Hallmark基序在VHHs中具有多样性,并且与不同的抗原结合模式相关联。这一发现表明,Hallmark基序的差异可能直接影响VHHs的抗原识别和结合能力,从而影响其功能性。而非典型二硫键在VHHs中普遍存在,并且对于维持VHHs的稳定性和功能性构象至关重要。这些二硫键可能作为一种补偿机制,替代了传统抗体中轻链的作用,为VHHs提供了额外的结构支持和功能多样性。
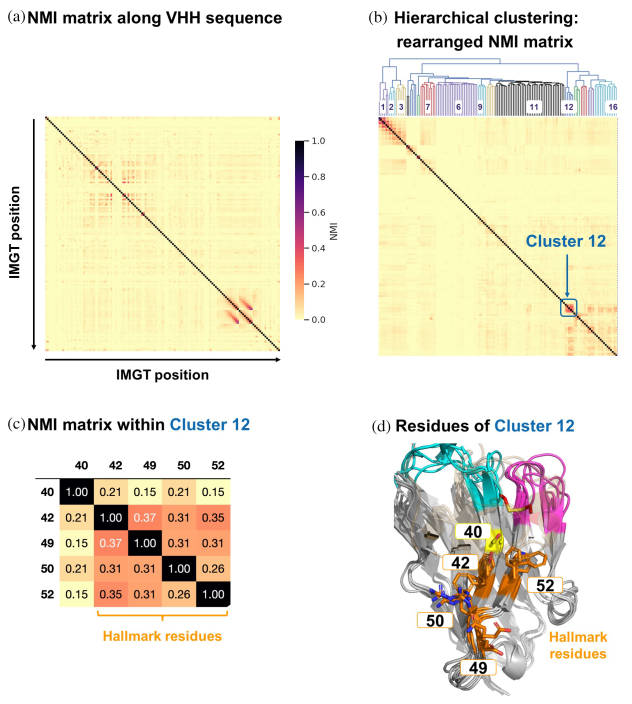
研究结论
该研究通过实验表征、结构解析、结构预测、SAR分析、分子动力学模拟以及NGS和PDB数据的系统分析等,揭示了Hallmark残基和非典型二硫键在维持VHHs的生物活性构象中的关键作用。
结语
这项突破性的研究不仅推动了我们对VHHs结构和功能的理解,也为未来的药物开发和生物医学研究开辟了新的道路。让我们一起期待VHHs在治疗领域的更多创新应用!
扩展阅读
Wecomput(唯信计算)致力于”计算技术驱动创新药研发”,基于对创新药物研发流程的深刻理解,融合人工智能、生物物理、高性能计算等技术,打造了独具特色的自动化、智能化、数字化的药物分子生成、设计与模拟平台,有望革新传统药物发现方式,驱动小分子、蛋白质、抗体、mRNA等创新药物的研发进程。核心团队成员来自国际知名AI制药公司、头部药企、知名互联网公司、985高校,在制药、生命科学、人工智能、软件开发等交叉领域有丰富的经验、深刻的理解和饱满的热情。
母公司北京中大唯信科技有限公司于2015年注册成立,入选国家高新技术企业,2021年获红杉资本股权投资,并入选NVIDIA Inception计划资深会员。至今,Wecomput已服务海内外数百家客户,涵盖众多生物医药企业、高校、医院、科研机构,并倾力打造了自主知识产权的分子数字化智能计算平台WeMol。欲了解更多信息,请访问官网www.wecomput.com,或关注公众号“唯信wecomput”。
WeMol(wemol.wecomput.com)是Wecomput开发的面向生物制药、材料、化学等领域的新一代分子数字化智能计算平台,集成了计算生物学、人工智能、量子化学等领域的上百种Wecomput自研及开源的计算与可视化模块,核心算法的速度、准确度超过或媲美国外主流商业软件,尤其特色的抗体人源化设计、蛋白质免疫原性预测、虚拟亲和力成熟、高通量虚拟筛选、RNA序列设计等算法已在多家知名药企的数十个药物发现项目中得到验证和广泛应用。WeMol基于先进的流式架构,可将复杂计算流程简单化、自动化,并支持低代码定制开发和灵活扩展,是业界首款同时面向计算科学家及非计算专业的湿实验人员,旨在构建一个简单、易用、智能、可扩展、可追溯、可重现的一站式计算平台,全方位覆盖大分子生物药设计、小分子化合物设计、分子模拟、数据分析等应用场景,可对Hit->Lead->PCC各阶段进行全链条赋能。发布至今,WeMol已获得了国内外数百家药企及学术单位的青睐与好评。